Sulfid měďnatý - Copper(I) sulfide
 | |
| Jména | |
|---|---|
| Název IUPAC Sulfid měďnatý | |
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.040.751 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Cu2S | |
| Molární hmotnost | 159,16 g / mol |
| Hustota | 5,6 g / cm3 [1] |
| Bod tání | 1130 ° C (2070 ° F; 1400 K)[2] |
| Nerozpustný | |
| Rozpustnost | málo rozpustný v HCl; rozpustný v NH4ACH; rozpustí se KCN; rozkládá se HNO3, H2TAK4 |
| Nebezpečí | |
| Bod vzplanutí | Nehořlavé |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | TWA 1 mg / m3 (jako Cu)[3] |
REL (Doporučeno) | TWA 1 mg / m3 (jako Cu)[3] |
IDLH (Okamžité nebezpečí) | TWA 100 mg / m3 (jako Cu)[3] |
| Související sloučeniny | |
jiný anionty | Oxid měďnatý Měď (I) selenid |
jiný kationty | Sulfid nikelnatý Sulfid měďnatý Síran zinečnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Sulfid měďnatý je sirník měďnatý, chemická sloučenina z měď a síra. Má chemickou sloučeninu Cu2S. V přírodě se vyskytuje jako minerál chalcocite. Má úzký rozsah stechiometrie od Cu1.997S až Cu2.000S.[4]
Příprava a reakce
Cu2S lze připravit silným zahřátím mědi v parách síry nebo H2S.[2] Reakce měděného prášku v roztavené síře rychle produkuje Cu2S, zatímco měděné pelety vyžadují mnohem vyšší teplotu.[5]Cu2S reaguje s kyslíkem za vzniku SO2:[6]
- 2 Cu2S + 3 O.2 → 2 Cu2O + 2 SO2
Při výrobě mědi se oxidují dvě třetiny roztaveného sulfidu mědi, jak je uvedeno výše, a Cu2O reaguje s neoxidovaným Cu2S dát Cu kov:[6]
- Cu2S + 2 Cu2O → 6 Cu + SO2
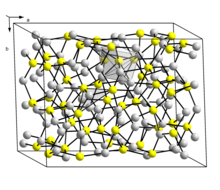
Struktura
Existují dvě formy Cu2S: nízkoteplotní monoklinická forma („low-chalcocite“), která má složitou strukturu s 96 atomy mědi v jednotkové buňce[7] a hexagonální forma stabilní nad 104 ° C.[8] V této struktuře je 24 krystalograficky odlišných atomů Cu a struktura byla popsána jako přibližná hexagonální těsně uspořádané řadě atomů síry s atomy Cu v rovinné 3 koordinaci. Této struktuře byla původně přidělena ortorombická buňka kvůli twinningu krystalu vzorku.
Existuje také krystalograficky odlišná fáze (minerál djurleite ) se stechiometrií Cu1.96S který je nestechiometrický (rozsah Cu1.934S-Cu1.965S) a má monoklinickou strukturu s 248 mědi a 128 atomy síry v jednotkové buňce.[7] Cu2S a Cu1.96S jsou podobného vzhledu a je těžké je od sebe odlišit.[9]
Viz také
- Sulfid měďnatý pro přehled všech fází sulfidu měďnatého
- Monosulfid měďnatý, CuS
- Chalkokit
- Djurleite
Reference
- ^ Patnaik, Pradyot (2002). Handbook of Anorganic Chemicals. McGraw-Hill, ISBN 0-07-049439-8
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1984). Chemie prvků. Oxford: Pergamon Press. str. 1373. ISBN 978-0-08-022057-4.
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0150". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Potter, R. W. (1977). „Elektrochemické zkoumání systému měď-síra“. Ekonomická geologie. 72 (8): 1524–1542. doi:10,2113 / gsecongeo.72.8.1524.
- ^ Blachnik R., Müller A. (2000). „Vznik Cu2S z prvků I. Měď používaná ve formě prášků ". Thermochimica Acta. 361: 31. doi:10.1016 / S0040-6031 (00) 00545-1.
- ^ A b Wiberg, Egon a Holleman, Arnold Frederick (2001) Anorganická chemie, Elsevier ISBN 0-12-352651-5
- ^ A b Evans, H. T. (1979). „Djurleite (Cu1.94S) a nízký chalcocite (Cu2S): Nové studie krystalové struktury “. Věda. 203 (4378): 356–8. doi:10.1126 / science.203.4378.356. PMID 17772445.
- ^ Wells A.F. (1984) Strukturní anorganická chemie, 5. vydání, Oxford Science Publications, ISBN 0-19-855370-6
- ^ Evans H.T. (1981). „Koordinace mědi u nízkých chalkokitů a djurleitů a dalších sulfidů bohatých na měď“ (PDF). Americký mineralog. 66 (7–8): 807–818.
