Cyklohexenon - Cyclohexenone - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 2-cyklohexenon | |||
| Ostatní jména 1-cyklohex-2-enon | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3DMet | |||
| 1280477 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.012.021 | ||
| Číslo ES |
| ||
| 2792 | |||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C6H8Ó | |||
| Molární hmotnost | 96.129 g · mol−1 | ||
| Vzhled | Čirá bezbarvá kapalina | ||
| Hustota | 0,993 g / ml [1] | ||
| Bod tání | −53 ° C (−63 ° F; 220 K)[1] | ||
| Bod varu | 171 až 173 ° C (340 až 343 ° F; 444 až 446 K)[1] | ||
| 41,3 g / l (25 ℃) | |||
| Nebezpečí | |||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H226, H301, H310, H319, H330, H331 | |||
| P210, P233, P240, P241, P242, P243, P260, P261, P262, P264, P270, P271, P280, P284, P301 + 310, P302 + 350, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P311, P320, P321, P322, P330 | |||
| NFPA 704 (ohnivý diamant) | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 220 mg kg−1 (krysa, orální) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Cyklohexenon je organická sloučenina což je univerzální meziprodukt používaný v syntéza různých chemických produktů, jako jsou léčiva a vonné látky.[2] Je to bezbarvá kapalina, ale komerční vzorky jsou často žluté.
Průmyslově se cyklohexenon připravuje z fenol podle Snížení břízy.[3]
Cyklohexenon je a keton, nebo přesněji enone. Mezi běžné reakce patří přidání nukleofilního konjugátu s organokoptická činidla, Michaelovy reakce a Robinsonovy anulace.[4][5]
Syntéza
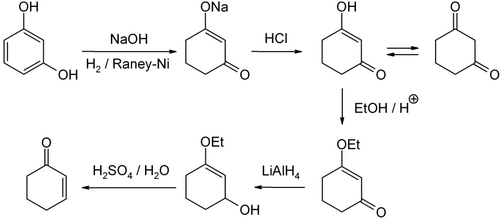
Existuje několik způsobů výroby cyklohexenonu. Pro laboratorní měřítko lze vyrobit z resorcinol přes 1,3-cyklohexandion.[6]
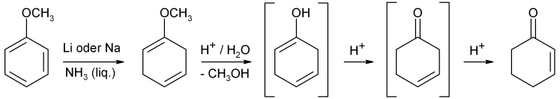
Cyklohexenon se získá Snížení břízy z anisol následuje kyselá hydrolýza.
Lze jej získat z cyklohexanonu a-bromací následovanou působením báze. Hydrolýza 3-chlorcyklohexenu s následnou oxidací cyklohexenolu je dalším způsobem.
Cyklohexenon se průmyslově vyrábí katalytickou oxidací cyklohexenu, například s peroxid vodíku a vanadium katalyzátory. Několik patentů popisuje různá oxidační činidla a katalyzátory.
Reakce
Cyklohexenon je široce používaným stavebním kamenem v chemii organické syntézy, protože nabízí mnoho různých způsobů rozšíření molekulárních struktur.
Jako enone, cyklohexenon se snadno přizpůsobuje Michael navíc s nukleofily (např enoláty nebo silyl enol ethery), nebo jej může použít a Diels-Alderova reakce s bohatým na elektrony dienes. Dále tato sloučenina reaguje s organické sloučeniny mědi z 1,4-adice (Michaelova adice), nebo s Grignardovými činidly 1,2-adicí, tj. s atakováním nukleofilu na karbonylovém atomu uhlíku. Cyklohexenon se také používá ve vícestupňové syntéze při konstrukci polycyklických přírodních produktů. Je to prochirální.
Se silnými základnami jsou pozice 4 a 6 (dva CH2-skupiny karbonylové skupiny a sousední dvojné vazby C-C) jsou deprotonovány.
Cyklohexenon je in-vitro katalyzátor pro relativně mírné dekarboxylace z alfa aminokyseliny.[7] [8]
Reference
- ^ A b C Cyklohexenon na Sigma-Aldrich
- ^ Podraze, K.F. Org. Přípravka. Postup. Int.1991, 23, s. 217.
- ^ Organické stavební bloky chemického průmysluHarry H. Szmant, ISBN 978-0-471-85545-3
- ^ Michael G. Organ a Paul Anderson (1996). „Přidání karbonylu a konjugátu k cyklohexenonu: experimenty ilustrující selektivitu reagencií“. Journal of Chemical Education. 73 (12): 1193. doi:10.1021 / ed073p1193.
- ^ Tetrahedron Lett. 34, 3881, (1993)
- ^ R. B. Thompson (1947). "Dihydroresorcinol". Organické syntézy. 27: 21. doi:10.15227 / orgsyn.027.0021.
- ^ Vědci v Japonsku se pokoušeli použít t-butylperoxid jako katalyzátor pro dekarboxylaci za použití volby rozpouštědla cyklohexanol. Zvědavě zjistili, že když použili cyklohexanol nižší čistoty (např. Technický stupeň, 98%), reakce probíhala až 4krát rychleji ve srovnání s použitím relativně čistého cyklohexanolu (> 99,3%). Zjistili, že cyklohexanol obsahuje cyklohexenon jako přirozenou nečistotu, která byla třikrát hojnější v technicky čistém cyklohexenonu ve srovnání s čištěnějším cyklohexanolem (~ 0,3% oproti ~ 0,1%). Další výzkum ukázal, že 1% cyklohexenonu v cyklohexanolu dekarboxyláci většiny alfa-aminokyselin, včetně nestandardních, s výtěžkem 80-95% během několika hodin. Výjimkou jsou určité aminokyseliny jako histidin, které údajně trvají více než 26 hodin, a místo toho je třeba najít polyaminokyseliny, které nedokážou dekarboxylovat pomocí 2-cyklohexenonu a jiným způsobem.Hashimoto, M; Eda, Y; Yasutomo, O; Toshiaki, I; Aoki, S (1986). „Nová dekarboxylace alfa-aminokyselin. Jednoduchá metoda dekarboxylace za použití 2-cyklohexen-1-onu jako katalyzátoru.“. Chemické dopisy. 15 (6): 893–896. doi:10,1246 / cl.1986,893. Citováno 4. ledna 2016.
- ^ Laval, G; Golding, B (2003). "Sekvence v jedné nádobě pro dekarboxylaci α-aminokyselin". Synlett (4): 542–546. doi:10,1055 / s-2003-37512. Citováno 4. ledna 2016.