Sigmatropní reakce - Sigmatropic reaction
A sigmatropní reakce v organická chemie je pericyklická reakce kde čistý výsledek je jeden σ-vazba se v nekatalýze změní na jinou σ-vazbu intramolekulární reakce.[1] Název sigmatropní je výsledkem a složení dlouho zavedeného označení sigma od singlu uhlík –Uhlíkové vazby a řecké slovo tropos, což znamená obrat. V tomto typu přesmyková reakce, a substituent pohybuje se z jedné části a π-vázané systému do jiné části při intramolekulární reakci se současným přeskupením systému π.[2] Pravé sigmatropické reakce jsou obvykle nekatalyzované Lewisova kyselina katalýza je možné. Sigmatropické reakce mají často katalyzátory na bázi přechodného kovu, které tvoří meziprodukty v analogických reakcích. Nejznámější ze sigmatropních přesmyků jsou [3,3] Vyrovnejte přeskupení, Claisenův přesmyk, Carroll přesmyk a Fischerova syntéza indolu.
Přehled sigmatropních posunů
Woodward – Hoffmanova nomenklatura sigmatropického posunu
Sigmatropické přesmyky jsou výstižně popsány v objednat období [i, j], který je definován jako migrace vazby σ sousedící s jedním nebo více systémy π do nové polohy (i − 1) a (j − 1) atomy odstraněn z původního umístění vazby σ.[3] Když je součet i a j sudé číslo, znamená to zapojení neutrálního řetězce všech atomů C. Liché číslo je známkou zapojení nabitého atomu C nebo heteroatomového osamělého páru, který nahrazuje dvojnou vazbu CC. Tím pádem, [1,5] a [3,3] směny se stávají [1,4] a [2,3] posuny s heteroatomy při zachování úvah o symetrii. Vodíky jsou ve třetím příkladu kvůli jasnosti vynechány.
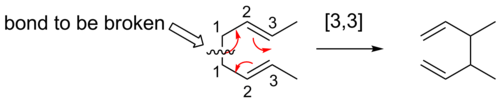
Vhodným prostředkem k určení pořadí daného sigmatropního přeskupení je spočítat atomy vazby, která je přerušena, jako atom 1, a poté spočítat atomy v každém směru od přerušené vazby k atomům, které tvoří novou vazbu σ v produkt, číslování postupně. Čísla, která odpovídají atomům tvořícím novou vazbu, jsou poté oddělena čárkou a umístěna do závorek, aby se vytvořil deskriptor pořadí sigmatropních reakcí.[4]
V případě migrace atomů vodíku lze použít podobnou techniku. Při určování pořadí sigmatropického posunu zahrnujícího migraci atomu vodíku je zásadní počítat přes všechny atomy zapojené do reakce, nikoli pouze přes nejbližší atomy. Například následující migrace atomu vodíku je řádu [1,5], dosažená počítáním proti směru hodinových ručiček systémem π, spíše než označení pořadí [1,3] kruhem CH2 skupina, která by omylem vyústila, kdyby se počítala ve směru hodinových ručiček.
Jako obecný přístup lze jednoduše nakreslit přechodový stav reakce. Pro sigmatropní reakci bude přechodový stav sestávat ze dvou fragmentů, které jsou spojeny formujícími se a rozbíjejícími se vazbami σ. Sigmatropická reakce je pojmenována jako [i,j] -sigmatropní přesmyk (i ≤ j) pokud tyto dva fragmenty sestávají z i a j atomy. To je znázorněno níže a příslušné fragmenty jsou zobrazeny barevně.
Suprafacial a antarafacial směny
V zásadě ke všem sigmatropickým posunům může dojít buď se zadržením, nebo s inverzí geometrie migrující skupiny, v závislosti na tom, zda původní spojovací lalok migrujícího atomu nebo jeho druhého laloku se používá k vytvoření nové vazby.[4]
V případech stereochemický retence se migrující skupina překládá bez rotace do vazebné polohy, zatímco v případě stereochemické inverze se migrující skupina jak rotuje, tak překládá, aby dosáhla své konformace.
Dalším stereochemickým přechodovým efektem, který je stejně schopný produkovat inverzní nebo retenční produkty, je to, zda migrující skupina zůstane po původní vazbě na původní ploše systému π nebo se místo toho přenese na opačnou stranu systému π. Pokud migrující skupina zůstává na stejné ploše systému π, je posun známý jako nadprofesionální, zatímco pokud se migrující skupina přenese na opačnou tvář, nazývá se antarafacialní posun,[3] které jsou nemožné pro transformace, ke kterým dochází v malých nebo středních prstencích.
Třídy sigmatropních přeskupení
[1,3] směny
Termální hydridové posuny
V tepelný [1,3] hydrid posun, hydrid pohybuje třemi atomy. The Woodward – Hoffmann vládne diktovat, že to bude probíhat v antarafacial směně. Ačkoli je takový posun povolen symetrií, Mobius topologie požadované v přechodový stav zakazuje takový posun, protože je geometricky nemožný, což odpovídá skutečnosti, že enoly neizomerujte bez kyselina nebo základna katalyzátor.[4]
Termální alkylové posuny
Termální posuny alkyl [1,3], podobné posunům [1,3] hydridu, musí probíhat antarafacialně. Zde je geometrie přechodového stavu prohibitivní, ale alkylová skupina, vzhledem k povaze svých orbitalů, může převrátit svou geometrii, vytvořit novou vazbu se zadním lalokem svého sp3 na oběžné dráze, a proto postupují suprafaciálním posunem. Tyto reakce stále nejsou běžné sloučeniny s otevřeným řetězcem kvůli vysoce uspořádané povaze přechodového stavu, kterého je snadněji dosaženo v cyklický molekuly.[4]
Fotochemické [1,3] směny
Fotochemické [1,3] směny by měly probíhat prostřednictvím suprafacialních směn; většina z nich však není koordinovaná, protože postupují prostřednictvím a stav tripletů (tj. mít a diradical mechanismus, na který se pravidla Woodward-Hoffmann nevztahují).[4]
[1,5] směny
Posun [1,5] zahrnuje posun o 1 substituent (hydrid, alkyl nebo aryl ) dolů 5 atomů systému π. Ukázalo se, že vodík se posouvá jak u cyklických sloučenin, tak u sloučenin s otevřeným řetězcem při teplotách nad nebo nad 200 ° C.[4] Předpokládá se, že tyto reakce budou probíhat suprafaciálně prostřednictvím přechodového stavu Hückel-topologie.
Foto ozáření by vyžadovalo antarafacialní posun vodíku. I když jsou vzácné, existují příklady, kde jsou upřednostňovány antarafacialní směny:[5]
Na rozdíl od posunů vodíku [1,5] nebyl u sloučeniny s otevřeným řetězcem nikdy pozorován [1,5] alkylový posun.[4] Bylo však provedeno několik studií hodnotit preference pro [1,5] alkylové posuny v cyklických systémech: karbonyl a karboxyl > hydrid> fenyl a vinyl >> alkyl.[6][7]
Alkylové skupiny podléhají [1,5] posunům velmi špatně, obvykle však vyžadují vysoké teploty cyklohexadien „teplota pro alkylové posuny není mnohem vyšší než teplota pro karbonyly, nejlepší migrační skupinu. Studie ukázala, že je to proto, že alkylové posuny na cyklohexadienech probíhají jiným mechanismem. Nejprve se kruh otevře, následuje posun [1,7] a poté se prsten reformuje elektrocyklicky:[8]
Stejný mechanický proces je vidět níže, bez konečné elektrocyklické reakce uzavírání kruhu, v interkonverzi lumisterolu na vitamin D2.
[1,7] směny
[1,7] sigmatropické posuny jsou podle pravidel Woodwarda-Hoffmanna předpovídány tak, že budou postupovat antarafacialně, prostřednictvím přechodového stavu topologie Mobius. Antarafacial [1,7] posun je pozorován při převodu lumisterol na Vitamín D2, kde po otevření elektrocyklického kruhu na previtamin D2, a methyl posuny vodíku.[9]
Bicyklické nonatrieny také procházejí [1,7] posuny v tzv chůze přeskupení,[10] což je posun o dvojmocný skupina, jako součást tříčlenného kruhu, v a bicyklická molekula.
[3,3] směny
[3,3] sigmatropické posuny jsou dobře prostudovány sigmatropní přesmyky. Pravidla Woodward – Hoffman předpovídají, že těchto šestelektron reakce by probíhaly suprafaciálně prostřednictvím přechodového stavu topologie Hückel.
Claisenův přesmyk
Objeveno v roce 1912 Rainer Ludwig Claisen, Claisenův přesmyk je prvním zaznamenaným příkladem [3,3] -sigmatropního přesmyku.[11][12][13] Toto přeskupení je užitečné uhlík -uhlík pouto -formování reakce. Příkladem Claisenova přesmyku je [3,3] přesmyk z allyl vinyl éter, který při zahřátí poskytne y, 8-nenasycený karbonyl. Tvorba karbonylové skupiny činí tuto reakci, na rozdíl od jiných sigmatropních přesmyků, ze své podstaty nevratnou.
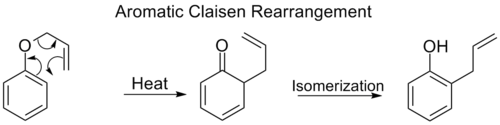
Aromatický Claisenův přesmyk
The ortho-Claisenův přesmyk zahrnuje [3,3] posun o allylfenylether na meziprodukt, který rychle tautomerizuje na ortho-substituovaný fenol.
Když oba ortho pozice na benzen zablokované, dojde k druhému [3,3] přeskupení. Tento para-Claisenův přesmyk končí tautomerací na tri-substituovaný fenol.
Vyrovnejte přeskupení
The Vyrovnejte přeskupení je rozsáhle studován organická reakce zahrnující [3,3] sigmatropní přeskupení 1,5-dienů.[14][15][16] Byl vyvinut společností Arthur C. Cope. Například 3,4-dimethyl-1,5-hexadien zahřátý na 300 ° C poskytne 2,6-oktadien.
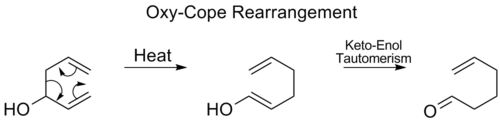
Oxy-Cope přesmyk
V oxy-Cope přesmyk, a hydroxyl skupina je přidána na C3 a tvoří enal nebo enon po keto-enol tautomerismus meziproduktu enol:[17]
Carroll přesmyk
The Carroll přesmyk je přesmyková reakce v organická chemie a zahrnuje transformaci β-keto allyl ester na a-allyl-p-ketokarboxylovou kyselinu.[18] Tato organická reakce je doprovázena dekarboxylace a konečným produktem je y, 5-allylketon. Carrollův přeskupení je adaptací Claisenův přesmyk a efektivně a dekarboxylativní allylace.
Fischerova syntéza indolu
The Fischerova syntéza indolu je chemická reakce který produkuje aromatické látky heterocyklus indol z (substituovaného) fenylhydrazin a aldehyd nebo keton pod kyselé podmínky.[19][20] Reakci objevil v roce 1883 Hermann Emil Fischer.
Výběr kyselého katalyzátoru je velmi důležitý. Bronstedovy kyseliny jako HCl, H2TAK4, kyselina polyfosforečná a kyselina p-toluensulfonová byly úspěšně použity. Lewisovy kyseliny jako fluorid boritý, chlorid zinečnatý, chlorid železitý, a chlorid hlinitý jsou také užitečné katalyzátory.
Bylo publikováno několik recenzí.[21][22][23]
[5,5] Směny
Podobně jako [3,3] posuny, pravidla Woodward-Hoffmana předpovídají, že [5,5] sigmatropické posuny budou probíhat suprafacialně, Hückelův topologický přechodový stav. Tyto reakce jsou vzácnější než [3,3] sigmatropické posuny, ale je to hlavně funkce skutečnosti, že molekuly, které mohou podstoupit [5,5] posuny, jsou vzácnější než molekuly, které mohou podstoupit [3,3] posuny.[4]
[2,3] směny
Příklad a 2,3-sigmatropní přesmyk je 2,3-Wittigův přesmyk:
Chůze přeskupení
Migrace dvojmocné skupiny, jako je např Ó, S, N –R nebo C – R2, který je součástí tříčlenného kruhu v bicyklické molekule, se běžně označuje jako chůze. Toto lze formálně charakterizovat podle pravidel Woodward-Hofmanna jako (1, n) sigmatropický posun.[24] Příkladem takového přeskupení je posun substituentů na tropilidenes (1,3,5-cykloheptatrieny). Při zahřátí prochází systém pí elektrocyklickým uzavíráním prstenců a vytváří bicykl [4,1,0] heptadien (norkaradien). Poté následuje [1,5] alkylový posun a otevření elektrocyklického kruhu.
Očekává se, že při procházení směnou [1,5] bude procházkové přeskupení norcaradienů probíhat suprafaciálně se zachováním stereochemie. Experimentální pozorování však ukazují, že 1,5-posuny norcaradienů probíhají antarafacialisticky.[25] Teoretické výpočty shledal posun [1,5] jako a diradical procesu, ale bez zapojení jakéhokoli diradikálu minima na povrch potenciální energie.[26]
Viz také
Reference
- ^ Carey, F.A. a R.J. Sundberg. Pokročilá organická chemie Část A ISBN 0-306-41198-9
- ^ „Sigmatropické přesmyky“. Chemistry LibreTexts.
- ^ A b Woodward, R.B.; Hoffmann, R. Zachování orbitální symetrie. Verlag Chemie Academic Press. 2004. ISBN 0-89573-109-6.
- ^ A b C d E F G h Miller, Bernard. Pokročilá organická chemie. 2. vyd. Horní sedlo: Pearson Prentice Hall. 2004. ISBN 0-13-065588-0
- ^ Kiefer, E.F .; Tana, C.H. J. Am. Chem. Soc., 1969, 91, 4478. doi:10.1021 / ja01044a027
- ^ Fields, D.J .; Jones, D.W .; Kneen, G. Chemická komunikace 1976. 873 – 874. doi:10.1039 / C39760000873
- ^ Miller, L.L .; Greisinger, R .; Boyer, R.F. J. Am. Chem. Soc. 1969. 91. 1578. doi:10.1021 / ja01034a076
- ^ Schiess, P .; Dinkel, R. Čtyřstěn dopisy, 1975, 16, 29, 2503. doi:10.1016/0040-4039(75)80050-5
- ^ Carey, Francis A; Sundberg, Richard J (2000). Pokročilá organická chemie. Část A: Struktura a mechanismy (4. vydání). New York: Kluwer Academic / Plenum. str.625. ISBN 0-306-46242-7.
- ^ Klaerner, F.G. Agnew. Chem. Mezinárodní Vyd. Eng., 1972, 11, 832.doi:10,1002 / anie.197208321
- ^ Claisen, L.; Ber. 1912, 45, 3157. doi:10.1002 / cber.19120450348
- ^ Claisen, L .; Tietze, E .; Chemische Berichte 1925, 58, 275. doi:10.1002 / cber.19250580207
- ^ Claisen, L .; Tietze, E .; Chemische Berichte 1926, 59, 2344. doi:10,1002 / cber.19260590927
- ^ Cope, A. C.; et al. J. Am. Chem. Soc. 1940, 62, 441. doi:10.1021 / ja01859a055
- ^ Hoffmann, R .; Stohrer, W. D. J. Am. Chem. Soc. 1971, 93, 25, 6941–6948. doi:10.1021 / ja00754a042
- ^ Dupuis, M .; Murray, C .; Davidson, E. R. J. Am. Chem. Soc. 1991, 113, 26, 9756–9759. doi:10.1021 / ja00026a007
- ^ Berson, Jerome A .; Jones, Maitland. J. Am. Chem. Soc. 1964, 86, 22, 5019–5020. doi:10.1021 / ja01076a067
- ^ Carrol, M. F. Journal of the Chemical Society 1940, 704–706. doi:10.1039 / JR9400000704.
- ^ Fischer, E .; Jourdan, F. Chemische Berichte 1883, 16, 2241.doi:10,1002 / cber.188301602141
- ^ Fischer, E .; Hess, O. Chemische Berichte 1884, 17, 559. doi:10,1002 / cber.188401701155
- ^ van Orden, R. B .; Lindwell, H. G. Chem. Rev. 1942, 30, 69–96. doi:10.1021 / cr60095a004
- ^ Robinson, B. Chem. Rev. 1963, 63, 373–401. doi:10.1021 / cr60224a003
- ^ Robinson, B. Chem. Rev. 1969, 69, 227–250. doi:10.1021 / cr60262a003
- ^ Jensen, F. J. Am. Chem. Soc., 1989, 111, 13, 4643 – 4647. doi:10.1021 / ja00195a018
- ^ Klarner, F.G. Témata ve stereochemii, 1984, 15, 1–42. ISSN 0082-500X
- ^ Kless, A .; Nendel, M .; Wilsey, S .; Houk, K. N. J. Am. Chem. Soc., 1999, 121, 4524. doi:10.1021 / ja9840192







![[1,3] Alkylové směny](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/1%2C3alkylfixed.png/550px-1%2C3alkylfixed.png)
![[1,5] hydridový posun v cyklickém systému](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/1%2C5hydridecyclicfixed.png/300px-1%2C5hydridecyclicfixed.png)
![Antarafacialní [1,5] hydridový posun](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/1%2C5hantarafacialfixed.png/600px-1%2C5hantarafacialfixed.png)








![[5,5] posun fenylpentadienyletheru](http://upload.wikimedia.org/wikipedia/commons/thumb/2/25/5%2C5shiftfixeds.png/800px-5%2C5shiftfixeds.png)

