Dess – Martin periodinane - Dess–Martin periodinane
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 3-oxo-1,3-dihydro-lλ52-benzjodoxol-1,1,1 -triyltriacetát | |
| Ostatní jména Dess – Martin periodinane | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.197.885 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C13H13IO8 | |
| Molární hmotnost | 424,14 g / mol |
| Vzhled | bílý prášek, hranolky, krystaly nebo krystalické prášek a / nebo kousky |
| Hustota | 1,362 g / cm3 pevný |
| Bod tání | 103 až 133 ° C (217 až 271 ° F; 376 až 406 K) |
| Související sloučeniny | |
Související sloučeniny | Kyselina 2-jodoxybenzoová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
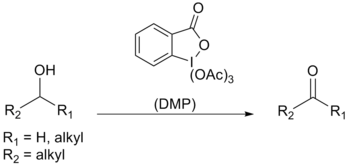
Dess – Martin periodinane (DMP) je chemické činidlo použitý v Dess – Martinova oxidace, oxidující primární alkoholy na aldehydy a sekundární alkoholy na ketony.[1][2] Tento periodinan má několik výhod oproti chrom - a DMSO - oxidanty na bázi, které zahrnují mírnější podmínky (pokojová teplota, neutrální pH), kratší reakční časy, vyšší výtěžky, zjednodušené zpracování, vysoká chemoselektivita, tolerance citlivých funkčních skupin a dlouhá skladovatelnost. Použití v průmyslovém měřítku je však obtížné kvůli jeho ceně a potenciálně výbušné povaze.[3] Je pojmenována podle amerických chemiků Daniela Benjamina Dessa a James Cullen Martin který vyvinul činidlo v roce 1983. Je založen na IBX, ale díky acetátovým skupinám připojeným k centrálnímu atomu jodu je DMP mnohem reaktivnější než IBX a je mnohem rozpustnější v organických rozpouštědlech.[4]
Příprava
Bylo zjištěno, že nejpřátelštější syntéza IBX je léčba Kyselina 2-jodbenzoová s oxon ve vodě při zvýšené teplotě po dobu 3 hodin.[5] IBX se poté acyluje pomocí Irska a Liu[6] úpravy původního postupu. Tyto úpravy umožňovaly vyšší výtěžky a zjednodušený postup zpracování. Výsledné pevné látky lze získat filtrací a promytím etherem. Irsko a Liu použily katalytické množství kyselina tosylová, což umožnilo dokončení reakce za méně než 2 hodiny (ve srovnání s klasickou syntézou s využitím 24 hodin) a ve výtěžcích přesahujících 90%.
Klasická metoda představená Boeckmanem a Mullinsem[7] zahrnoval ohřev řešení bromičnan draselný, kyselina sírová, Kyselina 2-jodbenzoová za získání IBX (l-hydroxy-l, 2-benzjodoxol-3 (lH) -on 1-oxidu, Kyselina 2-jodoxybenzoová ). IBX byl poté acylován pomocí kyseliny octové a anhydrid kyseliny octové.
Oxidační mechanismus
Dess – Martinův periodinan se používá hlavně jako oxidant pro komplexní, citlivé a multifunkční zařízení alkoholy. Jedním z důvodů jeho účinnosti je jeho vysoká selektivita vůči komplexaci hydroxyl skupina, která umožňuje alkoholům rychle fungovat ligand výměna; první krok v oxidační reakci.
Protonová NMR uvedla, že použitím jednoho ekvivalentu alkoholu se vytvoří meziprodukt diacetoxyalkoxyperiodinan. Acetát pak působí jako báze k deprotonaci a-H z alkoholu za vzniku karbonyl sloučenina, jodan a octová kyselina.
Když diol nebo se použije více než jeden ekvivalent alkoholu, místo toho se vytvoří acetoxydialkoxyperiodinan. V důsledku labilní Díky povaze tohoto konkrétního periodinanu dochází k oxidaci mnohem rychleji.[4]
Schreiber a spolupracovníci prokázali, že voda zvyšuje rychlost oxidační reakce.[8] Dess a Martin původně pozorovali, že oxidace ethanolu byla zvýšena, když existoval další ekvivalent ethanolu. Předpokládá se, že rychlost disociace konečného acetátového ligandu z jodu je zvýšena kvůli darování elektronů schopnost hydroxylové skupiny (tedy oslabení vazby I-OAc).[4]
Chemoselektivita
Za použití standardních Dess – Martinových periodinanových podmínek lze alkoholy bez ovlivnění oxidovat na aldehydy / ketony furan prsteny, sulfidy, vinylethery a sekundární amidy.[4] Allylalkoholy se snadno oxidují pomocí DMP, které se obvykle obtížně převádějí na jejich příslušné karbonyly pomocí typických oxidantů.[9]
Myers a spolupracovníci zjistili, že DMP může oxidovat N-chráněné aminoalkoholy bez epimerizace (na rozdíl od většiny ostatních oxidantů, včetně Swernovy oxidace). Tyto chráněné aminoalkoholy mohou být ve farmaceutickém průmyslu velmi důležité.[10]
Benzylové a allylalkoholy reagují rychleji než nasycené alkoholy,[4] zatímco DMP oxiduje aldoximy a ketoximy na příslušné aldehydy a ketony rychleji než primární, sekundární nebo benzylalkohol na příslušný karbonyl.[11]
V jednom příkladu Dess-Martinovy oxidace zahrnuje transformaci citlivého α-β-nenasyceného alkoholu na odpovídající aldehyd. Tato část byla nalezena v několika přírodních produktech a díky své vysoké funkčnosti by mohla být cenným syntetickým stavebním kamenem v organické syntéze. Thongsornkleeb a Danheiser oxidovali tento citlivý alkohol použitím oxidace Dess Martin a změnou postupu zpracování (ředění pentany, promytí poly (4-vinylpyridin ) k odstranění kyseliny octové generované během reakce, filtrace a zakoncentrování pomocí destilace.[12]
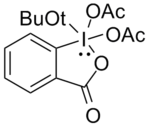
t-Butyl DMP
Difluoro a monofluoroalkoholy se obtížněji oxidují. Swernova oxidace bylo použito, ale musel být použit velký přebytek oxidantu a v některých případech nedal reprodukovatelné výsledky. Linderman a Graves[13] nalezen DMP byl ve většině případů úspěšný, ale nemohl tolerovat přítomnost nukleofilní funkční skupiny v alkoholu, protože tyto reagovaly s DMP vytěsněním acetátu. Použitím níže uvedené sloučeniny byly získány požadované karbonyly ve vysokých výtěžcích jako přídavek sloučeniny tert-butoxy skupina, kvůli jeho sterický objem, minimalizuje tyto vedlejší reakce.
Viz také
- Oxidace alkoholu
- Pyridiniumchlorchromát
- Jonesova oxidace
- Oppenauerova oxidace
- Pfitzner – Moffattova oxidace
- Parikh – Doeringova oxidace
- Albright-Goldmanova oxidace
- Swernova oxidace
- Corey – Kimova oxidace
- Oxidace Ley (TPAP oxidace)
- TEMPO oxidace
Reference
- ^ Dess, D. B .; Martin, J. C. (1983). „Snadno dostupný oxidant 12-I-5 pro přeměnu primárních a sekundárních alkoholů na aldehydy a ketony“. J. Org. Chem. 48 (22): 4155–4156. doi:10.1021 / jo00170a070.
- ^ Boeckman, Robert J .; George, Kelly M. (2009). „1,1,1-Triacetoxy-1,1-dihydro-1,2-benzjodoxol-3 (1 H) -on“. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rt157m.pub2. ISBN 978-0471936237.
- ^ Plumb, J.B .; Harper, D.J. (1990). „Chemická bezpečnost: kyselina 2-jodoxybenzoová“. Chem. Eng. Zprávy. 68: 3. doi:10.1021 / cen-v068n029.p002.
- ^ A b C d E Dess, D. B .; Martin, J. C. (1991). „Užitečný triacetoxyperiodinan 12-I-5 (Dess-Martinův jodistan) pro selektivní oxidaci primárních nebo sekundárních alkoholů a různých příbuzných druhů 12-I-5.“ J. Am. Chem. Soc. 113 (19): 7277–7287. doi:10.1021 / ja00019a027.
- ^ Frigerio, M .; Santagostino, M .; Sputore, S. (1999). „Uživatelsky přívětivý vstup do kyseliny 2-jodoxybenzoové (IBX)“. J. Org. Chem. 64 (12): 4537–4538. doi:10.1021 / jo9824596.
- ^ Irsko, R. E .; Liu, L. (1993). „Vylepšený postup pro přípravu Dess-Martinova periodinanu“. J. Org. Chem. 58 (10): 2899. doi:10.1021 / jo00062a040.
- ^ Boeckman Jr., R. K .; Shao, P .; Mullins, J. J. (2004). „Periodinan podle Desse-Martina“. Organické syntézy.; Kolektivní objem, 10, str. 696
- ^ Meyer, S. D .; Schreiber, S.L. (1994). „Zrychlení Dess-Martinovy oxidace vodou“. J. Org. Chem. 59 (24): 7549–7552. doi:10.1021 / jo00103a067.
- ^ Lawrence, N.J .; Crump, J.P .; McGown, A.T .; Hadfield, J.A. (2001). „Reakce produktů Baylis-Hillman s oxidačními činidly Swern a Dess-Martin“. Tetrahedron Lett. 42 (23): 3939–3941. doi:10.1016 / S0040-4039 (01) 00587-1.
- ^ Myers, A.G .; et al. (2000). "Syntéza vysoce epimerizovatelných N-chráněných _-aminoaldehydů s vysokým enantiomerním přebytkem". Tetrahedron Lett. 41: 1359. doi:10.1016 / S0040-4039 (99) 02293-5.
- ^ Chaudhari, S.S .; Akamanchi, K.G. (1999). "Mírná, chemoselektivní, oxidační metoda pro deoximaci s použitím Dess-Martinova periodinanu". Syntéza. 1999 (5): 760–764. doi:10,1055 / s-1999-3476.
- ^ Thongsornkleeb, C .; Danheiser, R.L. (2005). „Praktická metoda pro syntézu 2-alkynylpropenálů“. J. Org. Chem. 70 (6): 2364–2367. doi:10.1021 / jo047869a. PMC 2897060. PMID 15760233.
- ^ Linderman, R.J .; Graves, D.M. (1989). „Oxidace fluoralkyl-substituovaných karbinolů Dess-Martinovým činidlem“. J. Org. Chem. 54 (3): 661–668. doi:10.1021 / jo00264a029.