Nestechiometrická sloučenina - Non-stoichiometric compound - Wikipedia
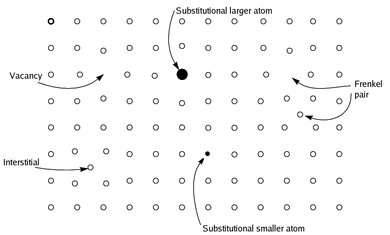
Nestechiometrické sloučeniny jsou chemické sloučeniny, téměř vždy pevné anorganické sloučeniny, které mají živel složení, jehož proporce nelze vyjádřit poměrem malých přirozená čísla; nejčastěji v takových materiálech chybí malé procento atomů nebo je příliš mnoho atomů zabaleno do jinak dokonalého mřížového díla.[není ověřeno v těle ]
Na rozdíl od dřívějších definic je moderní chápání nestechiometrických sloučenin považuje za homogenní, nikoli za směsi stechiometrických chemické sloučeniny.[není ověřeno v těle ] Vzhledem k tomu, že pevné látky jsou celkově elektricky neutrální, je vada kompenzována změnou náboje jiných atomů v pevné látce, buď změnou jejich oxidačního stavu, nebo jejich nahrazením atomy různých prvků odlišným nábojem. Mnoho oxidů a sulfidů kovů má nestechiometrické příklady; například stechiometrický oxid železitý, který je vzácný, má vzorec FeO, zatímco běžnější materiál je nestechiometrický, se vzorcem Fe0.95O. Typ rovnovážných defektů v nestechiometrických sloučeninách se může lišit podle doprovodných variací objemových vlastností materiálu.[1] Nestechiometrické sloučeniny také vykazují speciální elektrické nebo chemické vlastnosti kvůli vadám; například když chybí atomy, elektrony se mohou pohybovat pevnou látkou rychleji.[není ověřeno v těle ] Nestechiometrické sloučeniny mají aplikace v keramický a supravodivý materiálu a v elektrochemickém (tj. baterie ) návrhy systému.
Výskyt
Tato sekce potřebuje expanzi s: obecnější informace, se zdroji, o rozsahu výskytů tohoto jevu. Můžete pomoci přidávat k tomu. (Červenec 2015) |
Oxidy železa
Nonstoichiometry je všudypřítomná pro kov oxidy, zvláště když kov není na nejvyšší úrovni oxidační stav.[2]:642–644 Například i když wüstite (oxid železnatý ) má ideální (stechiometrický ) vzorec FeO, skutečná stechiometrie je blíže Fe0.95O. Nestechiometrie odráží snadnou oxidaci Fe2+ Fe3+ účinně nahradí malou část Fe2+ se dvěma třetinami jejich počet Fe3+. Tedy za každé tři „chybějící“ Fe2+ ionty, krystal obsahuje dva Fe3+ ionty k vyrovnání náboje. Složení nestechiometrické sloučeniny se obvykle mění úzkým způsobem v úzkém rozmezí. Proto je vzorec pro wüstite psán jako Fe1 − xO, kde X je malé číslo (v předchozím příkladu 0,05) představující odchylku od „ideálního“ vzorce.[3] Nestechiometrie je zvláště důležitá u pevných trojrozměrných polymerů, které mohou tolerovat chyby. Do určité míry entropie pohání všechny pevné látky za nestechiometrické. Ale pro praktické účely tento termín popisuje materiály, kde je nestechiometrie měřitelná, obvykle alespoň 1% ideálního složení.
Sulfidy železa

Monosulfidy přechodných kovů jsou často nestechiometrické. Nejznámější je nominálně sulfid železitý (minerál pyrhotit ) se složením Fe1−XS (X = 0 až 0,2). Vzácný stechiometrický FeS koncový člen je známý jako minerál troilite. Pyrhotan je pozoruhodný tím, že má mnoho polytypy, tj. krystalické formy lišící se symetrií (monoklinický nebo šestihranný ) a složení (Fe7S8, Fe9S10, Fe11S12 a další). Tyto materiály mají vždy nedostatek železa kvůli přítomnosti mřížových defektů, konkrétně volných míst železa. Přes tyto vady je složení obvykle vyjádřeno jako poměr velkého počtu a symetrie krystalů je relativně vysoká. To znamená, že železná volná místa nejsou náhodně rozptýlena po krystalu, ale tvoří určité pravidelné konfigurace. Tato volná místa silně ovlivňují magnetické vlastnosti pyrhotitu: magnetismus se zvyšuje s koncentrací volných míst a pro stechiometrický FeS chybí.[4]
Hydridy palladia
Hydrid palladnatý je nestechiometrický materiál přibližného složení PdHX (0.02 < X <0,58). Tato pevná látka vede vodík na základě mobility atomů vodíku v pevné látce.
Oxidy wolframu
Někdy je obtížné určit, zda je materiál nestechiometrický nebo zda je vzorec nejlépe reprezentován velkými čísly. Oxidy wolframu ilustrují tuto situaci. Počínaje idealizovaným materiálem oxid wolframový lze vytvořit řadu souvisejících materiálů, které mají mírný nedostatek kyslíku. Tyto druhy s nedostatkem kyslíku lze popsat jako WO3−X, ale ve skutečnosti jsou to stechiometrické druhy s velkými jednotkovými buňkami se vzorci WnÓ3n−2, kde n = 20, 24, 25, 40. Poslední druh lze tedy popsat stechiometrickým vzorcem W40Ó118, zatímco nestechiometrický popis WO2.95 znamená náhodnější rozdělení volných pracovních míst s oxidy.[Citace je zapotřebí ]
Ostatní případy
Při vysokých teplotách (1000 ° C), sulfidy titanu představují řadu nestechiometrických sloučenin.[2]:679
The koordinační polymer pruská modř, jmenovitě Fe7(CN)18 a je dobře známo, že se jejich analogy tvoří v nestechiometrických poměrech.[5]:114 Nestechiometrické fáze vykazují užitečné vlastnosti ve vztahu k jejich schopnosti vázat se cesium a thalium ionty.[Citace je zapotřebí ]
Aplikace
Oxidační katalýza
Mnoho užitečných sloučenin se vyrábí reakcemi uhlovodíky s kyslík, což je konverze katalyzovaný oxidy kovů. Proces probíhá přenosem „mřížkového“ kyslíku na uhlovodíkový substrát, což je krok, který dočasně generuje volné místo (nebo defekt). V následujícím kroku je chybějící kyslík doplněn O2. Takové katalyzátory spoléhají na schopnost oxidu kovu tvořit fáze, které nejsou stechiometrické.[6] Analogická řada událostí popisuje další druhy reakcí přenosu atomů včetně hydrogenace a hydrodesulfurizace katalyzované pevnými katalyzátory. Tyto úvahy také zdůrazňují skutečnost, že stechiometrie je určena vnitřkem krystalů: povrchy krystalů často nenásledují stechiometrii objemu. Složité struktury na površích jsou popsány výrazem „povrchová rekonstrukce“.
Iontové vedení
Migrace atomů v pevné látce je silně ovlivněna defekty spojenými s nestechiometrií. Tato defektní místa poskytují cesty pro atomy a ionty k migraci přes jinak hustý celek atomů, které tvoří krystaly. Kyslíkové senzory a baterie v pevné fázi jsou dvě aplikace, které se spoléhají na volná místa oxidů. Jedním z příkladů je Výkonný ředitel2-na základě senzor v automobilových výfukových systémech. Při nízkých parciálních tlacích O2, snímač umožňuje přívod zvýšeného množství vzduchu, aby došlo k důkladnějšímu spalování.[6]
Supravodivost
Mnoho supravodičů je nestechiometrických. Například, yttrium barnatý oxid měďnatý, pravděpodobně nejpozoruhodnější vysokoteplotní supravodič, je nestechiometrická pevná látka vzorce YXBa2Cu3Ó7−X. Kritická teplota supravodiče závisí na přesné hodnotě X. Stechiometrický druh má X = 0, ale tato hodnota může být až 1.[6]
Dějiny
Bylo to hlavně díky práci Nikolai Semenovich Kurnakov a jeho studenty, proti kterým Berthollet odmítá Proustův zákon Bylo prokázáno, že má zásluhy pro mnoho pevných sloučenin. Kurnakov rozdělil nestechiometrické sloučeniny na berthollides a daltonidy podle toho, zda jejich vlastnosti vykazovaly monotónní chování s ohledem na složení nebo ne. Termín berthollide byl přijat IUPAC v roce 1960.[7] Jména pocházejí Claude Louis Berthollet a John Dalton, kteří v 19. století prosazovali soupeřící teorie složení látek. Ačkoli Dalton z větší části „zvítězil“, později bylo zjištěno, že zákon definitivních rozměrů má důležité výjimky.[8]
Viz také
Reference
- ^ Geng, Hua Y .; et al. (2012). "Anomálie v nestechiometrickém oxidu uraničitém vyvolané pseudofázovým přechodem bodových vad". Phys. Rev. B. 85 (14): 144111. arXiv:1204.4607. doi:10.1103 / PhysRevB.85.144111.
- ^ A b N. N. Greenwood a A. Earnshaw, 2012, „Chemistry of the Elements“, 2. vydání, Amsterdam, NH, NLD: Elsevier, ISBN 0080501095viz [1], zpřístupněno 8. července 2015. [Čísla stránek označena horním indexem, vložená.]
- ^ Lesley E. Smart (2005). Solid State Chemistry: An Introduction, 3. vydání. CRC Press. p. 214. ISBN 978-0-7487-7516-3.
- ^ Hubert Lloyd Barnes (1997). Geochemie ložisek hydrotermální rudy. John Wiley and Sons. 382–390. ISBN 978-0-471-57144-5.
- ^ Kovově-organické a organické molekulární magnety Peter Day, Alan E Underhill Royal Society of Chemistry, 2007, ISBN 1847551394, ISBN 9781847551399
- ^ A b C Atkins, P. W .; Overton, T. L .; Rourke, J. P .; Weller, M. T .; Armstrong, F. A., 2010, Shriver and Atkins 'Anorganic Chemistry 5th Edn., Pp. 65, 75, 99f, 268, 271, 277, 287, 356, 409, Oxford, OXF, GBR: Oxford University Press, ISBN 0199236178viz [2], zpřístupněno 8. července 2015.
- ^ Trifluoridy vzácných zemin, část 2 Arxius de les Seccions de Ciències Dmitrii N. Khitarov, Boris Pavlovič Sobolev, Irina V. Alexeeva, Institut d'Estudis Catalans, 2000, str. ISBN 847283610X, ISBN 9788472836105
- ^ Henry Marshall Leicester (1971). Historické pozadí chemie. Publikace Courier Dover. p. 153. ISBN 9780486610535.
Další čtení
- F. Albert bavlna Geoffrey Wilkinson, Carlos A. Murillo a Manfred Bochmann, 1999, Advanced Anorganic Chemistry, 6. vydání, str. 202, 271, 316, 777, 888. 897 a 1145, New York, NY, USA: Wiley-Interscience, ISBN 0471199575viz [3], zpřístupněno 8. července 2015.
- Roland Ward, 1963, Nestechiometrické sloučeniny, Pokroky v chemii série, sv. 39, Washington, DC, USA: American Chemical Society, ISBN 9780841222076, DOI 10.1021 / ba-1964-0039, viz [4], zpřístupněno 8. července 2015.
- J. S. Anderson, 1963, „Aktuální problémy v nestechiometrii (kapitola 1),“ v Nestechiometrické sloučeniny (Roland Ward, ed.), S. 1–22, Pokroky v chemii série, sv. 39, Washington, DC, USA: American Chemical Society, ISBN 9780841222076, DOI 10.1021 / ba-1964-0039.ch001, viz [5], zpřístupněno 8. července 2015.
