Tetrahydropyran - Tetrahydropyran
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Oxan | |||
| Ostatní jména Tetrahydropyran, Oxacyklohexan, 1,5-epoxypentan | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.005.048 | ||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H10Ó | |||
| Molární hmotnost | 86.134 g · mol−1 | ||
| Hustota | 0,880 g / cm3 | ||
| Bod tání | -45 ° C (-49 ° F; 228 K) | ||
| Bod varu | 88 ° C (190 ° F; 361 K) | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Hořlavý, Dráždí kůži | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | -15,6 ° C (3,9 ° F; 257,5 K) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LDhle (nejnižší publikováno ) | 3000 mg / kg (orálně, potkan) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Tetrahydropyran (THP) je organická sloučenina sestávající z nasyceného šestičlenného kruhu obsahujícího pět atomů uhlíku a jeden atom kyslíku. Je pojmenován odkazem na pyran, který obsahuje dvě dvojné vazby a může být z něj vyroben přidáním čtyř vodíků. V roce 2013 byl preferovaný název IUPAC založen jako oxan.[1] Sloučenina je bezbarvá těkavá kapalina. Deriváty tetrahydropyranu jsou však běžnější. 2-Tetrahydropyranyl (THP-) ethery odvozené z reakce alkoholů a 3,4-dihydropyran se běžně používají jako chránící skupiny v organická syntéza.[2] Dále tetrahydropyran kruhový systém, tj. pět atomů uhlíku a kyslík, je jádrem pyranóza cukry, jako např glukóza.
Struktura a příprava
V plynné fázi existuje THP ve své nejnižší energii C.s konformace křesla symetrie.[3]
Jeden klasický postup pro organická syntéza tetrahydropyranu je o hydrogenace z 3,4-izomer z dihydropyran s Raney nikl.[4]
Tetrahydropyranylové deriváty
Přestože je tetrahydropyran neznámá sloučenina, běžně se používají tetrahydropyranylethery organická syntéza. Specificky je skupina 2-tetrahydropyranyl (THP) běžná chránící skupina pro alkoholy.[5][6] Alkoholy reagují s 3,4-dihydropyran čímž se získá 2-tetrahydropyranylether. Tyto ethery jsou odolné vůči různým reakcím. Alkohol lze později obnovit kyselinou katalyzovanou hydrolýza. Tato hydrolýza reformuje původní alkohol i 5-hydroxypentanal. Ethery THP odvozené od chirálních alkoholů tvoří diastereomery. Další nežádoucí vlastností je, že ethery zobrazují komplexní NMR spektra, která interferují s analýzou.[2]
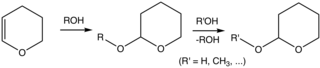 Ochrana alkoholu jako etheru THP s následnou deprotekcí. Oba kroky vyžadují kyselé katalyzátory.
Ochrana alkoholu jako etheru THP s následnou deprotekcí. Oba kroky vyžadují kyselé katalyzátory.
Typickým postupem je alkohol ošetřen 3,4-dihydropyran a str-toluensulfonová kyselina v dichlormethan při okolní teplotě.[2]

Alternativně může být THP ether generován za podmínek podobných podmínkám pro Mitsunobuova reakce. Na alkohol se tedy působí 2-hydroxytetrahydropyranylem, trifenylfosfin, a diethylazodikarboxylát (DEAD) v tetrahydrofuran (THF).
Běžně jsou ethery THP zbaveny ochrany za použití octová kyselina v roztoku THF / voda, strkyselina toluensulfonová ve vodě nebo Pyridinium str-toluensulfonát (PPTS) v ethanol.
Oxany
Oxany jsou třídou hexických cyklických etherových kruhů s tetrahydropyranem jako kořenovou chemikálií. Oxany mají jeden nebo více atomů uhlíku nahrazeny atomem kyslíku.[8] Preferovaný název IUPAC pro tetrahydropyran je nyní oxan.[9]
Viz také
Reference
- ^ „Nová organická nomenklatura IUPAC - chemické informace BULLETIN“ (PDF).
- ^ A b C Wuts, Peter G. M .; Greene, Theodora W. (2006). „Ochrana pro hydroxylovou skupinu, včetně 1,2- a 1,3-diolů“. Greeneovy ochranné skupiny v organické syntéze (4. vydání). 16–366. doi:10.1002 / 9780470053485.ch2. ISBN 9780470053485.
- ^ Builth-Williams, J. D .; Bellm, S. M .; Chiari, L .; Thorn, P. A .; Jones, D. B .; Chaluvadi, H .; Madison, D. H .; Ning, C. G .; Lohmann, B. (2013). „Dynamické (e, 2e) zkoumání strukturně souvisejících cyklických etherů, tetrahydrofuranu, tetrahydropyranu a 1,4-dioxanu“ (PDF). Journal of Chemical Physics. 139 (3): 034306. doi:10.1063/1.4813237.
- ^ Andrus, D. W .; Johnson, John R. (1943). "Tetrahydropyran". Organické syntézy. 23: 90. doi:10.15227 / orgsyn.023.0090.; Kolektivní objem, 3, str. 794
- ^ Earl, R. A .; Townsend, L. B. (1981). "Methyl 4-Hydroxy-2-butynoát". Organické syntézy. 60: 81. doi:10.15227 / orgsyn.060.0081.; Kolektivní objem, 7, str. 334
- ^ Kluge, Arthur F. (1986). "Diethyl [(2-tetrahydropyranyloxy) methyl] fosfonát". Organické syntézy. 64: 80. doi:10.15227 / orgsyn.064.0080.; Kolektivní objem, 7, str. 160
- ^ Robinson, Anna; Aggarwal, Varinder K. (2010). „Asymetric Total Synthesis of Solandelactone E: Stereocontrolled Synthesis of 2-ene-1,4-diol Core through a Lithiation – Borylation – Allylation Sequence“. Angewandte Chemie International Edition. 49 (37): 6673–6675. doi:10,1002 / anie.201003236.
- ^ Ferenc Notheisz, Mihály Bartók, „Hydrogenolýza vazeb C – O, C – N a C – X“, s. 1. 416 in, R. A. Sheldon, Herman van Bekkum (eds), Čisté chemikálie prostřednictvím heterogenní katalýzy, John Wiley & Sons, 2008 ISBN 3527612971.
- ^ „Nová organická nomenklatura IUPAC - chemické informace BULLETIN“ (PDF).




