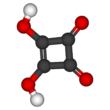
Kyselina čtvercová - Squaric acid
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 3,4-dihydroxycyklobut-3-en-1,2-dion | |||
| Ostatní jména Kvadratická kyselina | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.018.875 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H2Ó4 | |||
| Molární hmotnost | 114.056 g · mol−1 | ||
| Vzhled | bílý krystalický prášek | ||
| Bod tání | > 300 ° C (572 ° F; 573 K) | ||
| Kyselost (strK.A) | 1.5, 3.4 | ||
| Nebezpečí | |||
| R-věty (zastaralý) | R36 / 37/38 R43 | ||
| S-věty (zastaralý) | S26 S36 | ||
| Bod vzplanutí | 190 ° C (374 ° F; 463 K)[2] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina čtvercová, také zvaný kvadratická kyselina protože jeho čtyři atomy uhlíku přibližně tvoří čtverec, je a dibasic organická kyselina s chemický vzorec C4Ó2(ACH)2.[3]
The konjugovaná báze kyseliny čtvercové je hydrogensquarátový anion C
4HO−
4; a konjugovaná báze anionu hydrogensquarátu je dvojmocný kvadrátový anion C
4Ó2−
4. Toto je jeden z oxokarbonové anionty, které se skládají pouze z uhlíku a kyslíku.
Kyselina čtvercová je činidlo pro chemická syntéza, používá se například k výrobě fotocitlivý squaraine barviva a inhibitory protein tyrosin fosfatázy.
Chemické vlastnosti
Kyselina čtvercová je bílý krystalický prášek.[4] Nástup tepelného rozkladu závisí na různých termodynamických podmínkách, jako jsou rychlosti ohřevu.
Struktura kyseliny čtvercové není dokonalým čtvercem, protože délky vazeb uhlík-uhlík nejsou zcela stejné. Výška kyselost s pK.A = 1,5 pro první proton a pK.A = 3,4 pro druhý lze přičíst rezonanční stabilizace z anion.[5] Protože záporné náboje jsou rovnoměrně rozloženy mezi každý atom kyslíku, je dianion kyseliny čtvercové zcela symetrický (na rozdíl od samotné kyseliny čtvercové) se všemi C-C délky vazby identické a všechny délky vazeb C-O stejné.


Deriváty
Mnoho reakcí kyseliny čtvercové zahrnuje OH skupiny. Molekula se chová jako silná dikarboxylová kyselina. Je to silnější kyselina než typické karboxylové kyseliny.[6]
- C4Ó2(ACH)2 → [C.4Ó3(ACH)]− + H+ pK = 1,5
- [C4Ó3(ACH)]− → [C.4Ó4]2- + H+ pK = 3,5
Skupiny OH jsou labilní v kyselině čtvercové. Vytvoří dichlorid s thionylchloridem:
- C4Ó2(ACH)2 + 2 SOCl2 → C.4Ó2Cl2 + 2 HCl + 2 SO2
Chloridy jsou dobře odstupující skupiny, připomínající chloridy kyselin. Jsou přemístěni různými nukleofily. Tímto způsobem lze připravit dithiosquarate.[7]
Bis (methylether) se připraví alkylací s trimethylorthoformiát.[8]
Čtverce se připravují vytěsněním alkoxy nebo chloridových skupin z C4Ó2X2 (X = OR, Cl).[7][9]
Jedna nebo obě skupiny kyslíku (= O) ve čtvercovém aniontu mohou být nahrazeny dikyanomethylen = C (CN)2. Výsledné anionty, jako např 1,2-bis (dikyanomethylen) kvadrát a 1,3-bis (dikyanomethylen) kvadrát, zachovat si aromatický charakter kvadrátu a byly vyvolány pseudo-oxokarbonové anionty.
Fotolýza kyseliny čtvercové v a pevná argonová matice při 10 K (-263 ° C) poskytuje acetylenediol.[10]
Koordinační komplexy
Squarate dianion se chová podobně šťavelan, tvořící mono- a polynukleární komplexy s ionty tvrdých kovů.Hydrát kobaltu (II) squarate Co (C.4Ó4) (H2Ó)2 (žlutá, kubická) lze připravit pomocí autoklávování hydroxid kobaltnatý a kyselina čtvercová ve vodě při 200 ° C. Voda je vázána na kobalt atom a krystalová struktura se skládá z kubického uspořádání dutých buněk, jejichž stěny jsou buď šest čtvercových aniontů (ponechávající prázdnou dutinu 7 A) nebo několik molekul vody (ponechávající prázdnou dutinu 5 A).[11]
Kobalát (II) kvadrát dihydroxid Spol3(ACH)2(C4Ó4)2· 3H2O (hnědý) se získá společně s předchozí sloučeninou. Má sloupcovitou strukturu včetně kanálů naplněných molekulami vody; tyto mohou být odstraněny a nahrazeny bez poškození krystalové struktury. Řetězy jsou feromagnetický; jsou spojeny antiferomagneticky v hydratované formě, feromagneticky v bezvodé formě.[11]
Byly syntetizovány a charakterizovány komplexy čtverce mědi (II) s monomerními a dimerními směsnými ligandy.[12] Uvádí se infračervená, elektronická a Q-Band EPR spektra a také magnetická susceptibilita.
Stejná metoda vede železo (II) dihydroxid Fe2(ACH)2(C4Ó4) (světle hnědá).[11]
Syntézy
Původní syntéza začala ethanolýzou perfluorcyklobuten čímž se získá 1,2-diethoxy-3,3,4,4-tetrafluor-l-cyklobuten. Hydrolýza dává kyselinu čtvercovou.[13][3]
Ačkoli nepraktické, kvadratické a související anionty jako deltovat C
3Ó2−
3 a acetylenediolát C
2Ó2−
2 lze získat redukční vazbou oxidu uhelnatého za použití organouranové komplexy.[14][15]
Lékařské použití
Z lékařského hlediska pochází SADBE nebo dibutylester kyseliny čtvercové nebo dibutylester kyseliny čtvercové z kyseliny čtvercové.[16] se používá k léčbě bradavice.[17] K léčbě se také používá dibutylester kyseliny čtvercové alopecia areata nebo alopecia totalis (autoimunitní ztráta vlasů ) prostřednictvím aktuálního imunoterapie zahrnující výrobu alergický vyrážka.[18] Dibutylester kyseliny čtvercové v současné době prochází zkouškami pro použití při léčbě herpes labialis (opary).[19]
Diethylsquarate byl použit při syntéze Perzinfotel.
Viz také
- Cyklobuten, C
4H
6 - Kyselina deltová, C
3H
2Ó
3 - Kyselina krokonová, C
5H
2Ó
5 - Kyselina rhodizonová, C
6H
2Ó
6 - Čtverce, amidy kyselin čtvercových
Reference
- ^ 3,4-dihydroxy-3-cyklobuten-1,2-dion. Sigma-Aldrich
- ^ 3,4-dihydroxy-3-cyklobuten-1,2-dion, 98 +%. Alfa Aesar
- ^ A b Robert West (1980). "Historie oxokarbonů". V Robert West (ed.). Oxokarbony. Akademický tisk. s. 1–14. doi:10.1016 / B978-0-12-744580-9.50005-1. ISBN 9780127445809.
- ^ Lee, K.-S .; Kweon, J. J .; Ach, I.-H .; Lee, C. E. (2012). „Polymorfní fázový přechod a tepelná stabilita v kyselině čtvercové (H
2C
4Ó
4)". J. Phys. Chem. Pevné látky. 73 (7): 890–895. doi:10.1016 / j.jpcs.2012.02.013. - ^ West, Robert; Powell, David L. (1963). „Nové aromatické anionty. III. Molekulární orbitální výpočty na okysličené anionty“. J. Am. Chem. Soc. 85 (17): 2577–2579. doi:10.1021 / ja00900a010.
- ^ „Tabulky kyselosti organických kyselin a uhlíkových kyselin heteroatomů“.
- ^ A b Arthur H. Schmidt (1980). „Reaktionen von Quadratsäure und Quadratsäure-Derivaten“. Syntéza. 1980 (12): 961. doi:10.1055 / s-1980-29291.
- ^ Liu, Hui; Tomooka, Craig S .; Xu, Simon L .; et al. (1999). „Dimethyl Squarate and ITS Conversion to 3-Ethenyl-4-Methoxycyclobutene-1,2-Dione and 2-Butyl-6-Ethenyl-5-Methoxy-1,4-Benzochinon." Organické syntézy. 76: 189. doi:10.15227 / orgsyn.076.0189.
- ^ Ian Storer, R .; Aciro, Caroline; Jones, Lyn H. (2011). "Squaramidy: Fyzikální vlastnosti, syntéza a aplikace". Chem. Soc. Rev. 40 (5): 2330–2346. doi:10.1039 / c0cs00200c. PMID 21399835.
- ^ Maier, Günther; Rohr, Christine (1995). „Ethynediol: fotochemická generace a maticová spektroskopická identifikace“. Liebigs Annalen. 1996 (3): 307–309. doi:10,1002 / jlac.15719960304 (neaktivní 2020-09-03).CS1 maint: DOI neaktivní od září 2020 (odkaz)
- ^ A b C Hitoshi, Kumagai; Hideo, Sobukawa; Mohamedally, Kurmoo (2008). "Hydrotermální syntézy, struktury a magnetické vlastnosti koordinačních struktur dvojmocných přechodných kovů". Journal of Materials Science. 43 (7): 2123–2130. Bibcode:2008JMatS..43,2123K. doi:10.1007 / s10853-007-2033-8. S2CID 95205908.
- ^ Reinprecht, J. T .; Miller, J. G .; Vogel, G. C .; et al. (1979). "Syntéza a charakterizace komplexů mědi (II) kvadrátů". Inorg. Chem., 19, 927-931
- ^ Park, J. D .; Cohen, S. & Lacher, J. R. (1962). „Hydrolýzní reakce halogenovaných cyklobutenových etherů: Syntéza diketocyklobutendiolu“. J. Am. Chem. Soc. 84 (15): 2919–2922. doi:10.1021 / ja00874a015.
- ^ Frey, Alistair S .; Cloke, F. Geoffrey N .; Hitchcock, Peter B. (2008). „Mechanistické studie redukční cyklooligomerizace CO smíšenými sendvičovými komplexy U (III); molekulární struktura [(U (η-C8H6{Si′Pr3-1,4}2) (η-Cp*)]2(μ-η1: η1-C2Ó2)". Journal of the American Chemical Society. 130 (42): 13816–13817. doi:10.1021 / ja8059792. PMID 18817397.
- ^ Summerscales, Owen T .; Frey, Alistair S. P .; Cloke, F. Geoffrey N .; Hitchcock, Peter B. (2009). „Redukční disproporcionace oxidu uhličitého na uhličitany a výrobky z kvadrátu pomocí směsi sendvičového komplexu U (III)“. Chemická komunikace (2): 198–200. doi:10.1039 / b815576c. PMID 19099067.
- ^ „Dibutylester kyseliny čtvercové“.
- ^ "Bradavice". Wilmingtonské dermatologické centrum. Citováno 2011-10-23.
- ^ Holzer, A. M .; Kaplan, L. L .; Levis, W. R. (2006). „Stává se jako lék: kontaktní alergeny jsou silnými lokálními imunomodulátory“. J. Drugs Dermatol. 5 (5): 410–416. PMID 16703776.
- ^ http://clinicaltrials.gov/show/NCT01971385