Cyklooktatetraen - Cyclooctatetraene - Wikipedia
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Cycloocta-1,3,5,7-tetraen[1] | |||
| Ostatní jména [8] Zrušit (1Z,3Z,5Z,7Z) -Cyklookta-1,3,5,7-tetraen 1,3,5,7-Cyklooktatetraen DĚTSKÁ POSTÝLKA | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.010.074 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C8H8 | |||
| Molární hmotnost | 104,15 g / mol | ||
| Vzhled | Průhledná žlutá | ||
| Hustota | 0,9250 g / cm3, kapalný | ||
| Bod tání | -5 až -3 ° C (23 až 27 ° F; 268 až 270 K) | ||
| Bod varu | 142 až 143 ° C (288 až 289 ° F; 415 až 416 K) | ||
| nemísitelný | |||
| -53.9·10−6 cm3/ mol | |||
| Nebezpečí | |||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H304, H315, H319, H335 | |||
| P210, P233, P240, P241, P242, P243, P261, P264, P271, P280, P301 + 310, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P312, P321, P331, P332 + 313, P337 + 313, P362, P370 + 378, P403 + 233, P403 + 235, P405 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | -11 ° C (12 ° F; 262 K) | ||
| 561 ° C (1042 ° F; 834 K) | |||
| Související sloučeniny | |||
Příbuzný uhlovodíky | Cyklooktan Tetrafenylen | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
1,3,5,7-Cyklooktatetraen (DĚTSKÁ POSTÝLKA) je nenasycené derivát z cyklooktan, se vzorcem C.8H8. Je také známý jako [8]annulen. Tento polynenasycený uhlovodík je bezbarvá až světle žlutá hořlavá kapalina při pokojové teplotě. Kvůli jeho stechiometrickému vztahu k benzen „COT byla předmětem mnoha výzkumů a některých kontroverzí.
Na rozdíl od benzenu, C6H6, cyklooktatetraen, C.8H8, není aromatický, ačkoli jeho dianion, C
8H2−
8 (cyklooktatetraenid ), je. Jeho reaktivita je charakteristická pro obyčejné polyen, tj. prochází adiční reakce. Naproti tomu benzen charakteristicky prochází substituční reakce, ne dodatky.
Dějiny
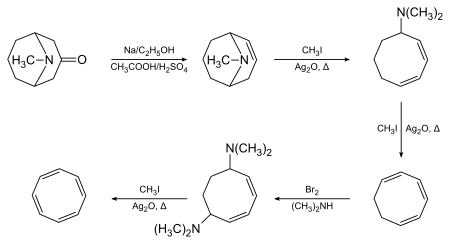
1,3,5,7-Cyklooktatetraen byl původně syntetizován Richard Willstätter v Mnichově v roce 1905 pomocí pseudopelletierin jako výchozí materiál a Hofmannova eliminace jako klíčová transformace:[2][3]
Willstätter poznamenal, že sloučenina nevykazovala očekávanou aromatičnost. V letech 1939 až 1943 se chemici v celých USA neúspěšně pokusili syntetizovat COT. Racionalizovali svůj neúspěch se závěrem, že Willstätter ve skutečnosti nesyntetizoval sloučeninu, ale její izomer, styren. Willstätter na tyto recenze odpověděl ve své autobiografii, kde poznamenal, že američtí chemici byli „bez problémů“ redukcí svého cyklooktatetraenu na cyklooktan (reakce, která je pro styren nemožná). Během druhé světové války Walter Reppe na BASF Ludwigshafen vyvinul jednoduchou, jednokrokovou syntézu cyklooktatetraenu z acetylenu, která poskytla materiál identický s materiálem připraveným Willstätterem.[4] Jakékoli zbývající pochybnosti o přesnosti Willstätterovy původní syntézy byly vyřešeny, když Arthur C. Cope a spolupracovníci v MIT popsal v roce 1947 úplné opakování Willstätterovy syntézy, krok za krokem, s použitím původně popsaných technik. Získali stejný cyklooktatetraen,[5] a následně uvedli moderní spektrální charakterizaci mnoha meziproduktů, což opět potvrdilo přesnost Willstätterova původního díla.[6]
Struktura a lepení

První studie prokázaly, že COT nevykazuje chemii aromatické sloučeniny.[7] Poté časné experimenty s elektronovou difrakcí dospěly k závěru, že vzdálenosti vazeb C-C jsou identické.[8] Data rentgenové difrakce od H. S. Kaufmana však prokázala, že cyklooktatetraen přijal několik konformace a obsahovat dvě odlišné vzdálenosti vazeb C – C.[9] Tento výsledek naznačil, že COT je annulen s pevnými střídavými jednoduchými a dvojitými vazbami CC.
Ve svém normálním stavu je cyklooktatetraen nerovinný a přijímá tubovou konformaci s úhly C = C-C = 126,1 ° a C = C-H = 117,6 °.[10] Bodová skupina cyklooktatetraenu je D2d.[11]
Ve svém planárním přechodovém stavu se D4h přechodný stav je stabilnější než D8h přechodný stav kvůli Jahn – Tellerův efekt.[12]
Syntéza
Originální syntéza Richarda Willstättera (4 po sobě jdoucí eliminační reakce na cyklooktanové struktuře) poskytuje relativně nízké výtěžky. Reppeova syntéza cyklooktatetraenu, která zahrnuje léčbu acetylén za vysokého tlaku s teplou směsí kyanid niklu a karbid vápníku, bylo mnohem lepší, s chemické výtěžky téměř 90%:[4]
COT může také připravit fotolýza z barrelen, jeden z jeho strukturní izomery „reakce probíhá prostřednictvím jiného izolovaného izomeru, semibullvalene.[13] Deriváty COT lze také syntetizovat pomocí poloibullvalenových meziproduktů. V níže uvedené sekvenci oktaethylcyklooktatetraen (C8Et8) je tvořen tepelná izomerizace oktaethylsemibullvalenu, který sám tvoří bromid měďnatý zprostředkovaný cyklodimerizace 1,2,3,4-tetraethyl-1,4-dilithio-1,3-butadienu.[14]
Protože COT je nestabilní a snadno tvoří výbušninu organické peroxidy, malé množství hydrochinon se obvykle přidává do komerčně dostupného materiálu. Testování na peroxidy se doporučuje při použití dříve otevřené lahve; bílé krystaly kolem hrdla lahve mohou být složeny z peroxidu, který může při mechanickém narušení explodovat.
Přirozený výskyt
Cyklooktatetraen byl izolován z určitých hub.[15]
Reakce
Vazby π v COT reagují obvyklým způsobem pro olefiny, spíše než jako aromatické kruhové systémy. Mono- a polyepoxidy lze generovat reakcí COT s peroxykyseliny nebo s dimethyldioxirane. Jsou známy také různé další adiční reakce. Dále polyacetylen lze syntetizovat pomocí polymerace otevírající kruh cyklooktatetraenu.[16] Samotná COT - a také analogy s postranními řetězci - byla použita jako kovové ligandy a in sendvičové směsi.
Cyklooktatetraen také prochází přesmykové reakce tvořit aromatický kruh systémy. Například, oxidace s vodný síran rtuťnatý formuláře fenylacetaldehyd[4][17] a fotochemické přeskupení jeho mono-epoxid formuláře benzofuran.[18]
Cyklooktatetraenid jako ligand a prekurzor ligandu
COT snadno reaguje s draslík kov za vzniku soli K.2COT, která obsahuje dianion C
8H2−
8.[19] Dianion je rovinný, osmiboký a aromatický s Hückelův počet elektronů z 10.
Formy cyklooktatetraenu organokovové komplexy s některými kovy, včetně ytrium, lanthanoidy a aktinidy.[20] The sendvičová směs uranocen (U (COT)2) obsahuje dva ῃ8 -COT ligandy. v bis (cyklooktatetraen) železo (Fe (COT)2) jeden COT je ῃ6 a druhá je ῃ4. (Cyklooktatetraen) železo trikarbonyl funkce ῃ4-DĚTSKÁ POSTÝLKA. Teplota v místnosti 1Spektra H NMR těchto komplexů železa jsou singlety, které svědčí o plynulost.[21]

Cyklooktatetraen je chlorovaný dát [4.2.0] -bicyklické sloučenina, která dále reaguje s dimethylacetylendikarboxylát v Diels-Alderova reakce (DA). Retro-DA při 200 ° C uvolňuje cis-dichlorcyklobuten. Tato sloučenina reaguje s diiron nonacarbonyl dát cyklobutadien-železo trikarbonyl.[22][23]
Viz také
- Cyklobutadien
- Pentalene
- Barrelen, strukturní izomer cyklooktatetraenu
- Heptafulvene, strukturní izomer cyklooktatetraenu
- Semibullvalene
- Benzen
Reference
- ^ „Přední hmota“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. str. P001 – P004. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Mason, S. (únor 1997). „Věda a humanismus Linuse Paulinga (1901–1994)“. Chem. Soc. Rev. 26: 29–39. doi:10.1039 / CS9972600029.
- ^ Willstätter, Richard; Waser, Ernst (1911). „Über Cyclo-octatetraen“ [O cyklooktatetraenu]. Berichte der Deutschen Chemischen Gesellschaft. 44 (3): 3423–3445. doi:10.1002 / cber.191104403216.
- ^ A b C Reppe, Walter; Schlichting, Otto; Klager, Karl; Toepel, Tim (1948). „Cyclisierende Polymerisation von Acetylen. I. Über Cyclooctatetraen“ [Kruhotvorná polymerace acetylenu. I. Cyklooktatetraen]. Justus Liebigs Annalen der Chemie. 560 (1): 1–92. doi:10.1002 / jlac.19485600102.
- ^ Cope, Arthur C .; Overberger, C. G. (1947). "Syntéza cykloöctatetraenu z pseudopelletierinu". Journal of the American Chemical Society. 69 (4): 976. doi:10.1021 / ja01196a513. PMID 20292490.
- ^ Cope, Arthur C .; Overberger, C. G. (1947). "Cyklické polyolefiny. I. Syntéza cyklooktatetraenu z pseudopelletierinu". Journal of the American Chemical Society. 70 (4): 1433–1437. doi:10.1021 / ja01184a041. PMID 18915758.
- ^ Johnson, A. W. (1947). "Organická chemie". Sci. Progr. 35 (139): 506–515. JSTOR 43413011.
- ^ Bastiensen, O .; Hassel, O .; Langseth, A. (1947). „‚ Octa-benzen ', cyklo-oktatetraen (C.8H8)". Příroda. 160 (4056): 128. Bibcode:1947Natur.160..128B. doi:10.1038 / 160128a0.
- ^ Kaufman, H. S .; Fankuchen, I .; H., Mark (1948). "Struktura cyklo-oktatetraenu". Příroda. 161 (4083): 165. Bibcode:1948Natur.161..165K. doi:10.1038 / 161165a0.
- ^ Thomas, P. M .; Weber, A. (1978). „Ramanova spektroskopie plynů s vysokým rozlišením pomocí laserových zdrojů. XIII - čistá rotační spektra 1,3,5,7-cyklooktatetraenu a 1,5-cyklooktadienu“. J. Raman Spectr. 7 (6): 353–357. Bibcode:1978JRSp .... 7..353T. doi:10.1002 / jrs.1250070614.
- ^ Claus, K. H .; Krüger, C. (15. září 1988). "Struktura cyklooktatetraenu při 129 K". Acta Crystallogr. C. 44 (9): 1632–1634. doi:10.1107 / S0108270188005840.
- ^ Nishinaga, Tohru; Ohmae, Takeshi; Iyoda, Masahiko (5. února 2010). „Nedávné studie o aromatičnosti a antiaromaticitě planárního cyklooktatetraenu“. Symetrie. 2 (1): 76–97. doi:10,3390 / sym2010076.
- ^ Zimmerman, H. E.; Grunewald, G.L. (1966). „The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene“ (PDF). J. Am. Chem. Soc. 88 (1): 183–184. doi:10.1021 / ja00953a045.
- ^ Wang, C .; Yuan, J .; Li, G .; Wang, Z .; Zhang, S .; Xi, Z. (2006). „Efektivní syntéza zprostředkovaná kovem, strukturní charakterizace a přeskupení kostry oktaubstituovaných semibullvalenů“. J. Am. Chem. Soc. 128 (14): 4564–4565. doi:10.1021 / ja0579208. PMID 16594680.
- ^ Stinson, M .; Ezra, D .; Hess, W. M .; Sears, J .; Strobel, G. (2003). „Endofytický Gliocladium sp. z Eucryphia cordifolia výroba selektivních těkavých antimikrobiálních sloučenin ". Plant Sci. 165 (4): 913–922. doi:10.1016 / S0168-9452 (03) 00299-1.
- ^ Moorhead, Eric J .; Wenzel, Anna G. (srpen 2009). „Dva vysokoškolácké experimenty s organickými polymery: Příprava polyacetylenu a telechelického polyacetylenu pomocí polymerace otevírající prsten kruhu“. J. Chem. Educ. 86 (8): 973. Bibcode:2009JChEd..86..973M. doi:10.1021 / ed086p973.
- ^ Kunichika, Sango (1953). „Cyklopolyolefiny odvozené od acetylenu“. Bulletin of the Institute for Chemical Research, Kyoto University. 31 (5): 323–335. hdl:2433/75368.
- ^ Holovka, J. M .; Gardner, P. D .; Strow, C. B .; Hill, M.L .; Van Auken, T. V. (1968). "Fotolýza a fotoizomerizace oxidu cyklooktatetraen". Journal of the American Chemical Society. 90 (18): 5041–5043. doi:10.1021 / ja01020a058.
- ^ Katz, Thomas J. (1960). "Cyklooktatetraenyl dianion". J. Am. Chem. Soc. 82 (14): 3784–3785. doi:10.1021 / ja01499a077.
- ^ Hlavní body projektu JST Nanostructed Materials - Prezentace prof. Nakajima
- ^ Cotton, F. Albert; Hunter, Douglas L. (1976). „Carbon-13 Nuclear Magnetic Resonance Study of Fluxional Behavior of Cyclooctatetraenetricarbonyliron and -Ruthenium“. Journal of the American Chemical Society. 98 (6): 1413–1417. doi:10.1021 / ja00422a022.
- ^ R. Pettit a J. Henery (1970). "cis-dichlorcyklobuten ". Organické syntézy. 50: 36. doi:10.15227 / orgsyn.050.0036.
- ^ „CYKLOBUTADIEN V SYNTÉZE: Endo-TRICYCLO [4.4.0.02,5] DECA-3,8-DIENE-7,10-DIONE“. Organické syntézy. 55: 43. 1976. doi:10.15227 / orgsyn.055.0043.