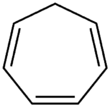
Cykloheptatrien - Cycloheptatriene
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Cyklohepta-l, 3,5-trien[1] | |||
| Ostatní jména 1,3,5-cykloheptatrien 1H- [7] Annulene CHT Tropiliden | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 506066 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.008.061 | ||
| Číslo ES |
| ||
| 1943 | |||
PubChem CID | |||
| UNII | |||
| UN číslo | 2603 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C7H8 | |||
| Molární hmotnost | 92.141 g · mol−1 | ||
| Hustota | 0,888 g / ml při 25 ° C | ||
| Bod tání | −80 ° C (−112 ° F; 193 K) | ||
| Bod varu | 116 ° C (241 ° F; 389 K) | ||
| Nerozpustný ve vodě | |||
| Kyselost (strK.A) | 36 | ||
| Nebezpečí | |||
| Piktogramy GHS |     | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H301, H304, H311, H315, H319, H335 | |||
| P210, P233, P240, P241, P242, P243, P261, P264, P270, P271, P280, P301 + 310, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P312, P321, P322, P330, P331, P332 + 313, P337 + 313, P361, P362 | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Cykloheptatrien (CHT) je organická sloučenina s vzorec C7H8. Jedná se o uzavřený kruh se sedmi atomy uhlíku spojený třemi dvojnými vazbami (jak název napovídá) a čtyřmi jednoduchými vazbami. O tuto bezbarvou kapalinu se vracel teoretický zájem organická chemie. Je to ligand organokovová chemie a stavební blok dovnitř organická syntéza. Cykloheptatrien není aromatický, což se odráží v neplanárnosti methylenový můstek (-CH2-) s ohledem na ostatní atomy; nicméně související kation tropylia je.
Syntéza
Albert Ladenburg poprvé generoval cykloheptatrien v roce 1881 rozkladem tropin.[2][3] Struktura byla nakonec prokázána syntézou Richard Willstätter v roce 1901. Tato syntéza začala od cykloheptanon a založil sedmičlennou kruhovou strukturu sloučeniny.[4]
Cykloheptatrien lze získat v laboratoři pomocí fotochemická reakce z benzen s diazomethan nebo pyrolýza aduktu cyklohexen a dichlorkarbenu.[5] Související klasická syntéza derivátů cykloheptatrienu, Zvětšení Buchnerova prstenu, začíná reakcí benzen s ethyl diazoacetát dát odpovídající norcaradiene ethylester, který poté prochází tepelně povolenou elektrocyklickou rozšíření kruhu čímž se získá ethylester kyseliny 1,3,5-cykloheptatrien-7-karboxylové.[6][7]

Reakce
Odstranění a hydrid ion z methylenový můstek dává planární a aromatický cykloheptatrienový kation, nazývaný také tropylium ion. Praktická cesta k tomuto kationu využívá PCl5 jako oxidant.[8] CHT se chová jako dien Diels – Alderovy reakce. Mnoho kovové komplexy cykloheptatrienu jsou známé, včetně Cr (CO)3(C7H8)[9] a cykloheptatrienemolybden trikarbonyl.[10]

Cyklooktatetraen a cykloheptatrien se používají jako a trojice zhášeč pro rhodamin 6G lasery na barvení.[11][12]
Viz také
Reference
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 223. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A. Ladenburg (1883). „Die Constitution des Atropins“. Justnal Liebig's Annalen der Chemie. 217 (1): 74–149. doi:10,1002 / jlac.18832170107.
- ^ A. Ladenburg (1881). „Die Zerlegung des Tropines“. Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2126–2131. doi:10.1002 / cber.188101402127.
- ^ R. Willstätter (1901). „Synthesen in der Tropingruppe. I. Synthese des Tropilidens“. Justnal Liebig's Annalen der Chemie. 317 (2): 204–265. doi:10,1002 / jlac.19013170206.
- ^ ON. Winberg (1959). "Syntéza cykloheptatrienu". Journal of Organic Chemistry. 24 (2): 264–265. doi:10.1021 / jo01084a635.
- ^ Buchner a kol., Ber., 18, 2377 (1885);
- ^ Pro variantu: Irvin Smith Lee; Tawney Pliny O (1934). "Studie na polymethylbenzenech. IX. Přidání ethyldiazoacetátu k Durene". J. Am. Chem. Soc. 56 (10): 2167–2169. doi:10.1021 / ja01325a054.
- ^ Conrow, K. (1973). „Fluoroborát tropylium“ (PDF). Organické syntézy, sebraný objem. 5: 1138.
- ^ James H. Rigby, Kevin R. Fales (2004). „7α-ACETOXY- (1Hβ, 6Hβ) -BICYKLO [4.4.1] UNDECA-2,4,8-TRIÉN VIA CHROMOU ZMĚNĚNÁ CYKLOADDICE VYSOKÉ OBJEDNÁVKY“. Organické syntézy.; Kolektivní objem, 10, str. 1
- ^ Green, Malcolm L. H .; Ng, Dennis K. P. (1995). „Cykloheptatrienové a -enylové komplexy kovů z raného přechodu“. Chemické recenze. 95 (2): 439–473. doi:10.1021 / cr00034a006.
- ^ Tomi Nath Das; K. Indira Priyadarsini (1994). "Triplet cyklooktatetraenu: reaktivita a vlastnosti". Journal of the Chemical Society, Faraday Transactions. 90 (7): 963–968. doi:10,1039 / ft9949000963.
- ^ R. Pappalardo; H. Samelson; A. Lempicki (1970). "Emise laseru s dlouhým pulsem z rhodaminu 6G pomocí cyklooktatetraenu". Aplikovaná fyzikální písmena. 16 (7): 267–269. Bibcode:1970ApPhL..16..267P. doi:10.1063/1.1653190.