Biomarker rakoviny - Cancer biomarker
A biomarker rakoviny se týká látky nebo procesu, který svědčí o přítomnosti rakovina v těle. A biomarker může být molekula vylučovaná a nádor nebo specifická reakce těla na přítomnost rakoviny. Genetický,[1] epigenetický,[2] proteomický,[3] glykomický,[4] a zobrazovací biomarkery mohou být použity pro diagnostiku, prognózu a epidemiologii rakoviny. V ideálním případě lze takové biomarkery testovat v neinvazivně shromážděných biofluidech, jako je krev nebo sérum.[5]

Zatímco při převádění výzkumu biomarkerů do klinického prostoru existuje řada výzev; počet gen a protein biomarkery založené na bázi již byly v určitém okamžiku použity v péči o pacienty; počítaje v to, AFP (Rakovina jater ), BCR-ABL (Chronická myeloidní leukémie ), BRCA1 / BRCA2 (Prsa /Rakovina vaječníků ), BRAF V600E (Melanom /Rakovina tlustého střeva a konečníku ), CA-125 (Rakovina vaječníků), CA19.9 (Rakovina slinivky ), CEA (Rakovina tlustého střeva), EGFR (Nemalobuněčný karcinom plic ), HER-2 (Rakovina prsu), SADA (Gastrointestinální stromální tumor ), PSA (Antigen specifický pro prostatu) (Rakovina prostaty ), S100 (Melanom) a mnoho dalších.[6][7][8][9][10][11][12][13][14][15] Mutantní proteiny samy detekovány Monitorování vybrané reakce (SRM) byly uváděny jako nejkonkrétnější biomarkery pro rakovinu, protože mohou pocházet pouze ze stávajícího nádoru.[16] Přibližně 40% nádorových onemocnění lze vyléčit, pokud jsou odhalena včas prostřednictvím vyšetření.[17]
Definice biomarkerů rakoviny
Organizace a publikace se liší ve své definici biomarker. V mnoha oblastech medicíny jsou biomarkery omezeny na bílkoviny identifikovatelné nebo měřitelné v krev nebo moč. Termín se však často používá k pokrytí jakékoli molekulární, biochemické, fyziologické nebo anatomické vlastnosti, kterou lze kvantifikovat nebo měřit.
The National Cancer Institute (NCI), zejména definuje biomarker jako: „Biologická molekula nacházející se v krvi, jiných tělních tekutinách nebo tkáních, která je známkou normálního nebo abnormálního procesu nebo stavu nebo nemoci. Může se použít biomarker, aby se zjistilo, jak dobře tělo reaguje na léčbu onemocnění nebo stavu. Také se nazývá molekulární marker a podpisová molekula. “ [18]
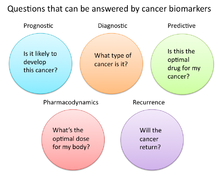
Ve výzkumu rakoviny a medicíně se biomarkery používají třemi primárními způsoby:[19]
- Pomáhat diagnostikovat stavy, jako v případě identifikace časných stadií rakoviny (diagnostické)
- Předpovědět, jak agresivní je stav, jako je tomu v případě stanovení pacientovy schopnosti stravovat se při absenci léčby (prognostický)
- Předvídat, jak dobře bude pacient reagovat na léčbu (Prediktivní)
Úloha biomarkerů ve výzkumu rakoviny a medicíně
Využití biomarkerů v medicíně proti rakovině
Posouzení rizik
Biomarkery rakoviny, zejména ty spojené s genetickými mutace nebo epigenetický změny často nabízejí kvantitativní způsob, jak určit, kdy jsou jednotlivci náchylní k určitým typům rakoviny. Pozoruhodné příklady potenciálně prediktivních biomarkerů rakoviny zahrnují mutace na genech KRAS, p53, EGFR, erbB2 pro kolorektální, jícnu, játra, a pankreatické rakovina; mutace genů BRCA1 a BRCA2 pro prsa a ovariální rakovina; abnormální methylace z geny potlačující nádory p16, CDKN2B, a p14ARF pro rakovina mozku; hypermethylace MYOD1, CDH1, a CDH13 pro rakovina děložního hrdla; a hypermethylace p16, p14, a RB1, pro rakovina ústní.[20]
Diagnóza
Biomarkery rakoviny mohou být také užitečné při stanovení konkrétní diagnózy. To platí zejména v případě, že je třeba určit, zda se jedná o nádory hlavní nebo metastazující původ. Vědci mohou tento rozdíl rozlišit chromozomální změny nalezené na buňkách umístěných v místě primárního nádoru oproti změnám nalezeným v sekundárním místě. Pokud se změny shodují, lze sekundární nádor identifikovat jako metastatický; zatímco pokud se změny liší, lze sekundární nádor identifikovat jako odlišný primární nádor.[21] Například lidé s nádory mají vysokou hladinu cirkulující nádorové DNA (ctDNA) v důsledku nádorových buněk, které prošly apoptózou.[22] Tento nádorový marker lze detekovat v krvi, slinách nebo moči.[17] Možnost identifikace účinného biomarkeru pro včasnou diagnostiku rakoviny byla nedávno zpochybněna s ohledem na vysokou molekulární heterogenitu nádorů pozorovanou sekvenčními studiemi nové generace.[23]
Prognóza a předpovědi léčby
Další použití biomarkerů v medicíně proti rakovině je pro onemocnění prognóza, které se odehrávají poté, co byla jednotlivci diagnostikována rakovina. Zde mohou být biomarkery užitečné při určování agresivity identifikované rakoviny i její pravděpodobnosti reakce na danou léčbu. Částečně je to proto, že nádory vykazující konkrétní biomarkery mohou reagovat na léčbu spojenou s expresí nebo přítomností tohoto biomarkeru. Příklady takových prognostických biomarkerů zahrnují zvýšené hladiny inhibitor metalopeptidázy 1 (TIMP1), značka spojená s agresivnějšími formami mnohočetný myelom,[24] zvýšené estrogenový receptor (ER) a / nebo receptor progesteronu (PR) exprese, markery spojené s lepším celkovým přežitím u pacientek s rakovinou prsu;[25][26] HER2 / neu genová amplifikace, značka označující rakovinu prsu bude pravděpodobně reagovat trastuzumab léčba;[27][28] mutace v exonu 11 protoonkogen c-KIT, značka označující a gastrointestinální stromální tumor (GIST) pravděpodobně odpoví imatinib léčba;[29][30] a mutace v tyrosinkináza doména EGFR1, značka označující pacienta nemalobuněčný karcinom plic (NSCLC) pravděpodobně odpoví gefitinib nebo erlotinib léčba.[31][32]
Farmakodynamika a farmakokinetika
Biomarkery rakoviny lze také použít k určení nejúčinnějšího režimu léčby rakoviny konkrétní osoby.[33] Kvůli rozdílům v genetickém složení každého člověka někteří lidé metabolizují nebo mění chemickou strukturu léků odlišně. V některých případech může snížený metabolismus určitých léků vytvářet nebezpečné podmínky, při nichž se v těle hromadí vysoká hladina léčiva. Proto může být rozhodnutí o dávkování léků v konkrétních způsobech léčby rakoviny prospěšné ze screeningu těchto biomarkerů. Příkladem je gen kódující enzym thiopurin methyl-transferáza (TPMPT).[34] Jedinci s mutacemi v genu TPMT nejsou schopni metabolizovat velké množství leukémie lék, merkaptopurin, což potenciálně způsobí fatální pokles bílá krev počítat pro takové pacienty. Pacientům s mutacemi TPMT se proto z bezpečnostních důvodů doporučuje podávat nižší dávku merkaptopurinu.[35]
Monitorování reakce na léčbu
Biomarkery rakoviny také ukázaly užitečnost při monitorování toho, jak dobře léčba v průběhu času funguje. V této konkrétní oblasti se věnuje mnoho výzkumu, protože úspěšné biomarkery mají potenciál významně snížit náklady na péči o pacienty, protože současné testy založené na obrazu, jako je CT a MRI, pro sledování stavu nádoru jsou velmi nákladné.[36]
Jedním z pozoruhodných biomarkerů s významnou pozorností je protein biomarker S100 -beta při sledování odpovědi maligního melanom. V takových melanomech melanocyty Buňky, které v naší pokožce tvoří pigment, produkují protein S100-beta ve vysokých koncentracích v závislosti na počtu rakovinných buněk. Odpověď na léčbu je tedy spojena se sníženými hladinami S100-beta v krvi těchto jedinců.[37][38]
Podobně další laboratorní výzkum ukázal, že nádorové buňky procházejí apoptóza může uvolňovat buněčné komponenty jako cytochrom c, nukleosomy, rozštěpený cytokeratin-18, a E-kadherin. Studie zjistily, že tyto makromolekuly a další lze nalézt v oběhu během léčby rakoviny, což poskytuje potenciální zdroj klinických metrik pro monitorování léčby.[36]
Opakování
Biomarkery rakoviny mohou také nabídnout hodnotu při předpovídání nebo monitorování rakoviny opakování. The Oncotype DX® test rakoviny prsu je jedním z takových testů, který se používá k předpovědi pravděpodobnosti recidivy rakoviny prsu. Tento test je určen pro ženy s raná fáze (Fáze I nebo II), negativní na uzly, estrogenový receptor -pozitivní (ER +) invazivní rakovina prsu, která bude léčena hormonální terapie. Oncotype DX zkoumá panel 21 genů v buňkách odebraných během nádoru biopsie. Výsledky testu jsou uvedeny ve formě skóre opakování, které naznačuje pravděpodobnost opakování po 10 letech.[39][40]
Využití biomarkerů ve výzkumu rakoviny
Rozvoj drogových cílů
Kromě jejich použití v medicíně proti rakovině se biomarkery často používají v celém procesu objevování léků proti rakovině. Například v 60. letech objevili vědci většinu pacientů s chronická myelogenní leukémie vlastnil zvláštní genetickou abnormalitu dne chromozomy 9 a 22 daboval Philadelphia chromozom. Když se tyto dva chromozomy spojí, vytvoří gen způsobující rakovinu známý jako BCR-ABL. U těchto pacientů tento gen působí jako základní výchozí bod ve všech fyziologických projevech leukémie. Po mnoho let se BCR-ABL jednoduše používal jako biomarker ke stratifikaci určitého podtypu leukémie. Vývojáři léků se však nakonec dokázali vyvinout imatinib, silný lék, který účinně inhiboval tento protein a významně snížil produkci buněk obsahujících Philadelphia chromozom.[41][42]
Náhradní koncové body
Další slibnou oblastí aplikace biomarkerů je oblast náhradní koncové body. V této přihlášce fungují biomarkery jako záskoky účinků léku na progresi a přežití rakoviny. V ideálním případě by použití validovaných biomarkerů zabránilo pacientům podstoupit nádor biopsie a zdlouhavé klinické testy zjistit, zda nová droga zafungovala. V současném standardu péče je metrikou pro stanovení účinnosti léku zkontrolovat, zda snížil progresi rakoviny u lidí a nakonec zda prodlužuje přežití. Úspěšné náhrady biomarkerů by však mohly ušetřit podstatný čas, úsilí a peníze, pokud by selhávající léky mohly být vyloučeny z vývojového potrubí před zavedením do klinických studií.
Některé ideální vlastnosti náhradních biomarkerů koncových bodů zahrnují:[43][44]
- Biomarker by měl být zapojen do procesu, který způsobuje rakovinu
- Změny biomarkerů by měly korelovat se změnami onemocnění
- Úrovně biomarkerů by měly být dostatečně vysoké, aby je bylo možné snadno a spolehlivě měřit
- Úrovně nebo přítomnost biomarkeru by měly snadno rozlišovat mezi normální, rakovinovou a prekancerózní tkání
- Účinná léčba rakoviny by měla změnit hladinu biomarkeru
- Hladina biomarkeru by se neměla měnit spontánně ani v reakci na jiné faktory nesouvisející s úspěšnou léčbou rakoviny
Zejména dvě oblasti, kterým se dostává pozornosti, protože zahrnují náhradní značky cirkulující nádorové buňky (CTC)[45][46] a v oběhu miRNA.[47][48] Oba tyto markery jsou spojeny s počtem nádor doufá se, že buňky přítomné v krvi, a jako takové, poskytnou náhradu za progresi nádoru a metastáza. Mezi významné překážky jejich přijetí však patří obtížnost obohacení, identifikace a měření hladin CTC a miRNA v krvi. K jejich převodu do klinické péče jsou pravděpodobně nutné nové technologie a výzkum.[49][50][51]
Typy biomarkerů rakoviny
Biomarkery molekulární rakoviny
| Typ nádoru | Biomarker |
|---|---|
| Prsa | ER /PR (estrogenový receptor / progesteronový receptor)[52][53] |
| HER-2 / neu [52][53] | |
| Kolorektální | EGFR [52][53] |
| KRAS [52][54] | |
| UGT1A1 [52][54] | |
| Žaludeční | HER-2 / neu [52] |
| PODSTATA | c-KIT [52][55] |
| Leukémie / lymfom | CD20 [52][56] |
| CD30 [52][57] | |
| FIP1L1 -PDGFRalfa [52][58] | |
| PDGFR [52][59] | |
| Filadelfský chromozom (BCR /ABL ) [52][60][61] | |
| PML /RAR-alfa [52][62] | |
| TPMT [52][63] | |
| UGT1A1 [52][64] | |
| Plíce | EML4 /ALK [52][65][66] |
| EGFR [52][53] | |
| KRAS [52][53] | |
| Melanom | BRAF [52][66] |
| Slinivka břišní | Zvýšené úrovně leucin, isoleucin a valin[67] |
| Vaječníky | CA-125[68] |
Další příklady biomarkerů:
- Potlačující nádory ztracené v rakovině
- RNA
- Bílkoviny nacházející se v tělních tekutinách nebo tkáních.
- Příklady: Antigen specifický pro prostatu, a CA-125
- Protilátky proti rakovinovým antigenům
- Příklady: Polyomavirus z Merkelových buněk[70]
- DNA
Biomarkery rakoviny bez specifičnosti
Ne všechny biomarkery rakoviny musí být specifické pro typy rakoviny. Některé biomarkery nalezené v oběhovém systému lze použít ke stanovení abnormálního růstu buněk přítomných v těle. Všechny tyto typy biomarkerů lze identifikovat pomocí diagnostických krevních testů, což je jeden z hlavních důvodů pravidelného testování zdraví. Pravidelným testováním lze v rané fázi odhalit mnoho zdravotních problémů, jako je rakovina, které zabraňují mnoha úmrtím.
Poměr neutrofilů k lymfocytům se ukázal jako nespecifický determinant pro mnoho druhů rakoviny. Tento poměr se zaměřuje na aktivitu dvou složek imunitního systému, které se podílejí na zánětlivé reakci, která je vyšší v přítomnosti maligních nádorů.[71] Navíc základní fibroblastový růstový faktor (bFGF ) je protein, který se podílí na množení buněk. Bohužel se ukázalo, že v přítomnosti nádorů je vysoce aktivní, což vedlo k závěru, že může pomoci reprodukci maligních buněk rychleji.[72] Výzkum ukázal, že protilátky anti-bFGF lze použít k léčbě nádorů mnoha původů.[72] Navíc, růstový faktor podobný inzulínu (IGF-R) se podílí na proliferaci a růstu buněk. Je možné, že se podílí na inhibici apoptózy, programované buněčné smrti v důsledku nějakého defektu.[73] Díky tomu mohou být hladiny IGF-R zvýšeny, pokud je přítomna rakovina, jako je prsa, prostata, plíce a kolorektum.[74]
| Biomarker | Popis | Použitý biosenzor |
|---|---|---|
| NLR (poměr neutrofilů k lymfocytům) | Zvyšuje se zánětem způsobeným rakovinou[75] | Ne |
| Základní růstový faktor fibroblastů (bFGF) | Tato hladina se zvyšuje, když je přítomen nádor, což pomáhá při rychlé reprodukci nádorových buněk[76] | Elektrochemické[77] |
| Růstový faktor podobný inzulínu (IGF-R) | Vysoká aktivita v rakovinných buňkách, napomáhá reprodukci[78] | Elektrochemický impedanční spektroskopický senzor[Citace je zapotřebí ] |
Viz také
Reference
- ^ Calzone, Kathleen A. (2012). „Genetické biomarkery rizika rakoviny“. Semináře z ošetřovatelství onkologie. 28 (2): 122–128. doi:10.1016 / j.soncn.2012.03.007. PMID 22542320.
- ^ Herceg, Zdenko; Hainaut, Pierre (01.06.2007). „Genetické a epigenetické změny jako biomarkery pro detekci, diagnostiku a prognózu rakoviny“. Molekulární onkologie. 1 (1): 26–41. doi:10.1016 / j.molonc.2007.01.004. ISSN 1878-0261. PMC 5543860. PMID 19383285.
- ^ Li, Danni; Chan, Daniel W. (2014-04-01). „Biomarkery proteomické rakoviny od objevu po schválení: stojí za to úsilí“. Odborná recenze proteomiky. 11 (2): 135–136. doi:10.1586/14789450.2014.897614. ISSN 1478-9450. PMC 4079106. PMID 24646122.
- ^ Aizpurua-Olaizola, O .; Toraño, J. Sastre; Falcon-Perez, J.M .; Williams, C .; Reichardt, N .; Boons, G.-J. (2018). "Hmotnostní spektrometrie pro objev biomarkerů glykanu". Trac Trends in Analytical Chemistry. 100: 7–14. doi:10.1016 / j.trac.2017.12.015.
- ^ Mishra, Alok; Verma, Mukesh (2010). „Biomarkery rakoviny: Jsme připraveni na hlavní čas?“. Rakoviny. 2 (1): 190–208. doi:10,3390 / rakoviny2010190. PMC 3827599. PMID 24281040.
- ^ Rhea, Jeanne; Ross J. Molinaro (březen 2011). „Biomarkery rakoviny: Přežít cestu z lavičky na postel“. Lékařský laboratorní pozorovatel. Archivovány od originál dne 14. října 2013. Citováno 26. dubna 2013.
- ^ Behne, Tara; Copur, M. Sitki (1. ledna 2012). „Biomarkery pro hepatocelulární karcinom“. International Journal of Hepatology. 2012: 859076. doi:10.1155/2012/859076. PMC 3357951. PMID 22655201.
- ^ Musolino, A; Bella, MA; Bortesi, B; Michiara, M; Naldi, N; Zanelli, P; Capelletti, M; Pezzuolo, D; Camisa, R; Savi, M; Neri, TM; Ardizzoni, A (červen 2007). „BRCA mutace, molekulární markery a klinické proměnné v časném nástupu rakoviny prsu: populační studie“. Prsa. 16 (3): 280–92. doi:10.1016 / j.breast.2006.12.003. PMID 17257844.
- ^ Dienstmann, R; Tabernero, J (březen 2011). „BRAF jako cíl léčby rakoviny“. Protirakovinové látky v léčivé chemii. 11 (3): 285–95. doi:10.2174/187152011795347469. PMID 21426297.
- ^ Lamparella, N; Barochia, A; Almokadem, S (2013). Dopad genetických markerů na léčbu nemalobuněčného karcinomu plic. Pokroky v experimentální medicíně a biologii. 779. str. 145–64. doi:10.1007/978-1-4614-6176-0_6. ISBN 978-1-4614-6175-3. PMID 23288638.
- ^ Orphanos, G; Kountourakis, P (2012). „Cílení na HER2 receptor u metastatického karcinomu prsu“. Hematologie / onkologie a terapie kmenovými buňkami. 5 (3): 127–37. doi:10.5144/1658-3876.2012.127. PMID 23095788.
- ^ DePrimo, S.E .; Huang, X .; Blackstein, M. E.; Garrett, C. R .; Harmon, C. S .; Schoffski, P .; Shah, M. H .; Verweij, J .; Baum, C. M .; Demetri, G. D. (8. září 2009). „Cirkulující hladiny rozpustného KIT slouží jako biomarker pro klinické výsledky u pacientů s gastrointestinálním stromálním tumorem, kteří dostávají sunitinib po selhání imatinibu“. Klinický výzkum rakoviny. 15 (18): 5869–5877. doi:10.1158 / 1078-0432.CCR-08-2480. PMC 3500590. PMID 19737953.
- ^ Bantis, A; Grammaticos, P (září – prosinec 2012). „Prostatický specifický antigen a kostní sken v diagnostice a sledování rakoviny prostaty. Lze zvýšit diagnostický význam PSA?“. Hellenic Journal of Nuclear Medicine. 15 (3): 241–6. PMID 23227460.
- ^ Kruijff, S; Hoekstra, HJ (duben 2012). "Aktuální stav S-100B jako biomarkeru melanomu". European Journal of Surgical Oncology. 38 (4): 281–5. doi:10.1016 / j.ejso.2011.12.005. PMID 22240030.
- ^ Ludwig, JA; Weinstein, JN (listopad 2005). „Biomarkery ve stagingu rakoviny, prognóze a výběru léčby“. Nature Reviews Cancer. 5 (11): 845–56. doi:10.1038 / nrc1739. PMID 16239904.
- ^ Wang, Qing; Raghothama Chaerkady (prosinec 2010). "Mutantní proteiny jako biomarkery specifické pro rakovinu". Sborník Národní akademie věd. 108 (6): 2444–2449. Bibcode:2011PNAS..108,2444 W.. doi:10.1073 / pnas.1019203108. PMC 3038743. PMID 21248225.
- ^ A b C Li, Xuanying; Ye, Mengsha; Zhang, Weiying; Tan, Duo; Jaffrezic-Renault, Nicole; Yang, Xu; Guo, Zhenzhong (01.02.2019). „Tekutá biopsie cirkulující nádorové DNA a aplikace biosenzoru“. Biosenzory a bioelektronika. 126: 596–607. doi:10.1016 / j.bios.2018.11.037. ISSN 0956-5663. PMID 30502682.
- ^ "biomarker". Slovník pojmů NCI o rakovině. Národní onkologický institut. 02.02.2011.
- ^ „Biomarkery v rakovině: Úvodní průvodce pro obhájce“ (PDF). Výzkumná advokační síť. 2010. Archivovány od originál (PDF) dne 29. 10. 2013. Citováno 26. dubna 2013.
- ^ Verma, M; Manne, U (říjen 2006). „Genetické a epigenetické biomarkery v diagnostice rakoviny a identifikaci vysoce rizikových populací“. Kritické recenze v onkologii / hematologii. 60 (1): 9–18. doi:10.1016 / j.critrevonc.2006.04.002. PMID 16829121.
- ^ Leong, PP; Rezai, B; Koch, WM; Reed, A; Eisele, D; Lee, DJ; Sidransky, D; Jen, J; Westra, WH (1. července 1998). „Rozlišování druhých primárních nádorů od plicních metastáz u pacientů s karcinomem dlaždicových buněk hlavy a krku“. Journal of the National Cancer Institute. 90 (13): 972–7. doi:10.1093 / jnci / 90.13.972. PMID 9665144.
- ^ Lapin, Morten; Oltedal, Satu; Tjensvoll, Kjersti; Buhl, Tove; Smaaland, Rune; Garresori, Herish; Javle, Milind; Glenjen, Nils Idar; Abelseth, Bente Kristin; Gilje, Bjørnar; Nordgård, Oddmund (06.11.2018). „Velikost fragmentu a hladina bezbuněčné DNA poskytují prognostické informace u pacientů s pokročilým karcinomem pankreatu“. Journal of Translational Medicine. 16 (1): 300. doi:10.1186 / s12967-018-1677-2. ISSN 1479-5876. PMC 6218961. PMID 30400802.
- ^ Dragani, TA; Matarese, V; Colombo, F (2020). „Biomarkery pro včasnou diagnostiku rakoviny: vyhlídky na úspěch prostřednictvím genetiky čočky tumoru“. BioEssays. 42 (4): e1900122. doi:10.1002 / bies.201900122. PMID 32128843.
- ^ Terpos E, Dimopoulos MA, Shrivastava V, et al. (Březen 2010). „Vysoké hladiny sérového TIMP-1 korelují s pokročilým onemocněním a předpovídají špatné přežití u pacientů s mnohočetným myelomem léčených novými látkami“. Výzkum leukémie. 34 (3): 399–402. doi:10.1016 / j.leukres.2009.08.035. PMID 19781774.
- ^ Kuukasjärvi, T; Kononen, J; Helin, H; Holli, K; Isola, J (září 1996). „Ztráta estrogenového receptoru u rekurentního karcinomu prsu je spojena se špatnou odpovědí na endokrinní terapii“. Journal of Clinical Oncology. 14 (9): 2584–9. doi:10.1200 / jco.1996.14.9.2584. PMID 8823339.
- ^ Harris, L; Fritsche, H; Mennel, R; Norton, L; Ravdin, P; Taube, S; Somerfield, MR; Hayes, DF; Bast RC, Jr; Americká společnost pro klinickou onkologii (20. listopadu 2007). „Americká společnost pro klinickou onkologii 2007 aktualizace doporučení pro použití nádorových markerů u rakoviny prsu“. Journal of Clinical Oncology. 25 (33): 5287–312. doi:10.1200 / JCO.2007.14.2364. PMID 17954709.
- ^ Kröger, N; Milde-Langosch, K; Riethdorf, S; Schmoor, C; Schumacher, M; Zander, AR; Löning, T (1. ledna 2006). „Prognostické a prediktivní účinky imunohistochemických faktorů u vysoce rizikových pacientek s primárním karcinomem prsu“. Klinický výzkum rakoviny. 12 (1): 159–68. doi:10.1158 / 1078-0432.CCR-05-1340. PMID 16397038.
- ^ Vrbic, S; Pejcic, I; Filipovic, S; Kocic, B; Vrbic, M (leden – březen 2013). „Současná a budoucí léčba anti-HER2 u rakoviny prsu“. Journal of the Balkan Union of Oncology. 18 (1): 4–16. PMID 23613383.
- ^ Yoo, C; Ryu, MH; Ryoo, BY; Beck, MY; Kang, YK (17. dubna 2013). „Účinnost, bezpečnost a farmakokinetika zvyšování dávky imatinibu na 800 mg / den u pacientů s pokročilými gastrointestinálními stromálními tumory“. Investigational New Drugs. 31 (5): 1367–74. doi:10.1007 / s10637-013-9961-8. PMID 23591629.
- ^ Demetri, GD; van Oosterom, AT; Garrett, ČR; Blackstein, ME; Shah, MH; Verweij, J; McArthur, G; Judson, IR; Heinrich, MC; Morgan, JA; Desai, J; Fletcher, CD; George, S; Bello, CL; Huang, X; Baum, CM; Casali, PG (14. října 2006). „Účinnost a bezpečnost sunitinibu u pacientů s pokročilým gastrointestinálním stromálním tumorem po selhání imatinibu: randomizovaná kontrolovaná studie“. Lanceta. 368 (9544): 1329–38. doi:10.1016 / S0140-6736 (06) 69446-4. PMID 17046465.
- ^ Herbst, RS; Prager, D; Hermann, R; Fehrenbacher, L; Johnson, BE; Sandler, A; Kris, MG; Tran, HT; Klein, P; Li, X; Ramies, D; Johnson, DH; Miller, VA; TRIBUTE Investigator Group (1. září 2005). „TRIBUTE: studie fáze III s erlotinib hydrochloridem (OSI-774) v kombinaci s chemoterapií karboplatinou a paclitaxelem u pokročilého nemalobuněčného karcinomu plic“. Journal of Clinical Oncology. 23 (25): 5892–9. doi:10.1200 / JCO.2005.02.840. PMID 16043829.
- ^ Lynch, TJ; Bell, DW; Sordella, R; Gurubhagavatula, S; Okimoto, RA; Brannigan, BW; Harris, PL; Haserlat, SM; Supko, JG; Haluska, FG; Louis, DN; Christiani, DC; Settleman, J; Haber, DA (20. května 2004). „Aktivační mutace v receptoru epidermálního růstového faktoru, které jsou základem reakce nemalobuněčného karcinomu plic na gefitinib (PDF). The New England Journal of Medicine. 350 (21): 2129–39. doi:10.1056 / NEJMoa040938. PMID 15118073.
- ^ Sawyers CL (duben 2008). „Problém s biomarkery rakoviny“. Příroda. 452 (7187): 548–52. Bibcode:2008 Natur.452..548S. doi:10.1038 / nature06913. PMID 18385728.
- ^ Karas-Kuzelicki, N; Mlinaric-Rascan, I (srpen 2009). „Individualizace thiopurinové terapie: thiopurinová S-methyltransferáza a další“. Farmakogenomika. 10 (8): 1309–22. doi:10,2217 / str.09,78. PMID 19663675.
- ^ Relling MV, Hancock ML, Rivera GK a kol. (Prosinec 1999). „Intolerance a heterozygotnost terapie merkaptopurinem na lokusu genu thiopurin S-methyltransferázy“. Journal of the National Cancer Institute. 91 (23): 2001–8. doi:10.1093 / jnci / 91.23.2001. PMID 10580024.
- ^ A b Schneider, John; Manpreet K Sidhu; Cynthia Doucet; Noemi Kiss; Robert L Ohsfeldt; Donald Chalfin (2012). "Ekonomika biomarkerů rakoviny". Personalizovaná medicína. 9 (8): 829–837. doi:10,2217 / pme.12.87. PMID 29776231.
- ^ Henze, G; Dummer, R; Joller-Jemelka, HI; Böni, R; Burg, G (1997). "Sérum S100 - marker pro sledování onemocnění u metastatického melanomu". Dermatologie. 194 (3): 208–12. doi:10.1159/000246103. PMID 9187834.
- ^ Harpio, R; Einarsson, R (červenec 2004). „Proteiny S100 jako biomarkery rakoviny se zaměřením na S100B u maligního melanomu“. Klinická biochemie. 37 (7): 512–8. doi:10.1016 / j.clinbiochem.2004.05.012. PMID 15234232.
- ^ Lamond, NW; Skedgel, C; Younis, T (duben 2013). „Je skóre rekurence 21 genů nákladově efektivní test u endokrinně senzitivního uzlinově negativního karcinomu prsu?“. Odborný přehled výzkumu farmakoekonomiky a výstupů. 13 (2): 243–50. doi:10.1586 / erp.13.4. PMID 23570435.
- ^ Biroschak, JR; Schwartz, GF; Palazzo, JP; Toll, AD; Brill, KL; Jaslow, RJ; Lee, SY (květen 2013). „Dopad Oncotype DX na rozhodování o léčbě u ER-pozitivního, node-negativního karcinomu prsu s histologickou korelací“. The Breast Journal. 19 (3): 269–75. doi:10.1111 / tbj.12099. PMID 23614365.
- ^ Moen, MD; McKeage, K; Plosker, GL; Siddiqui, MA (2007). „Imatinib: přehled jeho použití při chronické myeloidní leukémii“. Drogy. 67 (2): 299–320. doi:10.2165/00003495-200767020-00010. PMID 17284091.
- ^ Lemonick, Michael; Alice Park (28. května 2001). „Nová naděje na rakovinu“. Časopis Time. Citováno 26. dubna 2013.
- ^ Cena, C; McDonnell, D (únor 1991). "Účinky niobové filtrace a konstantního potenciálu na senzitometrické odezvy dentálních rentgenových filmů". Dentomaxilofaciální radiologie. 20 (1): 11–6. doi:10.1259 / dmfr.20.1.1884846. PMID 1884846.
- ^ Cohen, Victor; Fadlo Khuri (2003). „Pokrok v chemoprevenci rakoviny plic“ (PDF). Kontrola rakoviny. 10 (4): 315–324. doi:10.1177/107327480301000406. PMID 12915810. Citováno 26. dubna 2013.[trvalý mrtvý odkaz ]
- ^ Lucie; Tsai, HL; Uen, YH; Hu, HM; Chen, CW; Cheng, TL; Lin, SR; Wang, JY (5. března 2013). „Cirkulující nádorové buňky jako náhradní marker pro stanovení klinického výsledku chemoterapie mFOLFOX u pacientů s rakovinou tlustého střeva ve stadiu III.“. British Journal of Cancer. 108 (4): 791–7. doi:10.1038 / bjc.2012.595. PMC 3590657. PMID 23422758.
- ^ Balic, M; Williams, A; Lin, H; Datar, R; Cote, RJ (2013). „Cirkulující nádorové buňky: od lavičky k lůžku“. Roční přehled medicíny. 64: 31–44. doi:10.1146 / annurev-med-050311-163404. PMC 3809995. PMID 23092385.
- ^ Madhavan, D; Zucknick, M; Wallwiener, M; Cuk, K; Modugno, C; Scharpff, M; Schott, S; Heil, J; Turchinovich, A; Yang, R; Benner, A; Riethdorf, S; Trumpp, A; Sohn, C; Pantel, K; Schneeweiss, A; Burwinkel, B (1. listopadu 2012). „Cirkulující miRNA jako náhradní markery pro cirkulující nádorové buňky a prognostické markery u metastatického karcinomu prsu“. Klinický výzkum rakoviny. 18 (21): 5972–82. doi:10.1158 / 1078-0432.CCR-12-1407. PMID 22952344.
- ^ Redova, M; Sana, J; Slaby, O (březen 2013). „Cirkulující miRNA jako nové biomarkery na bázi krve pro solidní rakoviny“. Budoucí onkologie. 9 (3): 387–402. doi:10,2217 / fon.12.192. PMID 23469974.
- ^ Joosse, SA; Pantel, K (1. ledna 2013). „Biologické výzvy při detekci cirkulujících nádorových buněk“. Výzkum rakoviny. 73 (1): 8–11. doi:10.1158 / 0008-5472.CAN-12-3422. PMID 23271724.
- ^ Hou, HW; Warkiani, ME; Khoo, BL; Li, ZR; Soo, RA; Tan, DS; Lim, WT; Han, J; Bhagat, AA; Lim, CT (2013). „Izolace a získávání cirkulujících nádorových buněk pomocí odstředivých sil“. Vědecké zprávy. 3: 1259. Bibcode:2013NatSR ... 3E1259H. doi:10.1038 / srep01259. PMC 3569917. PMID 23405273.
- ^ Dhondt, Bert; De Bleser, Elise; Claeys, Tom; Buelens, Sarah; Lumen, Nicolaas; Vandesompele, Jo; Beckers, Anneleen; Fonteyne, Valerie; Van der Eecken, Kim; De Bruycker, Aurélie; Paul, Jérôme; Gramme, Pierre; Ost, Piet (21. prosince 2018). „Objev a ověření podpisu mikroRNA v séru k charakterizaci oligo- a polymetastatického karcinomu prostaty: není připraven na hlavní vysílací čas“. World Journal of Urology. 37 (12): 2557–2564. doi:10.1007 / s00345-018-2609-8. hdl:1854 / LU-8586484. PMID 30578441.
- ^ A b C d E F G h i j k l m n Ó str q r s „Tabulka farmakogenomických biomarkerů na štítcích s léky“. US Food and Drug Administration.
- ^ A b C d E "Informační list nádorových markerů" (PDF). Americká rakovinová společnost.
- ^ A b Heinz-Josef Lenz (18. 9. 2012). Biomarkery v onkologii: Predikce a prognóza. Springer Science & Business Media. p. 263. ISBN 978-1-4419-9754-8.
- ^ Gonzalez RS, Carlson G, Page AJ, Cohen C (červenec 2011). „Markery gastrointestinálního stromálního tumoru v kožních melanomech: vztah k prognostickým faktorům a výsledku“. American Journal of Clinical Pathology. 136 (1): 74–80. doi:10.1309 / AJCP9KHD7DCHWLMO. PMID 21685034.
- ^ Tam CS, Otero-Palacios J, Abruzzo LV a kol. (Duben 2008). „Chronická lymfocytární leukémie CD20 exprese závisí na genetickém podtypu: studie kvantitativní průtokové cytometrie a fluorescenční hybridizace in situ u 510 pacientů“. British Journal of Hematology. 141 (1): 36–40. doi:10.1111 / j.1365-2141.2008.07012.x. PMID 18324964.
- ^ Zhang M, Yao Z, Patel H a kol. (Květen 2007). „Efektivní terapie myších modelů lidské leukémie a lymfomu radioaktivně značenou anti-CD30 protilátkou, HeFi-1“. Sborník Národní akademie věd Spojených států amerických. 104 (20): 8444–8. Bibcode:2007PNAS..104,8444Z. doi:10.1073 / pnas.0702496104. PMC 1895969. PMID 17488826.
- ^ Yamada Y, Sanchez-Aguilera A, Brandt EB a kol. (Září 2008). „FIP1L1 / PDGFRalpha synergizuje s SCF a indukuje systémovou mastocytózu u myšího modelu chronické eozinofilní leukémie / hypereosinofilního syndromu“. Krev. 112 (6): 2500–7. doi:10.1182 / krev-2007-11-126268. PMID 18539901.
- ^ Nimer SD (květen 2008). „Myelodysplastické syndromy“. Krev. 111 (10): 4841–51. doi:10.1182 / krev-2007-08-078139. PMID 18467609. S2CID 6802096.
- ^ Ottmann O, Dombret H, Martinelli G a kol. (Říjen 2007). „Dasatinib indukuje rychlé hematologické a cytogenetické odpovědi u dospělých pacientů s akutní lymfoblastickou leukémií s pozitivním chromosomem Philadelphia s rezistencí nebo intolerancí na imatinib: průběžné výsledky studie fáze 2“. Krev. 110 (7): 2309–15. doi:10.1182 / krev-2007-02-073528. PMID 17496201.
- ^ Boulos N, Mulder HL, Calabrese CR a kol. (Březen 2011). „Chemoterapeutika obcházejí vznik mutací BCR-ABL kinázy rezistentních na dasatinib v přesném myším modelu akutní lymfoblastické leukémie pozitivní na chromozom Philadelphia“. Krev. 117 (13): 3585–95. doi:10.1182 / krev-2010-08-301267. PMC 3072880. PMID 21263154.
- ^ O'Connell PA, Madureira PA, Berman JN, Liwski RS, Waisman DM (duben 2011). „Regulace S100A10 onkoproteinem PML-RAR-α“. Krev. 117 (15): 4095–105. doi:10.1182 / krev-2010-07-298851. PMID 21310922.
- ^ Duffy MJ, Crown J (listopad 2008). „Personalizovaný přístup k léčbě rakoviny: jak mohou biomarkery pomoci“. Klinická chemie. 54 (11): 1770–9. doi:10.1373 / clinchem.2008.110056. PMID 18801934.
- ^ Ribrag V, Koscielny S, Casasnovas O, et al. (Duben 2009). „Farmakogenetická studie u Hodgkinových lymfomů odhaluje dopad polymorfismů UGT1A1 na prognózu pacientů“. Krev. 113 (14): 3307–13. doi:10.1182 / krev-2008-03-148874. PMID 18768784.
- ^ Li Y, Ye X, Liu J, Zha J, Pei L (leden 2011). „Hodnocení fúzních proteinů EML4-ALK u nemalobuněčného karcinomu plic pomocí inhibitorů s malými molekulami“. Neoplazie. 13 (1): 1–11. doi:10.1593 / neo.101120. PMC 3022423. PMID 21245935.
- ^ A b Pao W, Girard N (únor 2011). "Nové mutace řidiče u nemalobuněčného karcinomu plic". Onkologie lancety. 12 (2): 175–80. doi:10.1016 / S1470-2045 (10) 70087-5. PMID 21277552.
- ^ Hewes, Arlington (2. října 2014). „Slibná metoda detekce rakoviny pankreatu roky před tradiční diagnostikou“. Singularity HUB. Citováno 2016-04-22.
- ^ Gupta, Digant; Lis, Christopher G. (10.10.2009). „Role CA125 v predikci přežití rakoviny vaječníků - přehled epidemiologické literatury“. Journal of Ovarian Research. 2 (1): 13. doi:10.1186/1757-2215-2-13. ISSN 1757-2215. PMC 2764643. PMID 19818123.
- ^ Bartels CL, Tsongalis GJ (duben 2009). „MicroRNA: nové biomarkery pro lidskou rakovinu“. Klinická chemie. 55 (4): 623–31. doi:10.1373 / clinchem.2008.112805. PMID 19246618.
- ^ Paulson, Kelly G .; Lewis, Christopher W .; Redman, Mary W .; Simonson, William T .; Lisberg, Aaron; Ritter, Deborah; Morishima, Chihiro; Hutchinson, Kathleen; Mudgistratova, Lola; Blom, Astrid; Iyer, Jayasri; Moshiri, Ata S .; Tarabadkar, Erica S .; Carter, Joseph J .; Bhatia, Shailender; Kawasumi, Masaoki; Galloway, Denise A .; Wener, Mark H .; Nghiem, Paul (2017). „Virové onkoproteinové protilátky jako marker recidivy karcinomu Merkelových buněk: prospektivní validační studie“. Rakovina. 123 (8): 1464–1474. doi:10.1002 / cncr.30475. PMC 5384867. PMID 27925665.
- ^ Proctor, M J; McMillan, DC; Morrison, DS; Fletcher, Cd; Horgan, PG; Clarke, S J (2012-07-24). „Odvozený poměr neutrofilů k lymfocytům předpovídá přežití u pacientů s rakovinou“. British Journal of Cancer. 107 (4): 695–699. doi:10.1038 / bjc.2012.292. ISSN 0007-0920. PMC 3419948. PMID 22828611.
- ^ A b Liu, Man; Xing, Lu-Qi (06.06.2017). „Základní fibroblastový růstový faktor jako potenciální biomarker pro diagnostiku zhoubných nádorových metastáz u žen“. Onkologické dopisy. 14 (2): 1561–1567. doi:10.3892 / ol.2017.6335. ISSN 1792-1074. PMC 5529833. PMID 28789380.
- ^ Fürstenberger, Gregor; Senn, Hans-Jörg (květen 2002). „Inzulinu podobné růstové faktory a rakovina“. Onkologie lancety. 3 (5): 298–302. doi:10.1016 / s1470-2045 (02) 00731-3. ISSN 1470-2045. PMID 12067807.
- ^ Yu, Herbert; Rohan, Thomas (2000-09-20). „Role rodiny růstových faktorů podobných inzulínu ve vývoji a progresi rakoviny“. JNCI: Journal of the National Cancer Institute. 92 (18): 1472–1489. doi:10.1093 / jnci / 92.18.1472. ISSN 0027-8874. PMID 10995803.
- ^ Vano, Yann-Alexandre; Oudard, Stéphane; Autor: Marie-Agnès; Têtu, Pauline; Thibault, Constance; Aboudagga, Sláva; Scotté, Florian; Elaidi, Reza (06.04.2018). „Optimální hranice pro poměr neutrofilů k lymfocytům: Fakta nebo fantazie? Prospektivní kohortní studie u pacientů s metastatickým karcinomem“. PLOS ONE. 13 (4): e0195042. Bibcode:2018PLoSO..1395042V. doi:10.1371 / journal.pone.0195042. ISSN 1932-6203. PMC 5889159. PMID 29624591.
- ^ Liu, Man; Xing, Lu-Qi (01.08.2017). „Základní fibroblastový růstový faktor jako potenciální biomarker pro diagnostiku zhoubných nádorových metastáz u žen“. Onkologické dopisy. 14 (2): 1561–1567. doi:10.3892 / ol.2017.6335. ISSN 1792-1074. PMC 5529833. PMID 28789380.
- ^ Torrente-Rodríguez, Rebeca M .; Ruiz-Valdepeñas Montiel, Víctor; Campuzano, Susana; Pedrero, María; Farchado, Meryem; Vargas, Eva; Manuel de Villena, F. Javier; Garranzo-Asensio, María; Barderas, Rodrigo; Pingarrón, José M. (04.04.2017). „Elektrochemický senzor pro rychlé stanovení receptoru 4 fibroblastového růstového faktoru v surových lyzátech rakovinných buněk“. PLOS ONE. 12 (4): e0175056. Bibcode:2017PLoSO..1275056T. doi:10.1371 / journal.pone.0175056. ISSN 1932-6203. PMC 5380347. PMID 28376106.
- ^ Denduluri, Sahitya K .; Idowu, Olumuyiwa; Wang, Zhongliang; Liao, Zhan; Yan, Zhengjian; Mohammed, Maryam K .; Ye, Jixing; Wei, Qiang; Wang, Jing; Zhao, Lianggong; Luu, Hue H. (březen 2015). „Signalizace inzulínového růstového faktoru (IGF) v tumorigenezi a rozvoji rezistence na léky proti rakovině“. Geny a nemoci. 2 (1): 13–25. doi:10.1016 / j.gendis.2014.10.004. ISSN 2352-3042. PMC 4431759. PMID 25984556.
