Cirkulující nádorová buňka - Circulating tumor cell
A cirkulující nádorová buňka (CTC) je buňka, která se vrhla do vaskulatura nebo lymfatických cév[1] od primárky nádor a je nesen kolem těla v krevní oběh. CTC mohou extravazovat a stát se semena pro následný růst dalších nádorů (metastázy ) ve vzdálených orgánech, mechanismus, který je zodpovědný za drtivou většinu úmrtí souvisejících s rakovinou.[2] Detekce a analýza CTC mohou pomoci časným prognózám pacientů a určit vhodnou léčbu na míru.[3] V současné době existuje jedna metoda FDA schválená pro detekci CTC, CellSearch, která se používá k diagnostice prsa, kolorektální a prostata rakovina.[4]
Detekce CTC, nebo tekutá biopsie, představuje několik výhod oproti tradičním biopsiím tkáně. Jsou neinvazivní, lze je použít opakovaně a poskytují užitečnější informace o metastatickém riziku, progresi onemocnění a účinnosti léčby.[5][6] Například analýza krevních vzorků od pacientů s rakovinou zjistila sklon ke zvýšené detekci CTC, jak onemocnění postupuje.[7] Provádění krevních testů je snadné a bezpečné a lze v průběhu času odebrat více vzorků. Naproti tomu analýza solidních nádorů vyžaduje invazivní postupy, které by mohly omezit dodržování předpisů pacientem. Schopnost sledovat progresi onemocnění v průběhu času by mohla usnadnit vhodnou úpravu léčby pacienta a potenciálně tak zlepšit jeho prognózu a kvalitu života. Důležitým aspektem schopnosti prognózovat budoucí progresi onemocnění je eliminace (alespoň dočasně) nutnosti chirurgického zákroku, pokud je počet opakovaných CTC nízký a nezvyšuje se; Mezi zjevné výhody vyhýbání se chirurgickému zákroku patří vyhýbání se riziku spojenému s vrozenou genogenitou nádoru u chirurgických operací. Za tímto účelem byly nedávno vyvinuty technologie s požadovanou citlivostí a reprodukovatelností pro detekci CTC u pacientů s metastatickým onemocněním.[8][9][10][11][12][13][14][15] Na druhou stranu jsou CTC velmi vzácné, často se vyskytují pouze jako několik buněk na mililiter krve, což znemožňuje jejich detekci. Kromě toho často vyjadřují řadu markerů, které se liší od pacienta k pacientovi, což ztěžuje vývoj technik s vysokou hodnotou citlivost a specifičnost.
Typy
CTC, které pocházejí z karcinomy (rakoviny epiteliálního původu, které jsou nejčastější) lze klasifikovat podle exprese epiteliálních markerů, jejich velikosti a podle toho, zda jsou apoptotické. Obecně platí, že CTC jsou anoikis -rezistentní, což znamená, že mohou přežít v krevním řečišti bez připojení k substrátu.[16]
- Tradiční CTC jsou charakterizovány neporušeným životaschopným jádrem; výraz EpCAM a cytokeratiny, které prokazují epiteliální původ; nepřítomnost CD45, což naznačuje, že buňka není hematopoetického původu; a jejich větší velikost, nepravidelný tvar nebo subcelulární morfologie.[17]
- CTC negativní na cytokeratin jsou charakterizovány nedostatkem EpCAM nebo cytokeratinů, což může naznačovat nediferencovaný fenotyp (cirkulující rakovinové kmenové buňky ) nebo získání mezenchymálního fenotypu (známého jako epiteliálně-mezenchymální přechod nebo EMT). Tyto populace CTC mohou být nejodolnější a nejvíce náchylné k metastázám. Je také obtížnější je izolovat, protože neexprimují ani cytokeratiny, ani CD45. Jinak jsou jejich morfologie, genová exprese a genomika podobné jako u jiných rakovinných buněk.[18]
- Apoptotické CTC jsou tradiční CTC, které procházejí apoptóza (programovaná buněčná smrt). Mohou být použity k monitorování odpovědi na léčbu, jak je experimentálně provedeno metodou Epic Sciences, která identifikuje jadernou fragmentaci nebo cytoplazmatické bubliny spojené s apoptózou. Měření poměru tradičních CTC k apoptotickým CTC - od základní hodnoty po terapii - poskytuje vodítka k účinnosti léčby při cílení a zabíjení rakovinných buněk.[18]
- Malé CTC jsou pozitivní na cytokeratin a CD45 negativní, ale s velikostí a tvarem podobným bílým krvinkám. Důležité je, že malé CTC mají biomarkery specifické pro rakovinu, které je identifikují jako CTC. Malé CTC se podílejí na progresivním onemocnění a diferenciaci na malobuněčné karcinomy, které často vyžadují odlišný terapeutický průběh.[19]
Klastry CTC
Klastry CTC jsou dva nebo více jednotlivých CTC spojených dohromady. Klastr CTC může obsahovat tradiční, malé nebo CK-CTC. Tyto klastry mají biomarkery specifické pro rakovinu, které je identifikují jako CTC. Několik studií uvádí, že přítomnost těchto klastrů je spojena se zvýšeným metastatickým rizikem a špatnou prognózou. Například jedna studie zahrnující rakovinu prostaty ukázala osmkrát delší průměrnou míru přežití u pacientů s pouze jedním CTC ve srovnání s pacienty s klastry CTC, zatímco jiné studie prokázaly podobné korelace u rakoviny tlustého střeva.[20][21] Kromě toho výčet klastrů CTC může poskytnout užitečné prognostické informace pro pacienty s již zvýšenými hladinami CTC.[22]
Jedna studie však uvádí, že na rozdíl od dosavadního konsensu je alespoň diskrétní populace těchto klastrů nezhoubná a místo toho pochází z endotelu nádoru.[23] Tyto cirkulující klastry nádor-endotel také ukazují epiteliálně-mezenchymální markery, ale neodráží genetiku primárního nádoru.
Dříve se předpokládalo, že klastry CTC nemohly kvůli své celkové velikosti projít úzkými plavidly, jako jsou kapiláry. Ukázalo se však, že klastry CTC se mohou „odvíjet“ prostřednictvím „selektivního štěpení mezibuněčných adhezí“, aby tyto konstrikce procházely jedním souborem a poté proces zrušily, jakmile je jasné. Toto chování by mohlo být faktorem, proč mají klastry CTC tak významný metastatický potenciál.[24]
Frekvence
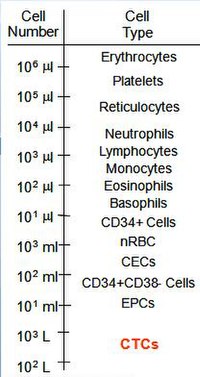
Detekce CTC může mít důležité prognostické a terapeutické důsledky, ale protože jejich počet může být velmi malý, tyto buňky nelze snadno detekovat.[25] Odhaduje se, že mezi buňkami, které se oddělily od primárního nádoru, může pouze 0,01% tvořit metastázy.[26]
Cirkulující nádorové buňky se u pacientů s metastatickým onemocněním vyskytují s frekvencí řádově 1-10 CTC na ml plné krve.[27] Pro srovnání, ml krve obsahuje několik milionů bílých krvinek a miliardu červených krvinek. Tato nízká frekvence spojená s obtížemi při identifikaci rakovinných buněk znamená, že klíčová součást porozumění biologickým vlastnostem CTC vyžaduje technologie a přístupy schopné izolovat 1 CTC na ml krve, a to buď obohacením, nebo ještě lépe testy bez obohacení, které identifikují všechny podtypy CTC v dostatečně vysokém rozlišení, aby uspokojily požadavky na diagnostickou patologii a kvantitu u pacientů s různými typy rakoviny.[18] K dnešnímu dni byly CTC detekovány u několika rakovin epitelu (prsu, prostaty, plic a tlustého střeva)[28][29][30][31] a klinické důkazy naznačují, že u pacientů s metastatickými lézemi je pravděpodobnější, že budou izolovány CTC.
CTC jsou obvykle (v roce 2011) zachyceny z vaskulatury pomocí specifických protilátek schopných rozpoznat specifický nádorový marker (obvykle EpCAM ); tento přístup je však předpojatý potřebou dostatečné exprese vybraného proteinu na buněčném povrchu, což je nutné pro krok obohacení. Navíc, protože EpCAM a další proteiny (např. cytokeratiny ) nejsou exprimovány v některých nádorech a mohou být sníženy během přechodu z epitelu do mezenchymu (EMT ), jsou nutné nové strategie obohacování.[32]
První důkazy naznačují, že markery CTC používané v humánní medicíně jsou u jiných druhů konzervovány. Pět z běžnějších markerů včetně CK19 je také užitečných pro detekci CTC v krvi psů se zhoubnými nádory prsu.[33][34] Novější přístupy dokážou identifikovat více buněk ze 7,5 ml krve, jako je IsofFux nebo Maintrac.[35][36] Ve velmi vzácných případech jsou CTC přítomny v dostatečně velkém množství, aby byly viditelné v rutině krevní nátěr zkouška. Toto se označuje jako karcinocytemie nebo leukémie z karcinomových buněk a je spojena se špatnou prognózou.[37]
Detekční metody

K dnešnímu dni byla vyvinuta celá řada výzkumných metod pro izolaci a vyjmenování CTC.[38] Jediný USA Úřad pro kontrolu potravin a léčiv (FDA) očištěnou metodikou pro výčet CTC v plné krvi je systém CellSearch.[39] Rozsáhlé klinické testování prováděné pomocí této metody ukazuje, že přítomnost CTC je silným prognostickým faktorem celkové přežití u pacientů s metastatickým karcinomem prsu, kolorektálního karcinomu nebo prostaty.[7][40][41][42][43][44][45]
CTC jsou klíčové pro pochopení biologie metastáz a slibují potenciál jako biomarker pro neinvazivní hodnocení progrese nádoru a odpovědi na léčbu. Izolace a charakterizace CTC však představují hlavní technologický problém, protože CTC tvoří minutový počet celkových buněk v cirkulující krvi, 1–10 CTC na ml plné krve ve srovnání s několika miliony bílých krvinek a miliardou červené krve buňky.[46] Proto je hlavní výzvou pro výzkumníky CTC převládající obtížnost čištění CTC, která umožňuje molekulární charakterizaci CTC. Bylo vyvinuto několik metod k izolaci CTC v periferní krvi a v zásadě spadají do dvou kategorií: biologické metody a fyzikální metody, stejně jako hybridní metody, které kombinují obě strategie. Techniky lze také klasifikovat podle toho, zda pro izolaci vybírají CTC (pozitivní výběr) nebo zda vylučují všechny krvinky (negativní výběr).
Biologické metody
Biologické metody izolují buňky na základě vysoce specifické vazby antigenu, nejčastěji pomocí monoklonální protilátky pro pozitivní výběr. Protilátky proti nádorově specifickým biomarkerům včetně EpCAM, HER2 a PSA bylo použito. Nejběžnější technikou je separace na bázi magnetických nanočástic (imunomagnetický test), jak se používá v CellSearch nebo MACS. Mezi další techniky, které jsou předmětem výzkumu, patří mikrofluidní separace[47] a kombinace imunomagnetického testu a mikrofluidní separace.[48][49][50][51] Při vývoji technologie mikrofabrikace jsou implementovány magnetické struktury v mikroskopickém měřítku, které poskytují lepší kontrolu nad magnetickým polem a pomáhají detekci CTC.[52][53][54] Onkolytické viry jako např vakcínie viry[55] jsou vyvinuty k detekci a identifikaci CTC. Existují alternativní metody, které se používají upravené bílkoviny místo protilátek, jako je malárie VAR2CSA protein, který se váže na oncofetal chondroitin sulfát na povrchu CTC.[56] CTC lze také získat přímo z krve upraveným Seldingerova technika, vyvinutý společností GILUPI GmbH.[57][58] Kovový drát pokrytý protilátkou se vloží do periferní žíly a zůstane tam po stanovenou dobu (30 minut). Během této doby se CTC z krve mohou vázat na protilátky (v současné době anti-EpCAM). Po inkubační době je drát odstraněn, promyt a nativní CTC, izolované z krve pacienta, mohou být dále analyzovány. Je možná molekulární genetika i imunofluorescenční barvení a několik dalších metod.[59][60] Výhodou této metody je vyšší objem krve, který lze analyzovat na CTC (přibližně 750 ml za 30 minut ve srovnání se 7,5 ml odebraného vzorku krve).
Metoda CellSearch
CellSearch je jedinou platformou pro izolaci CTC schválenou FDA. Tato metoda je založena na použití železa nanočástice potažený polymerní vrstvou nesoucí biotin analogy a konjugované s protilátkami proti EpCAM pro zachycení CTC. Izolace je spojena s analyzátorem, který pořizuje snímky izolovaných buněk po jejich barvení konjugáty specifických fluorescenčních protilátek. Krev je odebrána v EDTA zkumavka s přidaným konzervačním prostředkem. Po příjezdu do laboratoře se odstředí 7,5 ml krve a umístí se do systému pro přípravu. Tento systém nejprve obohacuje nádorové buňky imunomagneticky pomocí ferrofluidních nanočástic a magnetu. Následně jsou získané buňky permeabilizovány a obarveny nukleárním barvivem, proti kterému je konjugován fluorescenční protilátka CD45 (marker leukocytů) a cytokeratiny 8, 18 a 19 (epiteliální markery). Vzorek je poté skenován na analyzátoru, který pořizuje snímky skvrn nukleárního, cytokeratinového a CD45.[61] Aby byla buňka považována za CTC, musí obsahovat jádro, musí být pozitivní na cytoplazmatickou expresi cytokeratinu a také negativní na expresi markeru CD45 a musí mít průměr větší než 5 um. Pokud je celkový počet nádorových buněk, u nichž bylo zjištěno, že splňují výše uvedená kritéria, 5 nebo více, je vzorek krve pozitivní. Ve studiích prováděných na pacientech s rakovinou prostaty, prsu a tlustého střeva je střední přežití pacientů s metastázami s pozitivními vzorky přibližně polovina mediánu přežití pacientů s metastázami s negativními vzorky. Tento systém je charakterizován obnovovací kapacitou 93% a detekčním limitem jednoho CTC na 7,5 ml plné krve. U konkrétních typů rakoviny se více ukázaly alternativní metody, jako je IsoFlux citlivost.[62]
Metoda Parsortix
Tato automatizovaná metoda využívá filtraci velikosti k obohacení větších a méně stlačitelných cirkulujících nádorových buněk z jiných krevních složek. Systém Parsortix může odebírat vzorky krve v rozmezí od 1 ml do 40 ml. Jednorázová mikrofluidní kazeta s mezerou vysokou 6,5 mikronu umožňuje průchod drtivé většiny červených krvinek a bílých krvinek, zatímco větší vzácné buňky, včetně cirkulujících nádorových buněk a fetálních buněk, jsou zachyceny. Zachycené buňky mohou být buď automaticky obarveny protilátkami pro identifikaci, nebo mohou být uvolněny z kazety. Tyto uvolněné / sklizené buňky jsou živé a lze je analyzovat buněčnými a molekulárními technikami i kultivovat. Filtrační kazeta zachycuje nepřeberné množství různých typů rakovinných buněk.
Metoda epických věd
Tato metoda zahrnuje technologii k oddělení jaderných buněk od červených krvinek, kterým chybí jádro. Všechny jaderné buňky, včetně normálních bílých krvinek a CTC, jsou vystaveny fluorescenčně značeným protilátkám specifickým pro biomarkery rakoviny. Zobrazovací systém Epic navíc zachycuje obrázky všech buněk na sklíčku (přibližně 3 miliony), zaznamenává přesné souřadnice každé buňky a analyzuje každou buňku na 90 různých parametrů, včetně intenzity fluorescence čtyř fluorescenčních markerů a 86 různých morfologické parametry. Epic lze také použít RYBA a další barvicí techniky k hledání abnormalit, jako jsou duplikace, delece a přeskupení. Technologie zobrazování a analýzy také umožňuje znát souřadnice každé buňky na snímku, aby bylo možné ze snímku načíst jednu buňku pro analýzu pomocí sekvenování nové generace. Algoritmus trénovaný v hematopatologii zahrnuje řadu morfologických měření a také expresi z cytokeratinu a CD45. Algoritmus poté navrhuje kandidátské CTC, které proškolený čtenář potvrdí. Sledované buňky jsou analyzovány na relevantní fenotypové a genotypové markery, přičemž jako negativní kontroly jsou zahrnuty regionální bílé krvinky.[63] Molekulární testy společnosti Epic měří expresi proteinů a také vyšetřují genomové abnormality v CTC u více než 20 různých typů rakoviny.
Maintrac
Maintrac je a diagnostický krevní test mikroskopická aplikace platformy in vitro diagnostické metody k identifikaci vzácných buněk v tělních tekutinách a jejich molekulárních charakteristik. Je založen na pozitivní selekci pomocí protilátek specifických pro EpCAM.[64] Maintrac používá přístup založený na mikroskopické identifikaci cirkulujících nádorových buněk. Aby se zabránilo poškození a ztrátě buněk během procesu, používá Maintrac pouze dva kroky k identifikaci. Na rozdíl od mnoha jiných metod maintrac nečistí buňky ani je neobohacuje, ale identifikuje je v kontextu ostatních krevních sloučenin. K získání životně důležitých buněk a ke snížení stresu těchto buněk se krvinky připravují pouze jedním krokem centrifugace a lýzou erytrocytů. Stejně jako CellSearch používá maintrac protilátku EpCAM. Nepoužívá se však k obohacení, ale spíše jako fluorescenční marker k identifikaci těchto buněk. Spolu s nukleárním barvením propidium jodidem může metoda maintrac rozlišovat mezi mrtvými a živými buňkami. Jako potenciální nádorové buňky se počítá pouze vitální propidium s vyloučením EpCAM pozitivních buněk. Pouze živé buňky mohou růst do nádorů, takže umírání buněk pozitivních na EpCAM nemůže ublížit. Suspenze se analyzuje fluorescenční mikroskopií, která automaticky počítá události. Souběžně se zaznamenávají galerie událostí, aby se ověřilo, zda software našel skutečnou živou buňku, a aby se například rozlišovalo mezi buňkami epitelu kůže. Bližší validace metody ukázala, že další protilátky cytokeratinů nebo CD45 neměly žádnou výhodu.[36][65]
Na rozdíl od jiných metod maintrac nepoužívá počet jednotlivých buněk jako prognostický marker, ale Maintrac využívá dynamiku počtu buněk. Rostoucí počet nádorových buněk je důležitým faktorem, že aktivita nádoru pokračuje.[66] Snížení počtu buněk je známkou úspěšné terapie. Maintrac lze proto použít k ověření úspěšnosti chemoterapie[36][67] a dohlížet na léčbu během hormonální nebo udržovací léčby[68][69]Maintrac byl experimentálně používán k monitorování opakování rakoviny.[70][71] Studie používající přípravek Maintrac ukázaly, že u pacientů bez rakoviny lze v krvi nalézt buňky pozitivní na EpCAM.[72] Zánětlivé stavy jako Crohnova nemoc také vykazují zvýšené hladiny buněk pozitivních na EpCAM. Pacienti s těžkým popálením kůže mohou také nést buňky pozitivní na EpCAM v krvi. Proto použití buněk pozitivních na EpCAM jako nástroje pro včasnou diagnostiku není optimální.
Fyzikální metody
Fyzické metody jsou často založeny na filtrech, což umožňuje zachycení CTC pomocí velikost spíše než konkrétním epitopy.[15] ScreenCell je zařízení založené na filtraci, které umožňuje citlivou a specifickou izolaci CTC z plné lidské krve během několika minut.[73] Periferní krev je odebrána a zpracována do 4 hodin izolačním zařízením ScreenCell k zachycení CTC. Zachycené buňky jsou připraveny pro buněčnou kulturu nebo pro přímou charakterizaci pomocí hybridizačního testu in situ ViewRNA. Metoda Parsortix odděluje CTC na základě jejich velikosti a deformovatelnosti.[74]
Hybridní metody
Hybridní metody kombinují fyzickou separaci (gradienty, magnetická pole atd.) S vyhledáváním buněk zprostředkovaných protilátkami. Příkladem toho je citlivá dvojitá gradientová centrifugace a metoda detekce a výčtu magnetického třídění buněk, která byla použita k detekci cirkulujících epiteliálních buněk rakoviny u pacientů s rakovinou prsu negativní selekcí.[75] Princip negativního výběru je založen na získávání všech krvinky použitím panelu protilátek, stejně jako tradiční gradientovou centrifugací s Ficoll. Podobná metoda známá jako Test ISET byl použit k detekci cirkulujících buněk rakoviny prostaty[76][77][78] a k izolaci CTC z byla použita jiná technika známá jako RosetteStep malobuněčný karcinom plic pacientů.[79] Podobně vědci z Massachusetts General Hospital vyvinuli metodu negativního výběru, která využívá setrvačné zaměření na a mikrofluidní zařízení. Technika zvaná CTC-iChip nejprve odstraní buňky příliš malé na to, aby mohly být CTC, jako jsou červené krvinky, a poté pomocí magnetických částic odstraní bílé krvinky.[80]
Charakterizace CTC
Některé léky jsou zvláště účinné proti rakovině, která splňuje určité požadavky. Například, Herceptin je velmi efektivní u pacientů, kteří jsou Her2 pozitivní, ale mnohem méně efektivní u pacientů, kteří jsou Her2 negativní. Jakmile je primární nádor odstraněn, biopsie současného stavu rakoviny pomocí tradiční tkáňové typizace již není možná.[81] K typizaci se často používají tkáňové části primárního nádoru, odstraněné před lety. Další charakterizace CTC může pomoci určit současný fenotyp nádoru. Byly provedeny FISH testy na CTC a také stanovení IGF-1R, Her2, Bcl-2, ERG, PTEN, AR stav pomocí imunofluorescence.[6][82][83][84][85] Jednobuněčnou hladinu qPCR lze také provést s CTC izolovanými z krve.[Citace je zapotřebí ]
Orgánový tropismus CTC odvozeného od pacienta byl zkoumán na myším modelu.[86] CTC izolované od pacientů s rakovinou prsu a rozšířené in vitro prokázali, že mohou generovat kostní, plicní, vaječníkové a mozkové metastázy u myší, což částečně odráží sekundární léze zjištěné u odpovídajících pacientů. Je pozoruhodné, že jedna linie CTC - izolovaná dlouho před objevením se mozkových metastáz u pacienta - byla vysoce kompetentní pro generování mozkových metastáz u myší. Jednalo se o první prediktivní případ mozkových metastáz a důkaz koncepce, že vnitřní molekulární rysy metastatických prekurzorů mezi CTC mohou poskytnout nový pohled na mechanismy metastáz.
Buněčná morfologie
Morfologický vzhled je posuzován lidskými operátory, a proto podléhá velkým variacím mezi operátory.[87] Existuje několik metod výčtu CTC, které používají morfologický vzhled k identifikaci CTC, což může také aplikovat různá morfologická kritéria. Nedávná studie zaměřená na rakovinu prostaty ukázala, že mnoho různých morfologických definic cirkulujících nádorových buněk má podobnou prognostickou hodnotu, přestože absolutní počet buněk nalezených u pacientů a normálních dárců se mezi různými morfologickými definicemi lišil o více než deset let.[88]
Dějiny
CTC byly poprvé pozorovány v roce 1869 v krvi muže s metastatickým karcinomem Thomase Ashwortha, který předpokládal, že „buňky identické s buňkami samotné rakoviny, které jsou vidět v krvi, mohou mít tendenci vrhat nějaké světlo na způsob původu více nádorů existujících u stejné osoby ". Důkladné srovnání morfologie cirkulujících buněk do nádorových buněk z různých lézí vedlo Ashwortha k závěru, že „Jedna věc je jistá, že pokud [CTC] pocházejí ze stávající struktury rakoviny, musely projít větší částí oběhového systému, aby došly k vnitřní žilka saphena zvukové nohy “.[89]
Význam CTC v moderním výzkumu rakoviny začal v polovině 90. let, kdy se prokázalo, že CTC existují brzy v průběhu onemocnění.[90]Tyto výsledky byly umožněny díky mimořádně citlivé technologii magnetické separace ferrofluidy (koloidní magnetické nanočástice) a magnetické separátory s vysokým gradientem, které vynalezl Paul Liberti a motivovány teoretickými výpočty Liberti a Leon Terstappen, které naznačují, že velmi malé tumory vylučují buňky méně než 1,0% denně, by měly vést k detekovatelným buňkám v krvi.[91] Od té doby byla na výčet a identifikaci CTC použita celá řada dalších technologií.
Moderní výzkum rakoviny prokázal, že CTC pocházejí z klonů v primárním nádoru, což potvrzuje Ashworthovy poznámky.[92] Významné úsilí vynaložené na pochopení biologických vlastností CTC prokázalo kritickou roli, kterou cirkulující nádorové buňky hrají při metastatickém šíření karcinom.[93] Kromě toho vysoce citlivá analýza jednotlivých buněk prokázala vysokou úroveň heterogenity pozorovanou na úrovni jedné buňky jak pro expresi proteinu, tak pro lokalizaci proteinu[94] a CTC odrážely jak primární biopsii, tak změny pozorované v metastatických místech.[95]
Reference
- ^ Riquet, M; Rivera, C; Gibault, L; Pricopi, C; Mořidlo, P; Badia, A; Arame, A; Le Pimpec Barthes, F (2014). "[Lymfatické šíření rakoviny plic: anatomické řetězce lymfatických uzlin nezpevněné v zónách]". Revue de Pneumologie Clinique. 70 (1–2): 16–25. doi:10.1016 / j.pneumo.2013.07.001. PMID 24566031.
- ^ Gupta, GP; Massagué, J (17. listopadu 2006). "Metastáza rakoviny: budování rámce". Buňka. 127 (4): 679–95. doi:10.1016 / j.cell.2006.11.001. PMID 17110329. S2CID 7362869.
- ^ Regál B, Schindlbeck C, Jückstock J, Andergassen U, Hepp P, Zwingers T, Friedl T, Lorenz R, Tesch H, Fasching P, Fehm T, Schneeweiss A, Lichtenegger W, Beckmann M, Friese K, Pantel K, Janni W (2014). „Cirkulující nádorové buňky předpovídají přežití u pacientů s časným průměrným až vysokým rizikem rakoviny prsu“. Journal of the National Cancer Institute. 106 (5). doi:10.1093 / jnci / dju066. PMC 4112925. PMID 24832787.
- ^ Millner, LM; Linder, MW; Valdes R, Jr (NaN). „Cirkulující nádorové buňky: přehled současných metod a potřeba identifikovat heterogenní fenotypy“. Annals of Clinical and Laboratory Science. 43 (3): 295–304. PMC 5060940. PMID 23884225. Zkontrolujte hodnoty data v:
| datum =(Pomoc) - ^ Marrinucci, D; Bethel, K; Luttgen, M; Nieva, J; Kuhn, P; Kuhn, P (září 2009). „Cirkulující nádorové buňky z dobře diferencovaného adenokarcinomu plic si zachovávají cytomorfologické vlastnosti primárního typu nádoru“. Archivy patologie a laboratorní medicíny. 133 (9): 1468–71. doi:10.1043/1543-2165-133.9.1468 (neaktivní 2020-09-01). PMC 4422331. PMID 19722757.CS1 maint: DOI neaktivní od září 2020 (odkaz)
- ^ A b Attard G, Swennenhuis JF, Olmos D, Reid AH, Vickers E, A'Hern R, Levink R, Coumans F, Moreira J, Riisnaes R, Oommen NB, Hawche G, Jameson C, Thompson E, Sipkema R, Carden CP, Parker C, Dearnaley D, Kaye SB, Cooper CS, Molina A, Cox ME, Terstappen LW, de Bono JS (2009). „Charakterizace stavu genu ERG, AR a PTEN v cirkulujících nádorových buňkách u pacientů s kastra-rezistentním karcinomem prostaty“. Cancer Res. 69 (7): 2912–8. doi:10.1158 / 0008-5472.CAN-08-3667. PMID 19339269.
- ^ A b Cohen SJ, Punt CJ, Iannotti N, Saidman BH, Sabbath KD, Gabrail NY, Picus J, Morse M, Mitchell E, Miller MC, Doyle GV, Tissing H, Terstappen LW, Meropol NJ (2008). „Vztah cirkulujících nádorových buněk k odpovědi nádoru, přežití bez progrese a celkovému přežití u pacientů s metastatickým kolorektálním karcinomem“. J. Clin. Oncol. 26 (19): 3213–21. doi:10.1200 / JCO.2007.15.8923. PMID 18591556.
- ^ Yu M, Ting DT, Stott SL, Wittner BS, Ozsolak F, Paul S, Ciciliano JC, Smas ME, Winokur D, Gilman AJ, Ulman MJ, Xega K, Contino G, Alagesan B, Brannigan BW, Milos PM, Ryan DP , Sequist LV, Bardeesy N, Ramaswamy S, Toner M, Maheswaran S, Haber DA (2012). „Sekvenování RNA pankreatických cirkulujících nádorových buněk implikuje WNT signalizaci v metastázách“. Příroda. 487 (7408): 510–3. Bibcode:2012Natur.487..510Y. doi:10.1038 / příroda11217. PMC 3408856. PMID 22763454.
- ^ Sleijfer S, Gratama JW, Sieuwerts AM a kol. (2007). „Detekce cirkulujících nádorových buněk na cestě k rutinní implementaci diagnostiky?“. Eur J Cancer. 43 (18): 2645–50. doi:10.1016 / j.ejca.2007.09.016. PMID 17977713.
- ^ Hayes DF, Smerage J .; Směrage (2008). „Existuje role pro cirkulaci nádorových buněk při léčbě rakoviny prsu?“. Clin Cancer Res. 14 (12): 3646–50. doi:10.1158 / 1078-0432.CCR-07-4481. PMID 18559576.
- ^ Pantel K, Alix-Panabières C, Riethdorf S (2009). "Mikrometastázy rakoviny". Nat Rev Clin Oncol. 6 (6): 339–51. doi:10.1038 / nrclinonc.2009.44. PMID 19399023. S2CID 890927.
- ^ Pantel K, Riethdorf S .; Riethdorf (2009). „Patologie: předpovídají cirkulující nádorové buňky celkové přežití?“. Nature Reviews Clinical Oncology. 6 (4): 190–1. doi:10.1038 / nrclinonc.2009.23. PMID 19333222. S2CID 8904131.
- ^ Panteleakou Z, Lembessis P, Sourla A a kol. (2009). „Detekce cirkulujících nádorových buněk u pacientů s rakovinou prostaty: metodická úskalí a klinický význam“. Mol Med. 15 (3–4): 101–14. doi:10.2119 / molmed.2008.00116. PMC 2600498. PMID 19081770.
- ^ Esmaeilsabzali H, Beischlag TV, Cox ME, Parameswaran AM, Park EJ (2013). "Detekce a izolace cirkulujících nádorových buněk: principy a metody". Biotechnol. Adv. 31 (7): 1063–84. doi:10.1016 / j.biotechadv.2013.08.016. PMID 23999357.
- ^ A b Nieva, J; Wendel, M; Luttgen, MS; Marrinucci, D; Bazhenova, L; Kolatkar, A; Santala, R; Whittenberger, B; Burke, J; Torrey, M; Bethel, K; Kuhn, P (únor 2012). „Zobrazování cirkulujících nádorových buněk a souvisejících buněčných událostí u pacientů s nemalobuněčným karcinomem plic ve vysokém rozlišení: longitudinální analýza“. Fyzikální biologie. 9 (1): 016004. Bibcode:2012PhBio ... 9a6004N. doi:10.1088/1478-3975/9/1/016004. PMC 3388002. PMID 22306961.
- ^ Hong, Yupeng; Fang, Francia; Zhang, Qi (prosinec 2016). „Cirkulující shluky nádorových buněk: Co víme a co očekáváme (Recenze)“. International Journal of Oncology. 49 (6): 2206–2216. doi:10.3892 / ijo.2016.3747. PMC 5117994. PMID 27779656.
- ^ Racila, E; Euhus, D; Weiss, AJ; Rao, C; McConnell, J; Terstappen, LW; Uhr, JW (duben 1998). "Detekce a charakterizace buněk karcinomu v krvi". Sborník Národní akademie věd. 95 (8): 4589–4594. Bibcode:1998PNAS ... 95,4589R. doi:10.1073 / pnas.95.8.4589. PMC 22534. PMID 9539782.
- ^ A b C Marrinucci, Dena; Bethel, Kelly; Kolatkar, Anand; Luttgen, Madelyn; Malchiodi, Michael; Baehring, Franziska; Voigt, Katharina; Lazar, Daniel; Nieva, Jorge; Bazhenova, Lyudmilda; Ko, Andrew; Korn, W. Michael; Schram, Ethan; Coward, Michael; Yang, Xing; Metzner, Thomas; Lamy, Rachelle; Honnatti, Meghana; Yoshioka, Craig; Kunken, Joshua; Petrova, Yelena; Sok, Devin; Nelson, David; Kuhn, Peter (únor 2012). „Tekutinová biopsie u pacientů s metastatickým karcinomem prostaty, pankreatu a prsu“. Fyzikální biologie. 9 (1): 016003. Bibcode:2012PhBio ... 9a6003M. doi:10.1088/1478-3975/9/1/016003. PMC 3387996. PMID 22306768.
- ^ Ferraldeschi, Roberta; McDaniel, Andrew; Krupa, Rachel; Louw, Jessica; Tucker, Eric; Bales, Natalee; Marrinucci, Dena; Riisnaes, Ruth; Mateo, Joaquin; Dittamore, Ryan; De Bono, Johann Sebastian; Tomlins, Scott A .; Attard, Gerhardt (únor 2014). „CK- a fenotypy cirkulujících nádorových buněk (CTC) s malou jadernou velikostí u metastazujícího kastračně rezistentního karcinomu prostaty (mCRPC)“. Journal of Clinical Oncology. 32 (4_suppl): 209. doi:10.1200 / jco.2014.32.4_suppl.209.
- ^ Aceto N, Bardia A, Miyamoto DT, Donaldson MC, Wittner BS, Spencer JA, Yu M, Pely A, Engstrom A, Zhu H, Brannigan BW, Kapur R, Stott SL, Shioda T, Ramaswamy S, Ting DT, Lin CP , Toner M, Haber DA, Maheswaran S (2014). „Klastry cirkulujících nádorových buněk jsou oligoklonálními prekurzory metastáz rakoviny prsu“. Buňka. 158 (5): 1110–22. doi:10.1016 / j.cell.2014.07.013. PMC 4149753. PMID 25171411.
- ^ Divella R, Daniele A, Abbate I, Bellizzi A, Savino E, Simone G, Giannone G, Giuliani F, Fazio V, Gadaleta-Caldarola G, Gadaleta C, Lolli I, Sabbà C, Mazzocca A (2014). „Přítomnost shlukovaných cirkulujících nádorových buněk (CTC) a cirkulujících cytokinů definuje agresivní fenotyp u metastatického kolorektálního karcinomu“. Rakovina způsobuje kontrolu. 25 (11): 1531–41. doi:10.1007 / s10552-014-0457-4. PMID 25135616. S2CID 16377917.
- ^ Ye Z, Mu Z, Wang C, Palazzo JP, Biederman L, Li B, Jaslow R, Avery T, Austin L, Yang H, Cristofanilli M (2016). "Prognostické hodnoty počtu cirkulujících nádorových buněk (CTC) a jejich shluků u pokročilého karcinomu prsu". Výzkum rakoviny. 76 (4 dodatek): P2–08–09. doi:10.1158 / 1538-7445.SABCS15-P2-08-09.
- ^ Cima, I .; Kong, S.L .; Sengupta, D .; Tan, I.B .; Phyo, W. M .; Lee, D .; Hučení.; Iliescu, C .; Alexander, I .; Goh, W. L .; Rahmani, M .; Suhaimi, N.-A. M .; Vo, J. H .; Tai, J. A .; Tan, J. H .; Chua, C .; Ten, R .; Lim, W. J .; Chew, M. H .; Hauser, C. A. E .; van Dam, R. M .; Lim, W.-Y .; Prabhakar, S .; Lim, B .; Koh, P. K.; Robson, P .; Ying, J. Y .; Hillmer, A. M .; Tan, M.-H. (2016). „Nádorové cirkulující shluky endoteliálních buněk u kolorektálního karcinomu“. Science Translational Medicine. 8 (345): 345ra89. doi:10.1126 / scitranslmed.aad7369. hdl:10754/615874. ISSN 1946-6234. PMID 27358499. S2CID 26085239.
- ^ Au S, Storey B, Moore J, Tang Q, Chen Y, Javaid S, Sarioglu A, Sullivan R, Madden M, O'Keefe R, Haber D, Maheswaran S, Langenau D, Stott S, Toner M (2016). „Klastry cirkulujících nádorových buněk procházejí cévami velikosti kapiláry“. Sborník Národní akademie věd. 113 (18): 4937–52. Bibcode:2016PNAS..113,4947A. doi:10.1073 / pnas.1524448113. PMC 4983862. PMID 27091969.
- ^ Ghossein RA, Bhattacharya S, Rosai J. (1999). "Molekulární detekce mikrometastáz a cirkulujících nádorových buněk v solidních nádorech". Clin. Cancer Res. 5 (8): 1950–60. PMID 10473071.
- ^ Zhe, X; Cher M.L .; Bonfil R.D. (2011). „Cirkulující nádorové buňky: nalezení jehly v kupce sena“. Am J Cancer Res. 1 (6): 740–751. PMC 3195935. PMID 22016824.
- ^ A b Miller MC, Doyle GV, Terstappen LW (2010). „Význam cirkulujících nádorových buněk detekovaných systémem CellSearch u pacientů s metastatickým karcinomem prsu, kolorektálním karcinomem a prostatou“. J. Oncol. 2010: 1–8. doi:10.1155/2010/617421. PMC 2793426. PMID 20016752.
- ^ Swaby, RF; Cristofanilli, M (21. dubna 2011). „Cirkulující nádorové buňky u rakoviny prsu: nástroj, jehož doba dospěla“. BMC Medicine. 9: 43. doi:10.1186/1741-7015-9-43. PMC 3107794. PMID 21510857.
- ^ Danila, DC; Fleisher, M; Scher, HI (15. června 2011). „Cirkulující nádorové buňky jako biomarkery rakoviny prostaty“. Klinický výzkum rakoviny. 17 (12): 3903–12. doi:10.1158 / 1078-0432.CCR-10-2650. PMC 3743247. PMID 21680546.
- ^ Tanaka F, Yoneda K, Kondo N, Hashimoto M, Takuwa T, Matsumoto S, Okumura Y, Rahman S, Tsubota N, Tsujimura T, Kuribayashi K, Fukuoka K, Nakano T, Hasegawa S (2009). „Cirkulující nádorová buňka jako diagnostický marker u primární rakoviny plic“. Clin. Cancer Res. 15 (22): 6980–6. doi:10.1158 / 1078-0432.CCR-09-1095. PMID 19887487.
- ^ Negin, BP; Cohen, SJ (červen 2010). „Cirkulující nádorové buňky v kolorektálním karcinomu: minulé, současné a budoucí výzvy“. Aktuální možnosti léčby v onkologii. 11 (1–2): 1–13. doi:10.1007 / s11864-010-0115-3. PMID 20143276. S2CID 11881681.
- ^ Mikolajczyk, SD; Millar, LS; Tsinberg, P; Coutts, SM; Zomorrodi, M; Pham, T; Bischoff, FZ; Pircher, TJ (2011). „Detekce cirkulujících nádorových buněk negativních na epCAM a negativních na cytokeratin v periferní krvi“. Journal of Oncology. 2011: 1–10. doi:10.1155/2011/252361. PMC 3090615. PMID 21577258.
- ^ da Costa A, Oliveira JT, Gärtner F, Kohn B, Gruber AD, Klopfleisch R (2011). "Potenciální markery pro detekci cirkulujících psích nádorových buněk mléčné žlázy v periferní krvi". Veterinář J. 190 (1): 165–8. doi:10.1016 / j.tvjl.2010.09.027. PMID 21051248.
- ^ da Costa, A (2013). "Více markerů RT-PCR pro detekci cirkulujících nádorových buněk metastatických psích prsních nádorů". Veterinární věstník. 196 (1): 34–39. doi:10.1016 / j.tvjl.2012.08.021. PMID 23036177.
- ^ Harb, W .; Fan, A .; Tran, T .; Danila, D.C .; Keys, D .; Schwartz, M .; a Ionescu-Zanetti, C. (2013). „Mutační analýza cirkulujících nádorových buněk pomocí nového mikrofluidního odběrového zařízení a testu qPCR“. Transl. Oncol. 6 (5): 528–538. doi:10,1593 / tlo.13367. PMC 3799195. PMID 24151533.
- ^ A b C Pachmann K .; Camara O .; Kavallaris A .; Krauspe S .; Malarski N .; Gajda M .; Kroll T .; Jorke C .; Hammer U .; Altendorf-Hofmann A .; et al. (2008). „Monitorování odpovědi cirkulujících epitelových nádorových buněk na adjuvantní chemoterapii u rakoviny prsu umožňuje detekci pacientů s rizikem předčasného relapsu“. J. Clin. Oncol. 26 (8): 1208–1215. doi:10.1200 / JCO.2007.13.6523. PMID 18323545. S2CID 20074388.
- ^ Ronen, Shira; Kroft, Steven H .; Olteanu, Horatiu; Hosking, Paul R .; Harrington, Alexandra M. (2019). „Karcinocytemie: Vzácná entita se stává častější? Tříletá série sedmi případů a přehled literatury pro jednu instituci“. International Journal of Laboratory Hematology. 41 (1): 69–79. doi:10.1111 / ijlh.12924. ISSN 1751-5521. PMID 30216684.
- ^ Paterlini-Brechot P, Benali NL .; Benali (2007). „Detekce cirkulujících nádorových buněk (CTC): Klinický dopad a budoucí směry“. Cancer Lett. 253 (2): 180–204. doi:10.1016 / j.canlet.2006.12.014. PMID 17314005.
- ^ „Web Veridex CellSearch“. Březen 2010. Archivovány od originál dne 2008-06-05. Citováno 2010-03-14.
- ^ „Veridex LLC. Oznámení o uvedení na trh v oběhu soupravy nádorových buněk CellSearch - rozšířené indikace pro použití - metastatický karcinom prostaty“ (PDF). Březen 2010. Citováno 2010-03-14.[mrtvý odkaz ]
- ^ Cristofanilli M, Budd GT, Ellis MJ a kol. (2004). „Cirkulující nádorové buňky, progrese nemoci a přežití u metastazujícího karcinomu prsu“. NEJM. 351 (8): 781–91. doi:10.1056 / NEJMoa040766. PMID 15317891. S2CID 7445998.
- ^ Budd G, Cristofanilli M, Ellis M a kol. (2006). „Cirkulující nádorové buňky versus zobrazování - predikce celkového přežití u metastazujícího karcinomu prsu“. Clin Cancer Res. 12 (21): 6404–09. doi:10.1158 / 1078-0432.CCR-05-1769. PMID 17085652.
- ^ JS DeBono; HI Scher; RB Montgomery; et al. (2008). "Circulating Tumor Cells (CTC) predict survival benefit from treatment in metastatic castration resistant prostate cancer (CRPC)". Clin Cancer Res. 14 (19): 6302–9. doi:10.1158/1078-0432.CCR-08-0872. PMID 18829513.
- ^ Allard WJ, Matera J, Miller MC, et al. (2004). "Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with non-malignant diseases". Clin Cancer Res. 10 (20): 6897–6904. doi:10.1158 / 1078-0432.CCR-04-0378. PMID 15501967.
- ^ Riethdorf; Fritsche, H; Müller, V; Rau, T; Schindlbeck, C; Rack, B; Janni, W; Coith, C; et al. (2007). "Detection of Circulating Tumor Cells in Peripheral Blood of Patients with Metastatic Breast Cancer: A Validation Study of the CellSearch System". Clin Cancer Res. 13 (3): 920–8. doi:10.1158/1078-0432.CCR-06-1695. PMID 17289886.
- ^ Yu M.; et al. (2011). "Circulating tumor cells: approaches to isolation and characterization". The Journal of Cell Biology. 192 (3): 373–382. doi:10.1083/jcb.201010021. PMC 3101098. PMID 21300848.
- ^ Nagrath, Sunitha; Sequist, Lecia V.; Maheswaran, Shyamala; Bell, Daphne W .; Irimia, Daniel; Ulkus, Lindsey; Smith, Matthew R.; Kwak, Eunice L.; Digumarthy, Subba; Muzikansky, Alona; Ryan, Paula; Balis, Ulysses J.; Tompkins, Ronald G.; Haber, Daniel A.; Toner, Mehmet (December 2007). "Isolation of rare circulating tumour cells in cancer patients by microchip technology". Příroda. 450 (7173): 1235–1239. Bibcode:2007Natur.450.1235N. doi:10.1038/nature06385. PMC 3090667. PMID 18097410.
- ^ Hoshino, Kazunori; Huang, Yu-Yen; Lane, Nancy; Huebschman, Michael; Uhr, Jonathan W.; Frenkel, Eugene P.; Zhang, Xiaojing (Oct 2011). "Microchip-based immunomagnetic detection of circulating tumor cells". Laboratoř na čipu. 11 (20): 3449–3457. doi:10.1039/c1lc20270g. PMC 3379551. PMID 21863182.
- ^ Peng, Chen; Yu-yen, Huang; Hoshino, Kazunori; Xiaojing, Zhang (2014). "Multiscale immunomagnetic enrichment of circulating tumor cells: from tubes to microchips". Laboratoř na čipu. 14 (3): 446–458. doi:10.1039/C3LC51107C. PMID 24292816. S2CID 205863853.
- ^ Huang, Yu-yen; Hoshino, Kazunori; Chen, Peng; Wu, Chun-hsien; Lane, Nancy; Huebschman, Michael; Liu, Huaying; Sokolov, Konstantin; Uhr, Jonathan W. (2012-10-30). "Immunomagnetic nanoscreening of circulating tumor cells with a motion controlled microfluidic system". Biomedicínské mikrozařízení. 15 (4): 673–681. doi:10.1007/s10544-012-9718-8. ISSN 1387-2176. PMC 3584207. PMID 23109037.
- ^ Hoshino, Kazunori; Chen, Peng; Huang, Yu-Yen; Zhang, Xiaojing (2012-05-15). "Computational Analysis of Microfluidic Immunomagnetic Rare Cell Separation from a Particulate Blood Flow". Analytická chemie. 84 (10): 4292–4299. doi:10.1021/ac2032386. ISSN 0003-2700. PMC 3359653. PMID 22510236.
- ^ Chen, Peng; Huang, Yu-Yen; Hoshino, Kazunori; Zhang, John X.J. (2015-03-04). "Microscale Magnetic Field Modulation for Enhanced Capture and Distribution of Rare Circulating Tumor Cells". Vědecké zprávy. 5: 8745. Bibcode:2015NatSR...5E8745C. doi:10.1038/srep08745. ISSN 2045-2322. PMC 4348664. PMID 25735563.
- ^ Huang, Yu-Yen; Chen, Peng; Wu, Chun-Hsien; Hoshino, Kazunori; Sokolov, Konstantin; Lane, Nancy; Liu, Huaying; Huebschman, Michael; Frenkel, Eugene (2015-11-05). "Screening and Molecular Analysis of Single Circulating Tumor Cells Using Micromagnet Array". Vědecké zprávy. 5: 16047. Bibcode:2015NatSR...516047H. doi:10.1038/srep16047. ISSN 2045-2322. PMC 4633592. PMID 26538094.
- ^ Chen, Peng; Huang, Yu-Yen; Bhave, Gauri; Hoshino, Kazunori; Zhang, Xiaojing (2015-08-20). "Inkjet-Print Micromagnet Array on Glass Slides for Immunomagnetic Enrichment of Circulating Tumor Cells". Annals of Biomedical Engineering. 44 (5): 1710–1720. doi:10.1007/s10439-015-1427-z. ISSN 0090-6964. PMC 4761332. PMID 26289942.
- ^ Wang, Huiqiang; Chen, Nanhai G.; Minev, Boris R.; Zimmermann, Martina; Aguilar, Richard J.; Zhang, Qian; Sturm, Julia B.; Fend, Falko; Yu, Yong A.; Cappello, Joseph; Lauer, Ulrich M .; Szalay, Aladar A. (September 2013). "Optical Detection and Virotherapy of Live Metastatic Tumor Cells in Body Fluids with Vaccinia Strains". PLOS ONE. 8 (9): e71105. Bibcode:2013PLoSO...871105W. doi:10.1371/journal.pone.0071105. PMC 3760980. PMID 24019862.
- ^ Agerbæk, Mette Ø.; Bang-Christensen, Sara R.; Yang, Ming-Hsin; Clausen, Thomas M.; Pereira, Marina A.; Sharma, Shreya; Ditlev, Sisse B.; Nielsen, Morten A.; Choudhary, Swati; Gustavsson, Tobias; Sorensen, Poul H.; Meyer, Tim; Propper, David; Shamash, Jonathan; Theander, Thor G.; Aicher, Alexandra; Daugaard, Mads; Heeschen, Christopher; Salanti, Ali (16 August 2018). "The VAR2CSA malaria protein efficiently retrieves circulating tumor cells in an EpCAM-independent manner". Příroda komunikace. 9 (1): 3279. Bibcode:2018NatCo...9.3279A. doi:10.1038/s41467-018-05793-2. PMC 6095877. PMID 30115931.
- ^ GILUPI. "GILUPI - CellCollector in vivo CTC isolation". www.gilupi.de.
- ^ Saucedo-Zeni Nadia; et al. (2012). "A novel method for the in vivo isolation of circulating tumor cells from peripheral blood of cancer patients using a functionalized and structured medical wire". International Journal of Oncology. 41 (4): 1241–1250. doi:10.3892/ijo.2012.1557. PMC 3583719. PMID 22825490.
- ^ Luecke, Klaus, et al. "The GILUPI CellCollector as an in vivo tool for circulating tumor cell enumeration and molecular characterization in lung cancer patients." ASCO Annual Meeting Proceedings. Sv. 33. No. 15_suppl. 2015. http://hwmaint.meeting.ascopubs.org/cgi/content/abstract/33/15_suppl/e22035 Archivováno 10.03.2016 na Wayback Machine
- ^ Scheumann N; et al. (2015). "50P * Enumeration and Molecular Characterization of Circulating Tumor Cells in Lung Cancer Patients Using the Gilupi Cellcollector , an Effective in Vivo Device for Capturing CTCS". Annals of Oncology. 26: i14. doi:10.1093/annonc/mdv045.14.
- ^ "An Introduction to the CellSearch™" (PDF).[mrtvý odkaz ]
- ^ Sánchez-Lorencio, M.I.; Ramirez, P .; Saenz, L.; Martínez Sánchez, M.V.; De La Orden, V.; Mediero-Valeros, B.; Veganzones-De-Castro, S.; Baroja-Mazo, A.; Revilla Nuin, B.; Gonzalez, M.R.; Cascales-Campos, P.A.; Noguera-Velasco, J.A.; Minguela, A.; Díaz-Rubio, E.; Pons, J.A.; Parrilla, P. (November 2015). "Comparison of Two Types of Liquid Biopsies in Patients With Hepatocellular Carcinoma Awaiting Orthotopic Liver Transplantation". Řízení o transplantaci. 47 (9): 2639–2642. doi:10.1016/j.transproceed.2015.10.003. PMID 26680058.
- ^ Bethel, Kelly; Luttgen2, Madelyn; Damani, Samir; Kolatkar2, Anand; Lamy, Rachelle; Sabouri-Ghomi, Mohsen; Topol, Sarah; Topol2, Eric; Kuhn, Peter (9 Jan 2014). "Fluid phase biopsy for detection and characterization of circulating endothelial cells in myocardial infarction". Fyzikální biologie. 11 (1): 016002. Bibcode:2014PhBio..11a6002B. doi:10.1088/1478-3975/11/1/016002. PMC 4143170. PMID 24406475.
- ^ Pachmann, Katharina (5 April 2015). "Current and potential use of MAINTRAC method for cancer diagnosis and prediction of metastasis". Odborný přehled molekulární diagnostiky. 15 (5): 597–605. doi:10.1586/14737159.2015.1032260. PMID 25843106. S2CID 34030968.
- ^ Pachmann K.; Camara O.; Kavallaris A.; Schneider U.; Schünemann S.; Höffken K. (2005). "Quantification of the response of circulating epithelial cells to neodadjuvant treatment for breast cancer: a new tool for therapy monitoring". Breast Cancer Res. 7 (6): R975–979. doi:10.1186/bcr1328. PMC 1410761. PMID 16280045.
- ^ Lobodasch, Kurt; Fröhlich, Frank; Rengsberger, Matthias; Schubert, Rene; Dengler, Robert; Pachmann, Ulrich; Pachmann, Katharina (April 2007). "Quantification of circulating tumour cells for the monitoring of adjuvant therapy in breast cancer: An increase in cell number at completion of therapy is a predictor of early relapse". Prsa. 16 (2): 211–218. doi:10.1016/j.breast.2006.12.005. ISSN 0960-9776. PMID 17291754.
- ^ Camara O.; Rengsberger M.; Egbe A.; Koch A.; Gajda M.; Hammer U.; Jorke C.; Rabenstein C.; Untch M.; Pachmann K. (2007). "The relevance of circulating epithelial tumor cells (CETC) for therapy monitoring during neoadjuvant (primary systemic) chemotherapy in breast cancer". Ann. Oncol. 18 (9): 1484–1492. doi:10.1093/annonc/mdm206. PMID 17761704.
- ^ Pachmann K.; Camara O.; Kohlhase A.; Rabenstein C.; Kroll T.; Runnebaum I.B.; Hoeffken K. (2010). „Posouzení účinnosti cílené terapie pomocí cirkulujících epiteliálních nádorových buněk (CETC): příklad monitorování terapie SERM jako jedinečného nástroje k individualizaci terapie“. J. Cancer Res. Clin. Oncol. 137 (5): 821–828. doi:10.1007 / s00432-010-0942-4. PMC 3074080. PMID 20694797.
- ^ Pachmann K.; Camara O.; Kroll T.; Gajda M.; Gellner A.K.; Wotschadlo J.; Runnebaum I.B. (2011). "Efficacy control of therapy using circulating epithelial tumor cells (CETC) as "Liquid Biopsy": trastuzumab in HER2/neu-positive breast carcinoma". J. Cancer Res. Clin. Oncol. 137 (9): 1317–1327. doi:10.1007/s00432-011-1000-6. PMC 3155034. PMID 21739182.
- ^ Hekimian K.; Meisezahl S.; Trompelt K.; Rabenstein C.; Pachmann K. (2012). „Šíření a readheze epiteliálních buněk: analýza faktorů přispívajících k tvorbě metastáz u rakoviny prsu“. ISRN Oncol. 2012: 1–8. doi:10.5402/2012/601810. PMC 3317055. PMID 22530147.
- ^ Rolle A.; Günzel R.; Pachmann U.; Willen B.; Höffken K.; Pachmann K. (2005). "Increase in number of circulating disseminated epithelial cells after surgery for non-small cell lung cancer monitored by MAINTRAC is a predictor for relapse: A preliminary report". Svět J. Surg. Oncol. 3 (1): 18. doi:10.1186/1477-7819-3-18. PMC 1087511. PMID 15801980.
- ^ Camara Oumar; Kavallaris Andreas; Nöschel Helmut; Rengsberger Matthias; Jörke Cornelia; Pachmann Katharina (2006). "Seeding of Epithelial Cells into Circulation During Surgery for Breast Cancer: The Fate of Malignant and Benign Mobilized Cells". World Journal of Surgical Oncology. 4: 67. doi:10.1186/1477-7819-4-67. PMC 1599731. PMID 17002789.
- ^ Desitter I.; et al. (2011). "A New Device for Rapid Isolation by Size and Characterization of Rare Circulating Tumor Cells". Protinádorový výzkum. 31 (2): 427–442. PMID 21378321.
- ^ Miller, M. Craig; Robinson, Peggy S.; Wagner, Christopher; O'Shannessy, Daniel J. (14 August 2018). "The Parsortix™ Cell Separation System—A versatile liquid biopsy platform". Cytometrie část A. 93 (12): 1234–1239. doi:10.1002/cyto.a.23571. PMC 6586069. PMID 30107082.
- ^ Tkaczuk KH, Goloubeva O, Tait NS, Feldman F, Tan M, Lum ZP, Lesko SA, Van Echo DA, Ts'o PO (2008). "The significance of circulating epithelial cells in Breast Cancer patients by a novel negative selection method". Breast Cancer Res. Zacházet. 111 (2): 355–64. doi:10.1007/s10549-007-9771-9. PMID 18064568. S2CID 25370612.
- ^ Wang ZP, Eisenberger MA, Carducci MA, Partin AW, Scher HI, Ts'o PO (2000). "Identification and characterization of circulating prostate carcinoma cells". Rakovina. 88 (12): 2787–95. doi:10.1002/1097-0142(20000615)88:12<2787::aid-cncr18>3.0.co;2-2. PMID 10870062.
- ^ Polascik TJ, Wang ZP, Shue M, Di S, Gurganus RT, Hortopan SC, Ts'o PO, Partin AW (1999). "Influence of sextant prostate needle biopsy or surgery on the detection and harvest of intact circulating prostate cancer cells". J. Urol. 162 (3 Pt 1): 749–52. doi:10.1097/00005392-199909010-00034. PMID 10458358.
- ^ Ali A, Furusato B, Ts'o PO, Lum ZP, Elsamanoudi S, Mohamed A, Srivastava S, Moul JW, Brassell SA, Sesterhenn IA, McLeod DG (2010). "Assessment of circulating tumor cells (CTCs) in prostate cancer patients with low-volume tumors". Pathol. Int. 60 (10): 667–72. doi:10.1111/j.1440-1827.2010.02584.x. PMID 20846264.
- ^ Hodgkinson, Cassandra L; Morrow, Christopher J; Li, Yaoyong; Metcalf, Robert L; Rothwell, Dominic G; Trapani, Francesca; Polanski, Radoslaw; Burt, Deborah J; Simpson, Kathryn L; Morris, Karen; Pepper, Stuart D; Nonaka, Daisuke; Greystoke, Alastair; Kelly, Paul; Bola, Becky; Krebs, Matthew G; Antonello, Jenny; Ayub, Mahmood; Faulkner, Suzanne; Priest, Lynsey; Carter, Louise; Tate, Catriona; Miller, Crispin J; Blackhall, Fiona; Brady, Ged; Dive, Caroline (1 June 2014). "Tumorigenicity and genetic profiling of circulating tumor cells in small-cell lung cancer". Přírodní medicína. 20 (8): 897–903. doi:10.1038/nm.3600. PMID 24880617. S2CID 205393324.
- ^ Ozkumur E, Shah AM, Ciciliano JC, Emmink BL, Miyamoto DT, Brachtel E, Yu M, Chen PI, Morgan B, Trautwein J, Kimura A, Sengupta S, Stott SL, Karabacak NM, Barber TA, Walsh JR, Smith K, Spuhler PS, Sullivan JP, Lee RJ, Ting DT, Luo X, Shaw AT, Bardia A, Sequist LV, Louis DN, Maheswaran S, Kapur R, Haber DA, Toner M (2013). "Inertial focusing for tumor antigen-dependent and -independent sorting of rare circulating tumor cells". Science Translational Medicine. 5 (179): 179. doi:10.1126/scitranslmed.3005616. PMC 3760275. PMID 23552373.
- ^ Meng S, Tripathy D, Shete S, Ashfaq R, Haley B, Perkins S, Beitsch P, Khan A, Euhus D, Osborne C, Frenkel E, Hoover S, Leitch M, Clifford E, Vitetta E, Morrison L, Herlyn D, Terstappen LW, Fleming T, Fehm T, Tucker T, Lane N, Wang J, Uhr J (2004). "HER-2 gene amplification can be acquired as breast cancer progresses". Proc. Natl. Acad. Sci. USA. 101 (25): 9393–8. Bibcode:2004PNAS..101.9393M. doi:10.1073/pnas.0402993101. PMC 438987. PMID 15194824.
- ^ Hayes DF, Walker TM, Singh B, et al. (2002). "Monitoring Expression of HER-2 on Circulating Epithelial Cells in Patients with advanced Breast Cancer". Int J Oncol. 21 (5): 1111–8. doi:10.3892/ijo.21.5.1111. PMID 12370762.
- ^ O'Hara SM, Moreno JG, Zweitzig DR, et al. (2004). "Multigene Reverse Transcription-PCR Profiling of Circulating Tumor Cells in Hormone-Refractory Prostate Cancer". Clin Chem. 50 (5): 826–835. doi:10.1373/clinchem.2003.028563. PMID 14988224.
- ^ de Bono JS, Attard G, Adjei A, et al. (2007). "Potential Applications for Circulating Tumor Cells expressing the Insulin Growth Factor-I Receptor". Clin Cancer Res. 13 (12): 3611–6. doi:10.1158/1078-0432.CCR-07-0268. PMID 17575225.
- ^ Karp DD, Pollak MN, Cohen RB, et al. (2009). "Pharmacokinetics and Pharmacodynamics of the IGF-IR Inhibitor Figitumumab (CP-751,871) in Combination with Paclitaxel and Carboplatin". Journal of Thoracic Oncology. 4 (11): 1397–1403. doi:10.1097/JTO.0b013e3181ba2f1d. PMC 2941876. PMID 19745765.
- ^ Klotz, Remi; Thomas, Amal; Teng, Teng; Han, Sung Min; Iriondo, Oihana; Li, Lin; Restrepo-Vassalli, Sara; Wang, Alan; Izadian, Negeen; MacKay, Matthew; Moon, Byoung-San (2019-01-01). "Circulating tumor cells exhibit metastatic tropism and reveal brain metastasis drivers". Objev rakoviny. 10 (1): CD–19–0384. doi:10.1158/2159-8290.CD-19-0384. ISSN 2159-8274. PMC 6954305. PMID 31601552.
- ^ AGJ Tibbe; MC Miller; LWMM Terstappen (2007). "Statistical Considerations for Enumeration of Circulating Tumor Cells". Cytometrie část A. 71A (3): 132–142. doi:10.1002/cyto.a.20369. PMID 17200956. S2CID 6648226.
- ^ F. A. W. Coumans; C. J. M. Doggen; G. Attard; et al. (2010). "All circulating EpCAM1CK1CD452 objects predict overall survival in castration-resistant prostate cancer". Annals of Oncology. 21 (9): 1851–7. doi:10.1093/annonc/mdq030. PMID 20147742.
- ^ Ashworth, T. R (1869). "A case of cancer in which cells similar to those in the tumours were seen in the blood after death". Australian Medical Journal. 14: 146–7.
- ^ Racila, E.; Euhus, D.; Weiss, A. J .; Rao, C.; McConnell, J .; Terstappen, L. W. M. M.; Uhr, J. W. (1998). "Detection and characterization of carcinoma cells in the blood". Sborník Národní akademie věd. 95 (8): 4589–4594. Bibcode:1998PNAS...95.4589R. doi:10.1073/pnas.95.8.4589. ISSN 0027-8424. PMC 22534. PMID 9539782.
- ^ Paul Liberti (November 22, 2013). "The tools that fueled the new world of Circulating Tumor Cells by Paul A. Liberti – BioMagnetic Solutions". biomargneticsolutions.com. Archivovány od originál 26. září 2017. Citováno 25. září 2017.
- ^ Fehm T, Sagalowsky A, Clifford E, Beitsch P, Saboorian H, Euhus D, Meng S, Morrison L, Tucker T, Lane N, Ghadimi BM, Heselmeyer-Haddad K, Ried T, Rao C, Uhr J (Jul 2002). "Cytogenetic evidence that circulating epithelial cells in patients with carcinoma are malignant". Klinický výzkum rakoviny. 8 (7): 2073–84. PMID 12114406.
- ^ Fidler IJ (2003). "Timeline: The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited". Nature Reviews Cancer. 3 (6): 453–8. doi:10.1038/nrc1098. PMID 12778135. S2CID 9195161.
- ^ „Knihovna schůzky - knihovna schůzek“. meetinglibrary.asco.org.
- ^ Design, ISITE. "OÁZA". www.abstractsonline.com.
