Aminoacyláza - Aminoacylase
| aminoacyláza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.5.1.14 | ||||||||
| Číslo CAS | 9012-37-7 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
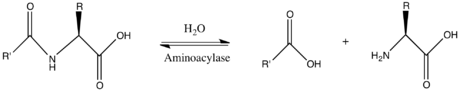
v enzymologie, an aminoacyláza (ES 3.5.1.14 ) je enzym že katalyzuje the chemická reakce
Tedy dva substráty tohoto enzymu jsou N-acyl-L-aminokyselina a H2Ó, zatímco jeho dva produkty jsou karboxylát a L-aminokyselina.
Tento enzym patří do rodiny hydrolázy, ti, kteří jednají vazby uhlík-dusík jiný než peptidové vazby, konkrétně lineární amidy. The systematické jméno z toho enzym třída je N-acyl-L-aminokyselina amidohydroláza. Mezi další běžně používaná jména patří dehydropeptidáza II, histozym, hippurikáza, benzamidáza, acyláza I, hippuráza, amidokyselinová deacyláza, L-aminoacyláza, acyláza, aminoacyláza I, L-aminokyselina acyláza, alfa-N-acylaminokyselina hydroláza, dlouhá acyl amidoacyláza, a krátká acyl amidoacyláza. Tento enzym účastní se močovinový cyklus a metabolismus aminoskupin.
Struktura enzymu

Ke konci roku 2007 dva struktur byly vyřešeny pro tuto třídu enzymy, s PDB přístupové kódy 1Q7L a 1YSJ. Tyto struktur také odpovídají dvěma známým primární aminokyselinové sekvence pro aminoacylázy. Související články identifikují dva typy domén obsahující aminoacylázy: Zinek vazebné domény - které vážou Zn2+ ionty - a domén které usnadňují dimerizace z Zinek vazebné domény.[1][2] Je to toto dimerizace to umožňuje katalýza nastat, protože aminoacylázy Aktivní stránky leží mezi jeho dvěma Zinek vazba domén.[1]
Vázaný Zinek usnadňuje vazba z N-acyl-L-aminokyselina Podklad, způsobující a konformační posun který přináší bílkoviny podjednotky společně kolem Podklad a umožňující katalýza nastat.[3] Aminoacyláza 1 existuje v heterotetramerní struktura, což znamená 2 Zinek vazebné domény a 2 dimerizace domén sejít, aby se aminoacyláza 1 je kvartérní struktura.
Enzymový mechanismus
Aminoacyláza je a metaloenzym to potřebuje Zinek (Zn2+ ) jako kofaktor fungovat.[3][4] The Zinek ionty uvnitř aminoacylázy jsou koordinovány histidin, glutamát, aspartát, a voda.[1][3][5] The Zinek ion polarizuje the voda, usnadňující jeho deprotonace blízkým základní zbytek.[3][5] Záporně nabitá hydroxidový ion je nukleofilní a útočí na elektrofilní karbonyl uhlík z substráty acylová skupina.[5] Přesný mechanismus poté, co tento bod není znám, s jednou možností je, že karbonyl se pak reformuje, rozbije amidová vazba, a tvoří dva produkty. V určitém okamžiku v mechanismus, další voda molekula vstoupí a souřadnice s Zinek, vrácení enzym do původního stavu.[5]
Nukleofilní útok vodou je krok omezující rychlost aminoacylázy katalytické mechanismus.[6] Tento nukleofilní útok je reverzibilní, zatímco následující kroky jsou rychlé a nevratné.[6] Tato reakční sekvence je příkladem Kinetika Michaelis – Menten, což umožňuje určit K.M, K.kočka, PROTImax, číslo obratu, a substrátová specificita prostřednictvím klasiky Michaelis-Menten enzym experimenty.[6] Druhý a třetí krok vpřed způsobí vznik a uvolnění reakčních reakcí produkty.[6]
Biologická funkce

Aminoacylázy jsou vyjádřeny v ledviny, kde recyklují N-acyl-L-aminokyseliny tak jako L-aminokyseliny a pomoc při regulaci močovinového cyklu.
N-acyl-L-aminokyseliny se tvoří, když L-aminokyseliny mít jejich N-konec kovalentně vázané do acylová skupina. The acylová skupina poskytuje stabilitu pro aminokyselina, čímž je odolnější vůči degradaci. Dodatečně, N-acyl-L-aminokyseliny nelze použít přímo jako stavební kameny pro bílkoviny a musí být nejprve převedeny na L-aminokyseliny aminoacylázou. Opět platí, že L-aminokyselina produkty lze použít pro biosyntéza nebo katabolizováno energie.
Aminoacyláza se podílí na nařízení z močovinový cyklus. N-acetyl-L-glutamát je alosterický aktivátor z karbamoylfosfát syntetáza, zásadní enzym který zavazuje NH4+ molekuly do močovinový cyklus.[7] Cyklus močoviny se zbaví přebytku amoniak (NH4+ ) v těle, což je proces, který musí být v době zvýšené zvýšen proteinový katabolismus, tak jako aminokyselina členění produkuje velké množství NH4+.[7] Když se zvyšuje katabolismus aminokyselin, N-acetylglutamát syntáza je up-regulovaný, produkující více N-acetyl-L-glutamátu, který up-reguluje karbamoylfosfát syntetáza a umožňuje mu zbavit se přebytku NH4+ z katabolismus.[7]
Aminoacyláza je nadměrně regulována v době nedostatku živin nebo hladovění způsobující N-acetyl-L-glutamát rozdělení, které down-reguluje karbamoylfosfát syntetáza a zbytek močovinový cyklus. Tato reakce je evolučně výhodná, protože nedostatek živin znamená, že toho není tolik NH4+ které je třeba zlikvidovat a protože tělo chce zachránit tolik aminokyselin, kolik jen může.[7]
Relevance nemoci
Nedostatek aminokyseliny 1 (A1D ) je vzácný choroba způsobeno autosomálně recesivní mutace v aminoacyláza 1 gen (ACY1 ) zapnuto chromozom 3p21.[8][9][10][11][12] Nedostatek funkčnosti aminoacyláza 1 způsobený A1D vede k nefunkčnosti močovinový cyklus, způsobující pole neurologické poruchy počítaje v to záchvaty, svalnatý hypotonie, mentální retardace, a zhoršený psychomotorický vývoj.[8][13][14][15] A1D byl také spojován s autismus .[16] Pacienti s A1D často začnou projevovat příznaky krátce poté narození ale zdá se, že se v příštích několika letech plně zotaví.[13][14][15]
Nedostatek aminokyseliny 2 - také známý jako Canavanova nemoc - Je další vzácné onemocnění způsobené a mutace v Gen ASPA (na chromozom 17 ) který vede k nedostatku v enzym aminoacyláza 2. Aminoacyláza 2 je známý tím, že může hydrolyzovat N-acetylaspartát zatímco aminoacyláza 1 nemůže.[17]
Průmyslová relevance
Aminoacylasy byly použity pro výrobu L-aminokyseliny v průmyslová nastavení od konce 50. let.[18] Protože aminoacylázy jsou Podklad specifické pro N-acyl-L-aminokyseliny a ne N-acyl-D-aminokyseliny, aminoacylázy lze použít ke spolehlivému přijetí a směs z těchto dvou reaktanty a převést pouze L enantiomery do produkty - které lze poté izolovat pomocí rozpustnost od nezreagovaného N-acyl-D-aminokyseliny.[18][19] Zatímco toto proces bylo provedeno v dávkový reaktor po mnoho let rychlejší a méně nehospodárné proces byl vyvinut na konci sedmdesátých let, kdy byly aminokyseliny umístěny do a sloupec ten N-acyl -aminokyseliny pak byly průběžně promývány.[18][20] Tento proces je stále používán v průmyslová nastavení dnes převést N-acyl-aminokyseliny na aminokyseliny v enantiomericky konkrétním způsobem.
Vývoj
Mnoho vědecké studie během poslední poloviny století použili jako svou vzorovou aminoacylázu prasečí aminoacylázu enzym.[21] The aminokyselina sekvence a primární struktura prasečí aminoacylázy.[4] Prase aminoacyláza 1 se skládá ze dvou identických heterodimerní podjednotky, z nichž každá obsahuje 406 aminokyselin, s acetylalanin na N-konci každého z nich.[4] Prase aminoacyláza se liší od člověk aminoacyláza struktura ale replikuje svou funkci.[1][4][22] Z těchto údajů lze odvodit, že tito dva enzymy se vyvinul ze společného předka protein, zachování funkce, ale rozbíhající se struktura přesčas.[1][4]
Reference
- ^ A b C d E Lindner HA, Lunin VV, Alary A, Hecker R, Cygler M, Ménard R (listopad 2003). „Základní role ligace zinku a dimerizace enzymu pro katalýzu v rodině aminoacylázy-1 / M20“. The Journal of Biological Chemistry. 278 (45): 44496–504. doi:10,1074 / jbc.M304233200. PMID 12933810.
- ^ Fones WS, Lee M (duben 1953). „Hydrolýza N-acylových derivátů alaninu a fenylalaninu acylázou I a karboxypeptidázou“. The Journal of Biological Chemistry. 201 (2): 847–56. PMID 13061423.
- ^ A b C d Lindner HA, Alary A, Wilke M, Sulea T (duben 2008). "Probing acyl-binding pocket of aminoacylase-1". Biochemie. 47 (14): 4266–75. doi:10.1021 / bi702156h. PMID 18341290.
- ^ A b C d E Mitta M, Ohnogi H, Yamamoto A, Kato I, Sakiyama F, Tsunasawa S (prosinec 1992). „Primární struktura prasečí aminoacylázy 1 odvozená ze sekvence cDNA“. Journal of Biochemistry. 112 (6): 737–42. doi:10.1093 / oxfordjournals.jbchem.a123968. PMID 1284246.
- ^ A b C d Hernick M, Fierke CA (leden 2005). „Hydrolázy zinku: mechanismy deacetyláz závislých na zinku“. Archivy biochemie a biofyziky. 433 (1): 71–84. doi:10.1016 / j.abb.2004.08.006. PMID 15581567.
- ^ A b C d Otvös L, Moravcsik E, Mády G (září 1971). „Vyšetřování mechanismu hydrolýzy acylaminokyseliny katalyzované acylázou-I“. Sdělení o biochemickém a biofyzikálním výzkumu. 44 (5): 1056–64. doi:10.1016 / S0006-291X (71) 80192-4. PMID 5160398.
- ^ A b C d Berg, Jeremy M .; Tymoczko, John L .; Stryer, Lubert (2012). Biochemie. New York: W. H. Freeman and Company. p. 688. ISBN 978-1-4292-2936-4.
- ^ A b Sommer A, Christensen E, Schwenger S a kol. (Červen 2011). „Molekulární podstata deficitu aminoacylázy 1“ (PDF). Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1812 (6): 685–90. doi:10.1016 / j.bbadis.2011.03.005. PMID 21414403.
- ^ Ferri L, Funghini S, Fioravanti A, et al. (Říjen 2013). "Nedostatek aminoacylázy I v důsledku přeskočení exonu mRNA ACY1". Klinická genetika. 86 (4): 367–372. doi:10.1111 / cge.12297. PMID 24117009. S2CID 24017306.
- ^ Miller YE, Minna JD, Gazdar AF (červen 1989). „Nedostatek exprese aminoacylázy-1 u malobuněčného karcinomu plic. Důkazy o inaktivaci genů kódovaných chromozomem 3p“. The Journal of Clinical Investigation. 83 (6): 2120–4. doi:10,1172 / JCI114125. PMC 303939. PMID 2542383.
- ^ EntrezGene 95
- ^ Miller YE, Drabkin H, Jones C, Fisher JH (září 1990). "Lidská aminoacyláza-1: klonování, regionální přiřazení k distálnímu chromozomu 3p21.1 a identifikace křížově hybridizující sekvence na chromozomu 18". Genomika. 8 (1): 149–54. doi:10.1016 / 0888-7543 (90) 90237-O. PMID 1707030.
- ^ A b Sass JO, Mohr V, Olbrich H a kol. (Březen 2006). „Mutace v ACY1, genu kódujícím aminoacylázu 1, způsobují novou vrozenou chybu metabolismu“. American Journal of Human Genetics. 78 (3): 401–9. doi:10.1086/500563. PMC 1380284. PMID 16465618.
- ^ A b Sass JO, Olbrich H, Mohr V a kol. (Červen 2007). "Neurologické nálezy u deficitu aminoacylázy 1". Neurologie. 68 (24): 2151–3. doi:10.1212 / 01.wnl.0000264933.56204.e8. PMID 17562838. S2CID 43376960.
- ^ A b Van Coster RN, Gerlo EA, Giardina TG a kol. (Prosinec 2005). "Aminoacylase I deficit: a new vrozená chyba metabolismu". Sdělení o biochemickém a biofyzikálním výzkumu. 338 (3): 1322–6. doi:10.1016 / j.bbrc.2005.10.126. PMID 16274666.
- ^ Tylki-Szymanska A, Gradowska W, Sommer A a kol. (Prosinec 2010). "Nedostatek aminokyseliny 1 spojený s autistickým chováním". Journal of Inherited Metabolic Disease. 33 Suppl 3: S211–4. doi:10.1007 / s10545-010-9089-3. PMID 20480396. S2CID 13374954.
- ^ Xie Q, Guo T, Wang T, Lu J, Zhou HM (listopad 2003). "Aspartátem indukovaná aminoacyláza skládání a tvorba roztaveného globulu". International Journal of Biochemistry & Cell Biology. 35 (11): 1558–72. doi:10.1016 / S1357-2725 (03) 00131-6. PMID 12824065.
- ^ A b C Sato, Tadashi; Tosa, Tetsuya (2010). "Produkce L-aminokyselin pomocí aminoacylázy". Encyclopedia of Industrial Biotechnology. str. 1–20. doi:10.1002 / 9780470054581.eib497. ISBN 978-0-470-05458-1.
- ^ Birnbaum SM, Levintow L, Kingsley RB, Greenstein JP (leden 1952). „Specifičnost aminokyselin acyláz“. The Journal of Biological Chemistry. 194 (1): 455–70. PMID 14927637.
- ^ Huang MQ, Zhou HM (1994). "Alkalické rozvinutí a solí indukované skládání aminoacylázy při vysokém pH". Enzym a bílkoviny. 48 (4): 229–37. doi:10.1159/000474993. PMID 8821711.
- ^ Koreishi M, Asayama F, Imanaka H a kol. (Říjen 2005). „Čištění a charakterizace nové aminoacylázy ze Streptomyces mobaraensis“. Bioscience, biotechnologie a biochemie. 69 (10): 1914–22. doi:10,1271 / bbb.69.1914. PMID 16244442.
- ^ Mitta M, Kato I, Tsunasawa S (srpen 1993). "Nukleotidová sekvence lidské aminoacylázy-1". Biochimica et Biophysica Acta (BBA) - genová struktura a exprese. 1174 (2): 201–3. doi:10.1016 / 0167-4781 (93) 90116-U. PMID 8357837.