Aldolová reakce - Aldol reaction
| Aldolová reakce | |
|---|---|
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | přidání aldolu |
| RSC ontologické ID | RXNO: 0000016 |
The aldolová reakce je prostředek formování vazby uhlík-uhlík v organická chemie.[1][2][3]Objevil nezávisle ruský chemik Alexander Borodin v roce 1869[4] a francouzským chemikem Charles-Adolphe Wurtz v roce 1872,[5][6][7] reakce kombinuje dvě karbonyl sloučeniny (použité původní experimenty aldehydy ) za vzniku nové β-hydroxykarbonylové sloučeniny. Tyto produkty jsou známé jako aldoly, od aldehyd + alkoholol, strukturální motiv viděný u mnoha produktů. Aldolové strukturní jednotky se nacházejí v mnoha důležitých molekulách, ať už přirozeně se vyskytujících nebo syntetických.[8][9][10]Například aldolová reakce byla použita při velkovýrobě komoditní chemikálie pentaerythritol[11]a syntéza léku na srdeční choroby Lipitor (atorvastatin, vápenatá sůl).[12][13]
Aldolová reakce spojuje dvě relativně jednoduché molekuly do složitějšího. Vzniká větší složitost, protože až dvě nové stereogenní centra (na α- a β-uhlík aldolového aduktu, označeného hvězdičkami v níže uvedeném schématu). Moderní metodologie je schopná nejen umožnit, aby aldolové reakce probíhaly vysoko výtěžek ale také ovládání relativního a absolutní konfigurace z nich stereocentra.[14] Tato schopnost selektivně syntetizovat konkrétní stereoizomer je významný, protože různé stereoizomery mohou mít velmi odlišné chemické a biologické vlastnosti.
Například stereogenní aldolové jednotky jsou zvláště běžné v polyketidy, třída molekuly nacházející se v biologických organismech. V přírodě jsou polyketidy syntetizovány pomocí enzymy tento účinek iterativní Claisenovy kondenzace. 1,3-dikarbonylové produkty těchto reakcí pak mohou být různě derivatizovány za vzniku široké škály zajímavých struktur. Taková derivitizace často zahrnuje redukci jedné z karbonylových skupin za vzniku aldolové podjednotky. Některé z těchto struktur mají silné biologické vlastnosti: imunosupresivum FK506, protinádorový činidlo discodermolid, nebo antifungální látka amfotericin B, například. Ačkoli syntéza mnoha takových sloučenin byla kdysi považována za téměř nemožnou, aldolová metodologie umožnila jejich účinnost syntéza v mnoha případech.[15]

Typický moderní aldol adiční reakce, zobrazené výše, může zahrnovat nukleofilní adice a keton enolát do aldehyd. Jakmile se aldolový produkt vytvoří, může někdy ztratit molekulu vody založit a, p-nenasycená karbonylová sloučenina. Tomu se říká kondenzace aldolu. Při aldolové reakci lze použít různé nukleofily, včetně enoly, enoláty a enol ethery ketonů, aldehydů a mnoha dalších karbonyl sloučeniny. The elektrofilní partnerem je obvykle aldehyd nebo keton (mnoho variací, například Mannichova reakce, existují). Pokud se nukleofil a elektrofil liší, reakce se nazývá a zkřížená aldolová reakce; naopak, když jsou nukleofil a elektrofil stejné, reakce se nazývá an aldol dimerizace.

Baňka vpravo je řešením lithium diisopropylamid (LDA) v tetrahydrofuran (THF). Baňka vlevo je roztokem lithného enolátu z tert-butylpropionát (vzniklý přidáním LDA k tert-butylpropionát). Potom může být do enolátové baňky přidán aldehyd pro zahájení adiční reakce s aldoly.
Obě baňky se ponoří do směsi suchého ledu a acetonu chladicí lázeň (-78 ° C), jejíž teplota je sledována termočlánkem (vodič vlevo).
Mechanismy
Aldolová reakce může probíhat dvěma zásadně odlišnými mechanismy. Karbonylové sloučeniny, jako jsou aldehydy a ketony, lze převést na enoly nebo enolethery. Tyto druhy jsou nukleofilní na α-uhlík, mohou napadat zvláště reaktivní protonované karbonyly, jako jsou protonované aldehydy. Toto je „enolový mechanismus“. Karbonylové sloučeniny uhlíkové kyseliny, mohou být také deprotonovány za vzniku enolátů, které jsou mnohem nukleofilnější než enoly nebo enolethery a mohou přímo napadat elektrofily. Obvyklým elektrofilem je aldehyd, protože ketony jsou mnohem méně reaktivní. Toto je „enolátový mechanismus“.
Pokud jsou podmínky obzvláště drsné (např .: NaOMe / MeOH /reflux ), může dojít ke kondenzaci, ale tomu se obvykle lze vyhnout pomocí mírných činidel a nízkých teplot (např. LDA (silná báze), THF, -78 ° C). Ačkoli přidání aldolu obvykle pokračuje téměř za nezvratných podmínek, izolované aldolové adukty jsou citlivé na retroaldolové štěpení indukované bází za účelem návratu výchozích látek. Naproti tomu retroaldolová kondenzace je vzácná, ale možná.[16]

Enol mechanismus
Pokud se použije kyselý katalyzátor, počáteční krok v mechanismus reakce zahrnuje kyselinou katalyzovaný tautomerizace karbonylové sloučeniny na enol. Kyselina také slouží k aktivaci karbonylové skupiny jiná molekula protonací, čímž je vysoce elektrofilní. Enol je nukleofilní na α-uhlíku, což mu umožňuje napadat protonovanou karbonylovou sloučeninu, což vede k aldolu po deprotonace. To se obvykle dehydratuje za vzniku nenasycené karbonylové sloučeniny. Schéma ukazuje typickou kyselinou katalyzovanou autokondenzaci aldehydu.
Kyselinou katalyzovaný aldolový mechanismus

Kyselinou katalyzovaná dehydratace

Enolátový mechanismus
Pokud katalyzátor je umírněná základna jako hydroxid ion nebo an alkoxid K aldolové reakci dochází nukleofilním útokem rezonančně stabilizovaný enolát na karbonylové skupině jiné molekuly. Produktem je alkoxid sůl aldolového produktu. Poté se vytvoří samotný aldol, který pak může podléhat dehydrataci za vzniku nenasycené karbonylové sloučeniny. Schéma ukazuje jednoduchý mechanismus bazálně katalyzované aldolové reakce aldehydu se sebou samým.
Aldolová reakce katalyzovaná bází (zobrazeno pomocí −OCH3 jako základ)

Báze katalyzovaná dehydratace (často psáno nesprávně jako jeden krok, viz E1cB eliminační reakce )

Ačkoli je v některých případech zapotřebí pouze katalytické množství báze, obvyklejším postupem je použít a stechiometrický množství silné báze, jako je LDA nebo NaHMDS. V tomto případě je tvorba enolátu nevratná a aldolový produkt se tvoří až po protonaci alkoxidu kovu aldolového produktu v samostatném kroku zpracování.
Model Zimmerman – Traxler
Jsou známy rafinovanější formy mechanismu. V roce 1957 Howard Zimmerman a Marjorie D. Traxler navrhli, že některé aldolové reakce mají „šestičlenné přechodové stavy mající a konformace židle."[17] Toto je nyní známé jako Model Zimmerman – Traxler. E-enoláty vedou k anti produkty, zatímco Z-enoláty vedou k syn produkty. Faktory, které řídí selektivitu, jsou preference pro umístění substituentů ekvatoriálně v šestičlenných přechodových stavech a vyhýbání se interakce syn-pentan, resp.[18] E a Z odkazovat na cis-trans stereochemický vztah mezi enolátovým kyslíkem nesoucím pozitivní protiiont a skupinou s nejvyšší prioritou na alfa uhlíku. Ve skutečnosti model Zimmerman – Traxler spolehlivě dodržují pouze některé kovy, jako je lithium. V některých případech tedy stereochemický výsledek reakce může být nepředvídatelný.

Kontrola zkříženého aldolu
Problém "kontroly" v přidání aldolu je nejlépe demonstrován na příkladu. Zvažte výsledek této hypotetické reakce:

V této reakci se kondenzují dva nesymetrické ketony ethoxid sodný. Zásaditost ethoxidu sodného je taková, že nemůže plně deprotonovat ani jeden z ketonů, ale může produkovat malá množství enolátu sodného obou ketonů. To znamená, že kromě toho, že jsou potenciálními aldolovými elektrofily, mohou oba ketony také působit jako nukleofily prostřednictvím svého enolátu sodného. Dva elektrofily a dva nukleofily tedy mají potenciál vést ke čtyřem možným produktům:

Pokud si tedy přejeme získat pouze jeden z křížových produktů, je třeba řídit, který karbonyl se stane nukleofilním enolem / enolátem a který zůstane ve své elektrofilní karbonylové formě.
Kyselost
Nejjednodušší kontrola je, pokud pouze jeden z reaktantů má kyselé protony a pouze tato molekula tvoří enolát. Například přidání diethyl malonát do benzaldehyd by produkoval pouze jeden produkt. Pouze malonát má α vodíky, takže je nukleofilním partnerem, zatímco neenolizovatelný benzaldehyd může být pouze elektrofil:

Malonát je obzvláště snadno deprotonován, protože poloha a je ohraničena více než jedním karbonylem. Díky dvojité aktivaci je enolát stabilnější, takže k jeho vytvoření není zapotřebí tak silná základna. Rozšíření tohoto účinku může umožnit kontrolu nad tím, který ze dvou karbonylových reaktantů se stane enolátem, i když oba mají α vodíky. Pokud je jeden partner podstatně kyselější než druhý, nejkyselejší proton se oddělí bází a na tomto karbonylu se vytvoří enolát, zatímco méně kyselý karbonyl není bází ovlivněn. Tento typ kontroly funguje, pouze pokud je rozdíl v kyselosti dostatečně velký a pro reakci se nepoužívá přebytek báze. Typickým substrátem pro tuto situaci je situace, kdy je deprotonovatelná poloha aktivována více než jednou karbonylovou skupinou. Mezi běžné příklady patří CH2 skupina ohraničená dvěma karbonyly nebo nitrily (viz např Knoevenagelova kondenzace a první kroky Malonicesterová syntéza ).
Pořadí přidání
Jedním běžným řešením je nejprve vytvořit enolát jednoho partnera a poté přidat druhého partnera pod kinetické ovládání.[19] Kinetická kontrola znamená, že dopředná adiční reakce s aldolem musí být výrazně rychlejší než reverzní retro-aldolová reakce. Aby byl tento přístup úspěšný, musí být splněny i další dvě podmínky; musí být možné kvantitativně vytvořit enolát jednoho partnera a přímá aldolová reakce musí být výrazně rychlejší než přenos enolátu z jednoho partnera na druhého. Běžné podmínky kinetické kontroly zahrnují tvorbu enolátu ketonu s LDA při -78 ° C, následované pomalým přidáváním aldehydu.
Enoláty
Formace
Enolát může být vytvořen použitím silné báze ("tvrdé podmínky") nebo použitím a Lewisova kyselina a slabá základna („měkké podmínky“):

V tomto diagramu představuje B: bázi, která bere proton. The dibutylboron triflát ve skutečnosti se připojí k kyslíku pouze během reakce. Druhý produkt vpravo (vytvořený z N, N-diisopropylethylamin ) mělo by i-Pr2EtNH+ OTf −.
Pro deprotonace nastane, stereoelektronický požadavek je, že alfa-C-H sigma vazba musí být schopen překrývat se s oběžnou dráhou pi * karbonyl:
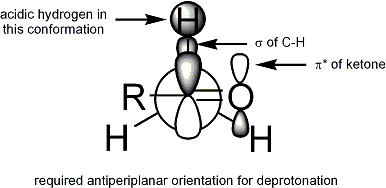
Geometrie
Byly provedeny rozsáhlé studie o tvorbě enolátů za mnoha různých podmínek. Nyní je možné vygenerovat ve většině případů požadovanou enolátovou geometrii:[20]

U ketonů dává většina podmínek enolizace Z enoláty. Pro estery, dává většina podmínek enolizace E enoláty. Přidání HMPA je známo, že zvrátit stereoselektivita deprotonace.

Stereoselektivní tvorba enolátů byla racionalizována pomocí Irský model,[21][22][23][24] i když jeho platnost je poněkud sporná. Ve většině případů není známo, jaké jsou meziprodukty, pokud existují monomerní nebo oligomerní v přírodě; Irský model nicméně zůstává užitečným nástrojem pro porozumění enolátům.
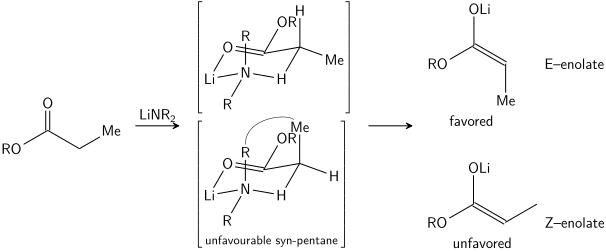
V irském modelu se předpokládá, že deprotonace probíhá šestičlennou nebo cyklickou[25] monomerní přechodový stav. Čím větší ze dvou substituentů na elektrofilu (ve výše uvedeném případě je methyl větší než proton) zaujímá ve výhodném přechodovém stavu ekvatoriální dispozici, což vede k preferenci E enolátů. Model v mnoha případech zjevně selhává; například pokud je směs rozpouštědel změněna z THF na 23% HMPA-THF (jak je vidět výše), je obrácená geometrie enolátu, což je v rozporu s tímto modelem a jeho cyklickým přechodovým stavem.
Regiochemie
Pokud je nesymetrický keton vystaven bázi, má potenciál tvořit dva regioizomerní enoláty (ignoruje geometrii enolátu). Například:

Trisubstituovaný enolát je považován za kinetický enolát, zatímco tetrasubstituovaný enolát je považován za termodynamický enolát. Alfa vodík deprotonovaný za vzniku kinetického enolátu je méně bráněn, a proto se deprotonuje rychleji. Obecně jsou tetrasubstituované olefiny stabilnější než trisubstituované olefiny díky hyperkonjugativní stabilizaci. Poměr enolátových regioizomerů je silně ovlivněn volbou báze. U výše uvedeného příkladu lze kinetickou kontrolu stanovit pomocí LDA při -78 ° C, což dává 99: 1 selektivitu kinetiky: termodynamický enolát, zatímco termodynamickou kontrolu lze stanovit pomocí trifenylmethyllithium v pokojová teplota, což dává selektivitu 10:90.
Obecně jsou kinetické enoláty upřednostňovány nízkými teplotami, podmínkami, které vytvářejí relativně iontové vazby kov-kyslík, a rychlou deprotonací za použití mírného přebytku silné, stericky bráněné báze. Velká báze pouze deprotonuje dostupnější vodík a nízké teploty a přebytek báze pomáhají vyhnout se rovnováze se stabilnějším alternativním enolátem po počáteční tvorbě enolátu. Termodynamické enoláty jsou upřednostňovány delšími ekvilibračními časy při vyšších teplotách, podmínkami, které poskytují relativně kovalentní vazbu kov-kyslík, a použitím mírného substechiometrického množství silné báze. Použitím nedostatečné báze k deprotonaci všech karbonylových molekul si enoláty a karbonyly mohou navzájem vyměňovat protony a ekvilibrovat se na jejich stabilnější izomer. Použití různých kovů a rozpouštědel může poskytnout kontrolu nad množstvím iontového charakteru ve vazbě kov-kyslík.
Stereoselektivita
Aldolová reakce je zvláště užitečná, protože v jedné reakci jsou generována dvě nová stereogenní centra. Byl proveden rozsáhlý výzkum s cílem porozumět mechanismu reakce a zlepšit selektivitu pozorovanou za mnoha různých podmínek. The syn/proti Konvence se běžně používá k označení relativní stereochemie na a- a p-uhlíku.
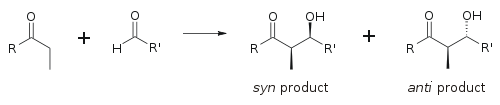
Konvence platí, když se do aldehydů přidávají propionátové (nebo vyššího řádu) nukleofily. The R skupina ketonu a R ' skupina aldehydu jsou zarovnány v „cik cak“ vzoru v rovině papíru (nebo síta) a je považována dispozice vytvořených stereocentrů syn nebo proti, v závislosti na tom, zda jsou na stejné nebo opačné straně hlavního řetězce.
Starší papíry používají erythro / threo nomenklatura známá z chemie sacharidů.
Enolate geometrie
Mezi úrovní není žádný významný rozdíl stereoindukce pozorováno u E a Z enoláty. Každá alkenová geometrie vede primárně k jedné specifické relativní stereochemii v produktu, E dávat proti a Z dávat syn:[20]


Ion kovu
Kationt enolátu kovu může hrát velkou roli při určování úrovně stereoselektivity v aldolové reakci. Bor se často používá[26][27] protože to je délky vazby jsou podstatně kratší než u kovů jako lithium, hliník nebo hořčík.

Například vazby bor-uhlík a bor-kyslík jsou 1,4–1,5 A a 1,5–1,6 Å na délku, zatímco typické vazby kov-uhlík a kov-kyslík mají délku 1,9–2,2 Å a 2,0–2,2 Å na délku. Použití boru spíše než kovu "utahuje" přechodový stav a dává větší stereoselektivitu v reakci.[28] Výše uvedená reakce tedy dává a syn: anti poměr 80:20 s použitím lithium enolátu ve srovnání s 97: 3 s použitím bibutylboron enolátu.
Alfa stereocentrum na enolátu
Aldolová reakce může vykazovat „stereocontrol na bázi substrátu“, ve kterém existuje chirality na kterémkoli z reaktantů ovlivňuje stereochemický výsledek reakce. To bylo rozsáhle studováno a v mnoha případech lze předvídat smysl asymetrická indukce, pokud ne absolutní úroveň diastereoselektivita. Pokud enolát obsahuje a stereocentrum v poloze alfa lze realizovat vynikající stereokontrolu.
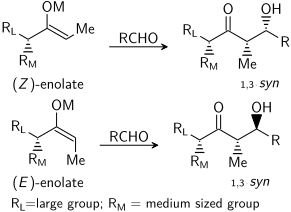
V případě E enolátu je dominantním ovládacím prvkem allylický 1,3-kmen zatímco v případě Z enolátu je dominantním kontrolním prvkem vyloučení 1,3-diaxiálních interakcí. Obecný model je uveden níže:

Pro přehlednost bylo stereocentrum na enolátu epimerizováno; ve skutečnosti by byl napaden opačný diastereoface aldehydu. V obou případech je výhodný 1,3-syn diastereomer. Existuje mnoho příkladů tohoto typu stereokontroly:[29]

Alfa stereocentrum na elektrofilu
Když enoláty napadají aldehydy pomocí alfa stereocentra, je také možná vynikající stereokontrola. Obecné pozorování je takové E enoláty exponát Felkin výběr diastereoface, zatímco Z enoláty vykazují anti-Felkinovu selektivitu. Obecný model[30][31] je uveden níže:

Od té doby Z enoláty musí reagovat prostřednictvím a přechodový stav který obsahuje buď destabilizující syn-pentanovou interakci, nebo anti-Felkin rotamer, Z-enoláty v tomto případě vykazují nižší hladiny diastereoselektivity. Některé příklady jsou uvedeny níže:[32][33]

Jednotný model stereoindukce
Pokud enolát i aldehyd obsahují již existující chiralitu, pak lze výsledek „dvojité stereodiferenciační“ aldolové reakce předpovědět pomocí sloučeného stereochemického modelu, který zohledňuje enolátové zkreslení obličeje, geometrii enolátu a zkreslení aldehydu na obličeji.[34] Níže uvádíme několik příkladů použití tohoto modelu:[33]

Evansova chemie oxazolidinonu
Moderní organické syntézy nyní vyžadují syntézu sloučenin v enantiopure formulář. Jelikož adiční reakce s aldolem vytváří dvě nová stereocentra, mohou vzniknout až čtyři stereoizomery.
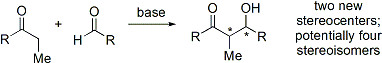
Mnoho metod, které řídí jak relativní stereochemii (tj. Syn nebo anti, jak je uvedeno výše), tak absolutní stereochemie (tj., R nebo S) byly vyvinuty.
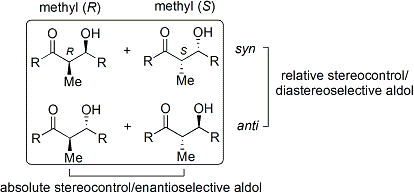
Široce používanou metodou je Evansova acyl oxazolidinon metoda.[35][36] Vyvinut na konci 70. a 80. let 20. století David A. Evans a spolupracovníci, metoda funguje tak, že dočasně vytvoří chirální enolát připojením a chirální pomocný. Pre-existující chiralita z pomocné látky se poté převede na aldolový adukt provedením diastereoselektivní aldolové reakce. Po následném odstranění pomocné látky se odhalí požadovaný aldolový stereoizomer.
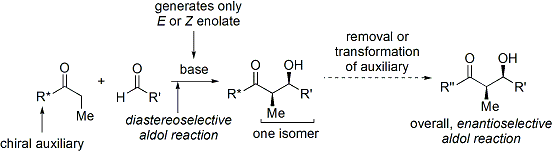
V případě Evansovy metody je připojenou chirální pomocnou látkou oxazolidinon a výsledná karbonylová sloučenina je imide. Řada oxazolidinonů je nyní snadno dostupná v obou enantiomerních formách. Ty mohou stát zhruba 10–20 $ amerických dolarů za gram, což je činí relativně nákladnými. Enantiočisté oxazolidinony jsou však odvozeny ve 2 syntetických krocích z poměrně levných aminokyselin, což znamená, že syntézy ve velkém měřítku mohou být díky vlastní výrobě ekonomičtější. To obvykle zahrnuje redukci kyseliny zprostředkovanou borohydridem skupina s následnou kondenzací / cyklizací výsledného aminoalkoholu s jednoduchým karbonátovým esterem, jako je diethylkarbonát.

The acylace oxazolidinonu je vhodný postup a je neformálně označován jako „zavádění provedeno“. Z-enoláty, které vedou k syn-aldolovým aduktům, lze spolehlivě vytvořit pomocí měkké enolizace zprostředkované bórem:[37]

Často jediný diastereomer lze získat jedním krystalizace aldolového aduktu. Antialdolové adukty však nelze spolehlivě získat Evansovou metodou. I přes náklady a omezení dát jen syn adukty, vynikající spolehlivost metody, snadné použití a všestrannost ji činí metodou volby v mnoha situacích. K odštěpení pomocné látky je k dispozici mnoho metod:[38]

Po konstrukci imidu mohou být provedeny jak syn-, tak anti-selektivní adiční reakce s aldoly, což umožňuje sestavení tří ze čtyř možných stereoarray: syn selective:[39] a anti selektivní:[40]

V syn-selektivních reakcích obě enolizační metody dávají Z enolát, jak se očekávalo; stereochemický výsledek reakce je však řízen spíše methylovým stereocentrem než chiralitou oxazolidinonu.[Citace je zapotřebí ] Popsané metody umožňují stereoselektivní sestavení polyketidy, třída přírodních produktů, které často obsahují aldol retron.
Intramolekulární reakce

Intramolekulární aldolová reakce je kondenzační reakce dvou aldehyd skupiny nebo keton skupiny ve stejné molekule. Pětičlenné nebo šestičlenné α, βjako produkty se tvoří nenasycený keton nebo aldehydy. Tato reakce je důležitým přístupem k tvorbě vazeb uhlík-uhlík v organických molekulách obsahujících kruhové systémy. Například za silných základních podmínek (např. hydroxid sodný ), hexan-2,5-dion (sloučenina A na obrázku 1) může cyklizovat intramolekulární aldolovou reakcí za vzniku 3-methylcyklopent-2-en-1-onu (sloučenina B).
Mechanismus intramolekulární aldolové reakce zahrnuje vytvoření klíče izolovat meziprodukt následovaný intramolekulárními nukleofilní adice proces. Nejprve hydroxid abstrahuje α-vodík na koncovém uhlíku za vzniku enolátu. Dále, a nukleofilní útok enolátu na druhé keto skupině tvoří novou vazbu uhlík-uhlík (červená) mezi uhlíky 2 a 6. Nakonec, obvykle za zahřívání, eliminace molekuly vody poskytne cyklizovaný α, β-nenasycený keton.

Intramolekulární aldolové reakce byly široce používány při celkové syntéze různých přírodních produktů, zejména alkaloidy a steroidy. Příkladem je aplikace intramolekulární aldolové reakce v kroku uzavření kruhu pro úplnou syntézu (+) -Wortmannin Shigehisa a kol.[41] (Obrázek 2).
Moderní variace a metody
Nedávno[když? ] metodologie nyní umožňuje provádět mnohem širší škálu aldolových reakcí, často s katalytickým množstvím chirální ligand. Když reakce používají malé množství enantiomerně čistých ligandů k vyvolání tvorby enantiomerně čistých produktů, reakce se obvykle nazývají „katalytické, asymetrické“; například mnoho různých katalytických, asymetrický Aldolové reakce jsou nyní k dispozici.
Acetátové aldolové reakce
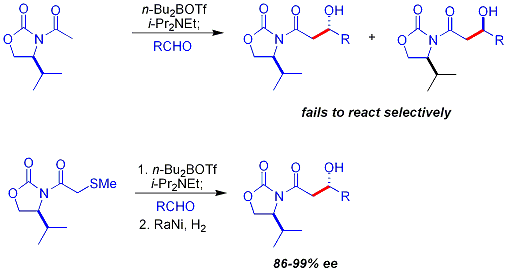
Klíčovým omezením výše popsaného chirálního pomocného přístupu je selhání N-acetylu imides reagovat selektivně. Prvním přístupem bylo použití dočasného thioether skupina:[38][42]
Mukaiyama aldolová reakce
The Mukaiyama aldolová reakce[43] je nukleofilní adice z silyl enol ethery na aldehydy katalyzované a Lewisova kyselina jako fluorid boritý (tak jako etherát fluoridu boritého ) nebo chlorid titaničitý.[44][45] Mukaiyamova aldolová reakce se neřídí modelem Zimmerman-Traxler. Carreira popsala obzvláště užitečnou asymetrickou metodiku se silylketenacetaly, která je pozoruhodná vysokou úrovní enantioselektivity a širokým rozsahem substrátu.[46]
Metoda funguje nerozvětvený alifatické aldehydy, které jsou často chudé elektrofily pro katalytické, asymetrické procesy. To může být způsobeno špatnou elektronickou a sterickou diferenciací mezi nimi enantiofaces.

Analogické vinylogický Proces Mukaiyama aldol lze také učinit katalytickým a asymetrickým. Níže uvedený příklad funguje efektivně pro aromatické (ale ne alifatické) aldehydy a předpokládá se, že mechanismus zahrnuje chirální, na kov vázaný dienolát.[47][48]

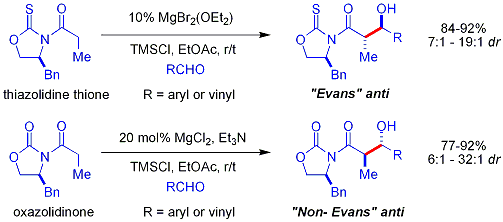
Crimmins thiazolidinethion aldol
Novější[když? ] verze Evansova pomocného zařízení je Crimmins thiazolidinethion.[49][50]The výnosy, diastereoselektivity a enantioselektivity reakce jsou obecně vysoké, i když ne tak vysoké jako ve srovnatelných Evansových případech. Na rozdíl od pomocné látky Evans však thiazoldinethion může provádět acetátové aldolové reakce (viz Crimmins, Org. Lett. 2007, 9 (1), 149–152.) A může produkovat „Evans syn“ nebo „non-Evans syn“ adukty jednoduše změnou množství (-) - spartein. Předpokládá se, že reakce probíhá šestičlennou vazbou na titan přechodové stavy, analogický s navrhovanými přechodovými stavy pro Evansovu pomocnou látku. POZNÁMKA: Ve struktuře sparteinu zobrazené níže chybí atom dusíku.

Organokatalýza
Novější[když? ] vývoj je použití chirálního sekundárního amin katalyzátory. Tyto sekundární aminy se tvoří přechodně enaminy při působení ketonů, které mohou reagovat enantioselektivně[51] s vhodnými aldehydovými elektrofily. Amin reaguje s karbonylem za vzniku enaminu, enamin působí jako enol-podobný nukleofil a poté se z produktu uvolní amin - samotný amin je katalyzátor. Tato metoda enaminové katalýzy je typem organokatalýza, protože katalyzátor je zcela založen na malé organické molekule. V klíčovém příkladu prolin účinně katalyzoval cyklizaci triketonu:
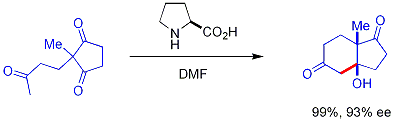
Tato reakce je známá jako Hajos-Parrishova reakce[52][53] (také známá jako reakce Hajos-Parrish-Eder-Sauer-Wiechert s odkazem na současnou zprávu Scheringa o reakci za drsnějších podmínek).[54] Za podmínek Hajos-Parrish je nutné pouze katalytické množství prolin (3 mol%). Neexistuje žádné nebezpečí achirální reakce na pozadí, protože přechodné enaminové meziprodukty jsou mnohem nukleofilnější než jejich mateřské ketonové enoly. Tato strategie nabízí jednoduchý způsob generování enantioselektivity v reakcích bez použití přechodných kovů, jejichž nevýhody jsou toxické nebo drahé.
Prolinem katalyzované aldolové reakce nevykazují žádné nelineární účinky (enantioselektivita produktů je přímo úměrná enantiočistotě katalyzátoru). Zkombinováno s izotopové značení důkazy a výpočetní studie, navrhovaný mechanismus reakce pro prolinem katalyzované aldolové reakce je následující:[55]

Tato strategie umožňuje jinak náročnou zkříženou aldolovou reakci mezi dvěma aldehydy. Obecně jsou křížové aldolové reakce mezi aldehydy obvykle náročné, protože mohou polymerovat snadno nebo neselektivně reagovat na statistickou směs produktů. První příklad je uveden níže:[56]
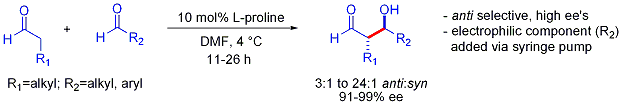
Na rozdíl od preference pro synadukty, které se typicky pozorují při přidání aldolových derivátů na bázi enolátu, jsou tyto organokatalyzované přídavky aldolové anteselektivní. V mnoha případech jsou organokatalytické podmínky dostatečně mírné, aby se zabránilo polymeraci. Selektivita však vyžaduje pomalé přidávání požadovaného elektrofilního partnera řízené pomalou injekční pumpou, protože oba reagující partneři mají obvykle enolizovatelné protony. Pokud jeden aldehyd nemá žádné enolizovatelné protony nebo alfa- nebo beta-větvení, lze dosáhnout další kontroly.
Elegantní demonstraci síly asymetrických organokatalytických aldolových reakcí popsali MacMillan a spolupracovníci v roce 2004 při syntéze rozdílně chráněných sacharidy. Zatímco tradiční syntetické metody provádějí syntézu hexózy pomocí variant iterativního ochranná deprotekce Strategie vyžadující 8–14 kroků, mohou organokatalýza získat přístup k mnoha stejným substrátům pomocí účinného dvoustupňového protokolu zahrnujícího prolinem katalyzovanou dimerizaci alfa-oxyaldehydů s následnou tandemovou cyklizací alkaly Mukaiyama.

Aldolová dimerizace alfa-oxyaldehydů vyžaduje, aby aldolový adukt, sám o sobě aldehyd, byl inertní vůči dalším aldolovým reakcím.[57]Dřívější studie odhalily, že aldehydy nesoucí alfa-alkyloxy nebo alfa-silyloxy substituenty byly vhodné pro tuto reakci, zatímco aldehydy nesly Skupiny odebírající elektrony jako acetoxy byli nereaktivní. Chráněné erytroza Produkt by pak mohl být přeměněn na čtyři možné cukry přidáním Mukaiyama aldolu následovaným laktol formace. To vyžaduje odpovídající diastereokontrolu v přidání Mukaiyama aldolu a produktu silyloxykarbeniový ion přednostně cyklizovat, spíše než podstoupit další aldolovou reakci. Na konci, glukóza, manóza, a přidělit byly syntetizovány:

„Přímé“ přidání aldolu
Při obvyklém přidání aldolu se karbonylová sloučenina deprotonuje za vzniku enolátu. Enolát se přidá k aldehydu nebo ketonu, který vytvoří alkoxid, který se potom při zpracování protonuje. Nadřazená metoda by v zásadě zabránila požadavku na vícestupňovou sekvenci ve prospěch „přímé“ reakce, která by mohla být provedena v jediném kroku procesu. Jedním z nápadů je generovat enolát pomocí kovu katalyzátor který se uvolňuje po mechanismu přidání aldolu. Obecným problémem je, že při přidání vznikne alkoxid, který je mnohem bazičtější než výchozí materiály. Tento produkt se pevně váže na kov a brání mu v reakci s dalšími karbonylovými reaktanty.
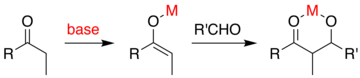
Jedním z přístupů, který prokázal Evans, je silylace aldolového aduktu.[58][59] Křemíkové činidlo, jako je TMSCI se přidá do reakce, která nahradí kov na alkoxidu, což umožní obrat kovového katalyzátoru. Minimalizace počtu reakčních kroků a množství použitých reaktivních chemikálií vede k nákladově efektivní a průmyslově užitečné reakci.
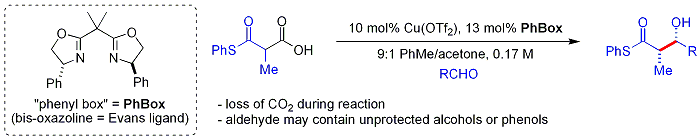
Novější[když? ] biomimetický přístup od Shaira používá beta-thioketokyseliny jako nukleofil.[60] Ketokyselina skupina je dekarboxylovaný in situ. Proces je podobný malonyl-CoA je používán Polyketidové syntázy. The chirální ligand je případ je bisoxazolin. Aromatické a rozvětvené alifatické aldehydy jsou obvykle špatnými substráty.
Biologické aldolové reakce
Příklady aldolových reakcí v biochemii zahrnují štěpení fruktóza-1,6-bisfosfát do dihydroxyaceton a glyceraldehyd-3-fosfát ve čtvrté fázi glykolýza, což je příklad reverzní („retro“) aldolové reakce katalyzované enzymem aldoláza A (také známý jako fruktóza-1,6-bisfosfát aldoláza).
V glyoxylátový cyklus rostlin a některých prokaryot, isocitrát lyáza vyrábí glyoxylát a sukcinát z isocitrát. Po deprotonaci OH skupiny isocitrát lyáza štěpí isocitrát na sukcinát se čtyřmi uhlíky a glykoláty se dvěma uhlíky štěpením aldolové reakce. Toto štěpení je mechanicky velmi podobné reakci glykolýzy s aldolázou A.
Viz také
Reference
- ^ Wade, L. G. (2005). Organická chemie (6. vydání). Upper Saddle River, New Jersey: Prentice Hall. str. 1056–66. ISBN 978-0-13-236731-8.
- ^ Smith, M. B .; March, J. (2001). Pokročilá organická chemie (5. vydání). New York: Wiley Interscience. s. 1218–23. ISBN 978-0-471-58589-3.
- ^ Mahrwald, R. (2004). Moderní Aldol reakce, svazky 1 a 2. Weinheim, Německo: Wiley-VCH Verlag GmbH & Co. KGaA. str.1218–23. ISBN 978-3-527-30714-2.
- ^ Vidět:
- Borodin informoval o kondenzaci pentanal (Valerianaldehyd) s heptanal (Oenanthaldehyd) v: von Richter, V. (1869) „V. von Richter, aus St. Petersburg am 17. October 1869“ (V. von Richter [hlášení] z Petrohradu dne 17. října 1869), Berichte der deutschen chemischen Gesellschaft (v němčině), 2 : 552-553.
- Anglická verze Richterovy zprávy: (Staff) (10. prosince 1869) „Chemická oznámení ze zahraničních zdrojů: Berichte der Deutschen Chemischen Gesellschaft zu Berlin, č. 16, 1869: Valerian aldehyd a Oenanth aldehyd - M. Borodin,“ The Chemical News and Journal of Industrial Science, 20 : 286.
- Garner, Susan Amy (2007) „Vodíkem zprostředkované formace vazby uhlík-uhlík: Aplikováno na reduktivní aldolové a Mannichovy reakce,“ Ph.D. disertační práce, University of Texas (Austin), 4 a 51.
- Borodin, A. (1873) „Ueber einen neuen Abkömmling des Valerals“ (Na novém derivátu valeriánského aldehydu), Berichte der deutschen chemischen Gesellschaft (v němčině), 6 : 982–985.
- ^ Wurtz, C. A. (1872). „Sur un aldéhyde-alcool“ [Na aldehydovém alkoholu]. Bulletin de la Société Chimique de Paris. 2. série (ve francouzštině). 17: 436–442.
- ^ Wurtz, C. A. (1872). „Ueber einen Aldehyd-Alkohol“ [O aldehydovém alkoholu]. Journal für Praktische Chemie (v němčině). 5 (1): 457–464. doi:10.1002 / prac.18720050148.
- ^ Wurtz, C. A. (1872). „Sur un aldéhyde-alcool“ [Na aldehydovém alkoholu]. Comptes rendus de l'Académie des sciences (francouzsky). 74: 1361.
- ^ Heathcock, C. H. (1991). „Aldolová reakce: Kyselina a obecná bazická katalýza“. v Trost, B. M.; Fleming, I. (eds.). Komplexní organická syntéza. 2. Elsevierova věda. 133–179. doi:10.1016 / B978-0-08-052349-1.00027-5. ISBN 978-0-08-052349-1.
- ^ Mukaiyama T. (1982). Řízená aldolová reakce. Org. Reagovat. 28. 203–331. doi:10.1002 / 0471264180.nebo028.03. ISBN 978-0471264187.
- ^ Paterson, I. (1988). "Nová asymetrická aldolová metodologie používající bór-enoláty". Chem. Ind. 12: 390–394.
- ^ Mestres R. (2004). „Zelený pohled na aldolovou reakci“. Zelená chemie. 6 (12): 583–603. doi:10.1039 / b409143b.
- ^ M. Braun; R. Devant (1984). „(R) a (S) -2-acetoxy-1,1,2-trifenylethanolu - účinné syntetické ekvivalenty chirálního acetátového enolátu“. Čtyřstěn dopisy. 25 (44): 5031–4. doi:10.1016 / S0040-4039 (01) 91110-4.
- ^ Jie Jack Li; et al. (2004). Současná syntéza léčiv. Wiley-Interscience. str. 118–. ISBN 978-0-471-21480-9.
- ^ Wulff W. D .; Andersson B. A (1994). „Stereoselektivní adiční reakce aldolu komplexů Fischerova karbenu prostřednictvím elektronického ladění kovového centra pro enolátovou reaktivitu“. Anorganica Chimica Acta. 220 (1–2): 215–231. doi:10.1016/0020-1693(94)03874-0.
- ^ Schetter, B .; Mahrwald, R. (2006). „Moderní aldolové metody pro úplnou syntézu polyketidů“. Angew. Chem. Int. Vyd. 45 (45): 7506–7525. doi:10.1002 / anie.200602780. PMID 17103481.
- ^ Guthrie, J.P .; Cooper, K.J .; Cossar, J .; Dawson, B. A.; Taylor, K.F. (1984). „Retroaldolová reakce cinnamaldehydu“. Umět. J. Chem. 62 (8): 1441–1445. doi:10.1139 / v84-243.
- ^ Zimmerman, H. E.; Traxler, M. D. (1957). „Stereochemie Ivanovových a Reformatských reakcí. Já.“ Journal of the American Chemical Society. 79 (8): 1920–1923. doi:10.1021 / ja01565a041.
- ^ Heathcock, C. H.; Buse, C. T .; Kleschnick, W. A .; Pirrung, M. C .; Sohn, J. E .; Lampe, J. (1980). "Acyklická stereoselekce. 7. Stereoselektivní syntéza 2-alkyl-3-hydroxykarbonylových sloučenin aldolovou kondenzací". Journal of Organic Chemistry. 45 (6): 1066–1081. doi:10.1021 / jo01294a030.
- ^ Bal, B .; Buse, C. T .; Smith, K .; Heathcock, C. H., Kyselina (2SR, 3RS) -2,4-dimethyl-3-hydroxypentanová Archivováno 06.06.2011 na Wayback Machine, Org. Synth., Sb. Sv. 7, str. 185 (1990); Sv. 63, str. 89 (1985).
- ^ A b Brown, H. C.; Dhar, R. K.; Bakshi, R. K.; Pandiarajan, P. K .; Singaram, B. (1989). "Hlavní účinek odstupující skupiny v dialkylboronchloridech a triflátech při řízení stereospecifické přeměny ketonů buď na E- nebo Z-enolboráty". Journal of the American Chemical Society. 111 (9): 3441–3442. doi:10.1021 / ja00191a058.
- ^ Irsko, R. E .; Willard, A. K. (1975). "Stereoselektivní generace esterových enolátů". Čtyřstěn dopisy. 16 (46): 3975–3978. doi:10.1016 / S0040-4039 (00) 91213-9.
- ^ Narula, A. S. (1981). „Analýza interakcí diastereomerního přechodového stavu pro kinetickou deprotonaci acyklických karbonylových derivátů lithiumdiisopropylamidem“. Čtyřstěn dopisy. 22 (41): 4119–4122. doi:10.1016 / S0040-4039 (01) 82081-5.
- ^ Irsko, RE; Wipf, P; Armstrong, JD (1991). „Stereochemická kontrola v Claenově přesmyku ester-enolátu. 1. Stereoselektivita při tvorbě silylketen-acetalu“. Journal of Organic Chemistry. 56 (2): 650–657. doi:10.1021 / jo00002a030.
- ^ Xie, L; Isenberger, KM; Drženo, G; Dahl, LM (říjen 1997). „Vysoce stereoselektivní kinetická enolátová formace: sterické vs. elektronické efekty“. Journal of Organic Chemistry. 62 (21): 7516–7519. doi:10.1021 / jo971260a. PMID 11671880.
- ^ Řízená syntéza aldolu - tvorba E-enolátu a Z-enolátu
- ^ Cowden, C. J .; Paterson, I. Org. Reagovat. 1997, 51, 1.
- ^ Cowden, C. J .; Paterson, I. (2004). Asymetrické aldolové reakce s použitím boritanových esterů. Organické reakce. s. 1–200. doi:10.1002 / 0471264180.nebo051.01. ISBN 978-0471264187.
- ^ Evans, D. A.; Nelson J. V.; Vogel E.; Taber T. R. (1981). "Stereoselective aldol condensations via boron enolates". Journal of the American Chemical Society. 103 (11): 3099–3111. doi:10.1021/ja00401a031.
- ^ Evans, D. A.; Rieger D. L.; Bilodeau M. T.; Urpi F. (1991). "Stereoselective aldol reactions of chlorotitanium enolates. An efficient method for the assemblage of polypropionate-related synthons". Journal of the American Chemical Society. 113 (3): 1047–1049. doi:10.1021/ja00003a051.
- ^ Evans D. A. et al. Horní. Stereochem. 1982, 13, 1–115. (Posouzení)
- ^ Roush W. R. (1991). "Concerning the diastereofacial selectivity of the aldol reactions of .alpha.-methyl chiral aldehydes and lithium and boron propionate enolates". Journal of Organic Chemistry. 56 (13): 4151–4157. doi:10.1021/jo00013a015.
- ^ Masamune S.; Ellingboe J. W.; Choy W. (1982). "Aldol strategy: coordination of the lithium cation with an alkoxy substituent". Journal of the American Chemical Society. 104 (20): 1047–1049. doi:10.1021/ja00384a062.
- ^ A b Evans, D. A.; Dart M. J.; Duffy J. L.; Rieger D. L. (1995). "Double Stereodifferentiating Aldol Reactions. The Documentation of "Partially Matched" Aldol Bond Constructions in the Assemblage of Polypropionate Systems". Journal of the American Chemical Society. 117 (35): 9073–9074. doi:10.1021/ja00140a027.
- ^ Masamune S.; Choy W.; Petersen J. S.; Sita L. R. (1985). "Double Asymmetric Synthesis and a New Strategy for Stereochemical Control in Organic Synthesis". Angew. Chem. Int. Vyd. Angl. 24: 1–30. doi:10.1002/anie.198500013.
- ^ Evans D. A. Aldrichimica Acta 1982, 15, 23. (Review)
- ^ Gage J. R.; Evans D. A., Diastereoselective Aldol Condensation Using A Chiral Oxazolidinone Auxiliary: (2S*,3S*)-3-Hydroxy-3-Phenyl-2-Methylpropanoic Acid Archivováno 29. 09. 2012 na Wayback Machine, Organické syntézy, Sb. Sv. 8, p.339 (1993); Sv. 68, p.83 (1990).
- ^ Evans, D. A.; Bartroli J.; Shih T. L. (1981). "Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates". Journal of the American Chemical Society. 103 (8): 2127–2129. doi:10.1021/ja00398a058.
- ^ A b Evans, D. A.; Bender S. L.; Morris J. (1988). "The total synthesis of the polyether antibiotic X-206". Journal of the American Chemical Society. 110 (8): 2506–2526. doi:10.1021/ja00216a026.
- ^ Evans, D. A.; Clark J.S.; Metternich R.; Sheppard G.S. (1990). "Diastereoselective aldol reactions using .beta.-keto imide derived enolates. A versatile approach to the assemblage of polypropionate systems". Journal of the American Chemical Society. 112 (2): 866–868. doi:10.1021/ja00158a056.
- ^ Evans, D. A.; Ng, H.P.; Clark, J.S.; Rieger, D.L. (1992). "Diastereoselective anti aldol reactions of chiral ethyl ketones. Enantioselective processes for the synthesis of polypropionate natural products". Čtyřstěn. 48 (11): 2127–2142. doi:10.1016/S0040-4020(01)88879-7.
- ^ Shigehisa, H.; Mizutani, T .; Tosaki, S. Y.; Ohshima, T.; Shibasaki, M, Tetrahedron 2005, 61, 5057-5065.
- ^ In this reaction the nucleophile is a boron enolate derived from reaction with dibutylboron triflate (nBu2BOTf), the base is N, N-diisopropylethylamin. The thioether is removed in step 2 by Raney Nickel / hydrogen snížení
- ^ S. B. Jennifer Kan; Kenneth K.-H. Ng; Ian Paterson (2013). "The Impact of the Mukaiyama Aldol Reaction in Total Synthesis". Angewandte Chemie International Edition. 52 (35): 9097–9108. doi:10.1002/anie.201303914. PMID 23893491.
- ^ Teruaki Mukaiyama; Kazuo Banno; Koichi Narasaka (1974). "Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride". Journal of the American Chemical Society. 96 (24): 7503–7509. doi:10.1021/ja00831a019.
- ^ 3-Hydroxy-3-Methyl-1-Phenyl-1-Butanone by Crossed Aldol Reaction Teruaki Mukaiyama and Koichi Narasaka Organické syntézy, Sb. Sv. 8, p.323 (1993); Sv. 65, p.6 (1987)
- ^ Carreira E.M.; Singer R.A.; Lee W.S. (1994). "Catalytic, enantioselective aldol additions with methyl and ethyl acetate Ó-silyl enolates — a chira; tridentate chelate as a ligand for titanium(IV)" (PDF). Journal of the American Chemical Society. 116 (19): 8837–8. doi:10.1021/ja00098a065.
- ^ Kruger J.; Carreira E.M. (1998). "Apparent catalytic generation of chiral metal enolates: Enantioselective dienolate additions to aldehydes mediated by Tol-BINAP center Cu(II) fluoride complexes". Journal of the American Chemical Society. 120 (4): 837–8. doi:10.1021/ja973331t.
- ^ Pagenkopf B.L.; Kruger J.; Stojanovic A.; Carreira E.M. (1998). "Mechanistic insights into Cu-catalyzed asymmetric aldol reactions: Chemical and spectroscopic evidence for a metalloenolate intermediate". Angew. Chem. Int. Vyd. 37 (22): 3124–6. doi:10.1002/(SICI)1521-3773(19981204)37:22<3124::AID-ANIE3124>3.0.CO;2-1.
- ^ Crimmins M. T.; King B. W.; Tabet A. E. (1997). "Asymmetric Aldol Additions with Titanium Enolates of Acyloxazolidinethiones: Dependence of Selectivity on Amine Base and Lewis Acid Stoichiometry". Journal of the American Chemical Society. 119 (33): 7883–7884. doi:10.1021/ja9716721.
- ^ Crimmins M. T.; Chaudhary K. (2000). "Titanium enolates of thiazolidinethione chiral auxiliaries: Versatile tools for asymmetric aldol additions". Organické dopisy. 2 (6): 775–777. doi:10.1021/ol9913901. PMID 10754681.
- ^ Carreira, E. M.; Fettes, A.; Martl, C. (2006). Catalytic Enantioselective Aldol Addition Reactions. Org. React. 67. pp. 1–216. doi:10.1002/0471264180.or067.01. ISBN 978-0471264187.
- ^ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 1971
- ^ Hajos, Zoltan G.; Parrish, David R. (1974). "Asymmetric synthesis of bicyclic intermediates of natural product chemistry". Journal of Organic Chemistry. 39 (12): 1615–1621. doi:10.1021 / jo00925a003.
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf (1971). "New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures". Angewandte Chemie International Edition v angličtině. 10 (7): 1615–1621. doi:10.1002 / anie.197104961.
- ^ List, Benjamin (2006). "The ying and yang of asymmetric aminocatalysis". Chemická komunikace (8): 819–824. doi:10.1039/b514296m. PMID 16479280.
- ^ Northrup, Alan B.; MacMillan David W. C. (2002). "The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes" (PDF). Journal of the American Chemical Society. 124 (24): 6798–6799. doi:10.1021/ja0262378. PMID 12059180.
- ^ Northrup A. B.; Mangion I. K.; Hettche F.; MacMillan D. W. C. (2004). "Enantioselective Organocatalytic Direct Aldol Reactions of -Oxyaldehydes: Step One in a Two-Step Synthesis of Carbohydrates". Angewandte Chemie International Edition v angličtině. 43 (16): 2152–2154. doi:10.1002/anie.200453716. PMID 15083470.
- ^ Evans, D. A.; Tedrow, J. S.; Shaw, J. T.; Downey, C. W. (2002). "Diastereoselective Magnesium Halide-Catalyzed anti-Aldol Reactions of Chiral N-Acyloxazolidinones". Journal of the American Chemical Society. 124 (3): 392–393. doi:10.1021/ja0119548. PMID 11792206.
- ^ Evans, David A.; Downey, C. Wade; Shaw, Jared T.; Tedrow, Jason S. (2002). "Magnesium Halide-Catalyzed Anti-Aldol Reactions of Chiral N-Acylthiazolidinethiones". Organické dopisy. 4 (7): 1127–1130. doi:10.1021/ol025553o. PMID 11922799.
- ^ Magdziak, D .; Lalic, G.; Lee, H. M .; Fortner, K. C.; Aloise, A. D.; Shair, M. D. (2005). "Catalytic Enantioselective Thioester Aldol Reactions That Are Compatible with Protic Functional Groups". Journal of the American Chemical Society. 127 (20): 7284–7285. doi:10.1021/ja051759j. PMID 15898756.
externí odkazy
- Chem 206, 215 Lecture Notes (2003, 2006) podle D. A. Evans, A. G. Myers, et al., Harvard University (pp. 345, 936)
