Mannichova reakce - Mannich reaction - Wikipedia
| Mannichova reakce | |
|---|---|
| Pojmenoval podle | Carl Mannich |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | mannichova reakce |
| RSC ontologické ID | RXNO: 0000032 |
The Mannichova reakce je organická reakce který se skládá z amino alkylace kyselého protonu umístěného vedle a karbonyl funkční skupina podle formaldehyd a primární nebo sekundární amin nebo amoniak. Konečným produktem je β-aminokarbonylová sloučenina známá také jako a Mannichova základna.[1] Reakce mezi aldiminy a a-methylenkarbonyly jsou také považovány za Mannichovy reakce, protože tyto iminy se tvoří mezi aminy a aldehydy. Reakce je pojmenována po chemik Carl Mannich.[2][3]

Mannichova reakce je příkladem nukleofilní adice aminu na karbonylovou skupinu s následnou dehydratací na Schiffova základna. Základna Schiff je elektrofil který reaguje ve druhém kroku v elektrofilní adice se sloučeninou obsahující kyselý proton (který je nebo se stal enolem). Mannichova reakce je také považována za kondenzační reakce.
V Mannichově reakci primární nebo sekundární aminy nebo amoniak, se používají k aktivaci formaldehydu. Terciárním aminům chybí N – H proton pro vytvoření meziproduktu enamin. α-CH-kyselé sloučeniny (nukleofily ) zahrnují karbonylové sloučeniny, nitrily, acetyleny, alifatické nitrosloučeniny, a-alkyl-pyridiny nebo imines. Je také možné použít aktivovaný fenyl skupiny a heterocykly bohaté na elektrony, jako je furan, pyrrol, a thiofen. Indole je zvláště aktivní substrát; reakce poskytuje gram deriváty.
Při racionalizaci Mannichovy reakce lze jasně chápat, že jde o smíšenýAldolová reakce, dehydratace alkoholu a konjugované přidání aminu (Michaelova reakce ) vše se děje v „jeden hrnec ". Manuální reakce jsou také velmi časté.
Reakční mechanismus
Mechanismus Mannichovy reakce začíná tvorbou iminium iont z aminu a formaldehydu. Níže uvedený mechanismus NENÍ správný. PKa protonizovaného kyslíku je přibližně -2. Aminová báze by jednoduše deprotonovala karbonyl a zastavila reakci. Proto je bezpodmínečně nutné, aby se tato reakce prováděla při pH přibližně 4 až 5. Správný mechanismus by měl začít nukleofilním útokem atomu dusíku na karbonylový uhlík.

Sloučenina s karbonylovou funkční skupinou (v tomto případě a keton ) umět tautomerizovat na enolovou formu, po které může napadnout iminiový iont.


U methylketonů může enolizace a Mannichova adice proběhnout dvakrát, následovaná β-eliminací za vzniku derivátů β-aminoenonu.[4][5]
Asymetrické Mannichovy reakce
Bylo dosaženo pokroku směrem k asymetrický Mannichovy reakce. Při správné funkcionalizaci má nově vytvořený ethylenový můstek v Mannichově aduktu dva prochirál centra vedoucí ke vzniku dvou diastereomerních párů enantiomerů. Byla provedena první asymetrická Mannichova reakce s nemodifikovaným aldehydem (S) -prolin jako přirozeně se vyskytující chirální katalyzátor.[6]
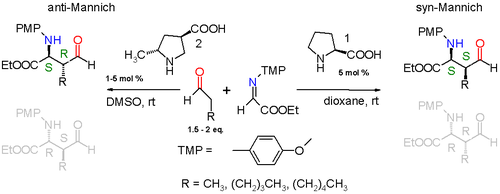
Reakce probíhá mezi jednoduchým aldehydem, jako je např propionaldehyd a já těžím odvozený od ethyl glyoxylát a p-methoxyanilin (PMP = paramethoxyfenyl) katalyzovaný (S) -prolin v dioxan v pokojová teplota. Reakční produkt je diastereoselektivní s výhodou pro syn-Mannichovu reakci 3: 1, když je alkylovým substituentem na aldehydu a methyl skupina nebo 19: 1, když je alkylová skupina mnohem větší pentyl skupina. Ze dvou možných syn adukty (S,S) nebo (R,R) reakce je také enantioselektivní s preferencí pro (S,S) adukt s enantiomerní přebytek větší než 99%. Tato stereoselektivita je vysvětlena v níže uvedeném schématu.

Proline vstupuje do a katalytický cyklus reakcí s aldehydem za vzniku enamin. Dva reaktanty (imin a enamin) se seřadí pro Mannichovu reakci s Si obličej napadení iminu Si-povrchem enamin-aldehydu. Reliéf sterický kmen určuje, že alkylový zbytek R enaminové a iminové skupiny jsou antiperiplanar při přístupu, který se zablokuje v režimu synchronizace přidávání. Enantioselektivitu dále řídí vodíkové vazby mezi prolinem karboxyl skupina a imin. The přechodový stav pro přidání je devítičlenný prsten s konformace židle s částečnými jednoduchými a dvojnými vazbami. Prolinová skupina se převede zpět na aldehyd a jeden (S,S) vzniká izomer.
Modifikací prolinového katalyzátoru je také možné získat anti-Mannichovy adukty.[7]

Další methylová skupina navázaná na prolin nutí specifický enaminový přístup a přechodovým stavem je nyní 10členný kruh s přídavkem v anti-režimu. Diastereoselektivita je alespoň anti: syn 95: 5 bez ohledu na velikost alkylové skupiny a (S,R) enantiomer je preferováno s alespoň 97% enantiomerní přebytek.
Aplikace
Mannichova reakce se používá v mnoha oblastech organické chemie. Příklady zahrnují:
- alkyl aminy
- peptidy, nukleotidy, antibiotika, a alkaloidy (např. tropinon )
- agrochemikálie, jako jsou regulátory růstu rostlin[8]
- polymery
- katalyzátory
- Formaldehyd zesíťování tkáně
- Farmaceutické léky (např. rolitetracyklin (Mannichův produkt tetracyklin a pyrrolidin ), fluoxetin (antidepresivum), tramadol a tolmetin (protizánětlivý lék).
- mýdlo a čisticí prostředky. Tyto sloučeniny se používají v různých čisticích aplikacích, při úpravách pohonných hmot pro automobily a epoxid nátěry
- polyetheraminy ze substituovaného alkylu s rozvětveným řetězcem ethery[9]
- α, β -nenasycené ketony tepelnou degradací produktů Mannichovy reakce (např. methylvinylketon z 1-diethylamino-butan-3-onu)[10][11]
Viz také
Reference
- ^ Originál přeložen z němčiny Wiki
- ^ Carl Mannich; Krösche, W. (1912). „Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin“. Archiv der Pharmazie (v němčině). 250 (1): 647–667. doi:10,1002 / ardp.19122500151. S2CID 94217627.
- ^ Blicke, F. F. (2011). "Mannichova reakce". Organické reakce. 1 (10): 303–341. doi:10.1002 / 0471264180.or001.10. ISBN 978-0471264187.
- ^ Cromwell, Norman H .; Soriano, David S .; Doomes, Earl (listopad 1980). "Mobilní ketoallylové systémy. 18. Syntéza a chemie N-substituovaných a N, N-disubstituovaných 2-benzoyl-1-amino-3-propenů". The Journal of Organic Chemistry. 45 (24): 4983–4985. doi:10.1021 / jo01312a034.
- ^ Girreser, Ulrich; Heber, Dieter; Schütt, Martin (květen 1998). „Facile One-Pot Synthesis of 1-Aryl-2- (dimethylaminomethyl) prop-2-en-1-ones from Aryl Methyl Ketones“. Syntéza. 1998 (5): 715–717. doi:10.1055 / s-1998-2056.
- ^ Córdova, A .; Watanabe, S.-I .; Tanaka, F .; Notz, W .; Barbas, C. F. (2002). „Vysoce enantioselektivní cesta k jakémukoli enantiomeru derivátů α- i β-aminokyselin“. Journal of the American Chemical Society. 124 (9): 1866–1867. doi:10.1021 / ja017833p. PMID 11866595.
- ^ Mitsumori, S .; Zhang, H .; Cheong, P. H.-Y .; Houk, K .; Tanaka, F .; Barbas, C. F. (2006). „Přímé asymetrické reakce proti Mannichovu typu katalyzované navrženou aminokyselinou“. Journal of the American Chemical Society. 128 (4): 1040–1041. doi:10.1021 / ja056984f. PMC 2532695. PMID 16433496.
- ^ da Rosa, F. A. F .; Rebelo, R. A .; Nascimento, M. G. (2003). "Syntéza nových indolkarboxylových kyselin souvisejících s rostlinným hormonem indoleactovou kyselinou" (PDF). Journal of the Brazilian Chemical Society. 14 (1): 11–15. doi:10.1590 / S0103-50532003000100003.
- ^ [1] [2] [3] [4]
- ^ Siegel, H .; Eggersdorfer, M. „Ketony“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a15_077.
- ^ Wilds, A. L .; Nowak, R. M .; McCaleb, K.E. (1957). "1-diethylamino-3-butanon (2-butanon, 4-diethylamino-)". Organické syntézy. 37: 18. doi:10.15227 / orgsyn.037.0018.; Kolektivní objem, 4, str. 281
