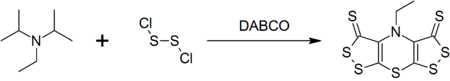N, N-diisopropylethylamin - N,N-Diisopropylethylamine
 | |||
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC N-Ethyl-N- (propan-2-yl) propan-2-amin | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.027.629 | ||
| Číslo ES |
| ||
| Pletivo | N, N-diisopropylethylamin | ||
PubChem CID | |||
| UNII | |||
| UN číslo | 2733 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C8H19N | |||
| Molární hmotnost | 129.247 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | Rybí, čpavkové | ||
| Hustota | 0,742 g ml−1 | ||
| Bod tání | −50 až −46 ° C (−58 až −51 ° F; 223 až 227 K) | ||
| Bod varu | 126,6 ° C; 259,8 ° F; 399,7 tis | ||
| 4,01 g / l (při 20 ° C) | |||
| Tlak páry | 4,1 kPa (při 37,70 ° C) | ||
Index lomu (nD) | 1.414 | ||
| Nebezpečí | |||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H301, H314, H412 | |||
| P210, P273, P280, P301 + 310, P305 + 351 + 338, P310 | |||
| Bod vzplanutí | 10 ° C (50 ° F; 283 K) | ||
| Výbušné limity | 0.7–6.3% | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 200–500 mg kg−1 (orální, krysa) | ||
| Související sloučeniny | |||
Související aminy | |||
Související sloučeniny | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
N,N-Diisopropylethylaminnebo Hünigova základna, je organická sloučenina a amin. Je pojmenována po německém chemikovi Siegfriedovi Hünigovi. Používá se v organická chemie jako základna. To je obyčejně zkrátil jako DIPEA, DIEAnebo i-Pr2Síť.
Struktura
DIPEA se skládá z centrální dusík který je vázán na ethylová skupina a dva isopropyl skupiny. Osamocený pár elektronů spočívá na atomu dusíku, který může reagovat s elektrofily. Jelikož však tyto dvě isopropylové skupiny a ethylová skupina zabírají velkou část prostoru obklopujícího dusík, jsou pouze malé elektrofily jako protony může reagovat s dusíkovým osamělým párem.
Výskyt a příprava
DIPEA je komerčně dostupný. Tradičně jej připravuje alkylace z diisopropylamin s diethylsulfát.[1]
Čistý DIPEA existuje jako bezbarvá kapalina, i když komerční vzorky mohou být slabě žluté. V případě potřeby lze sloučeninu přečistit pomocí destilace z hydroxid draselný[2] nebo hydrid vápenatý.[3]
Použití a reakce
DIPEA je stéricky bráněná organická báze, která se běžně používá jako lapač protonů. Tak, jako 2,2,6,6-tetramethylpiperidin a triethylamin „DIPEA je dobrá základna, ale chudá nukleofil, kombinace vlastností, díky nimž je užitečným organickým činidlem.[4]
Amidová vazba
Běžně se používá jako bráněná báze při amidových vazebných reakcích mezi karboxylovou kyselinou (obvykle aktivovanou například jako chlorid kyseliny, jak je znázorněno níže) a nukleofilním aminem.[5] Protože DIPEA je bráněn a je špatně nukleofilní, nekonkuruje s nukleofilním aminem v kopulační reakci.

Alkylace
DIPEA byl zkoumán z hlediska jeho použití jako selektivního činidla v alkylace z sekundární aminy na terciární aminy podle alkylhalogenidy. Tomu často brání nechtěné Menshutkinova reakce formování a kvartérní amonná sůl, ale chybí, je-li přítomen DIPEA.[6]
Křížové vazebné reakce katalyzované přechodovým kovem
DIPEA lze použít jako základnu v řadě přechodový kov katalyzovaný křížové vazebné reakce, tak jako Sakra spojka a Sonogashira spojka (jak je znázorněno níže).[7]

Swernova oxidace
Ačkoli se jako bráněná báze tradičně používá triethylamin Swernovy oxidace, místo toho lze použít strukturně podobný DIPEA, jak je ilustrováno níže.[8]

Příklady DIPEA použitého jako substrát
DIPEA tvoří komplex heterocyklický sloučenina zvaná skorpionin (bis ([1,2] dithiolo) - [1,4] thiazin) po reakci s chlorid disulfurový který je katalyzován DABCO v syntéza v jedné nádobě.[9]
Srovnání s triethylaminem
DIPEA a triethylamin jsou strukturně velmi podobné, přičemž obě sloučeniny jsou považovány za bráněné organické báze. Díky své strukturální podobnosti jsou DIPEA a triethylamin lze použít zaměnitelně ve většině aplikací. Atom dusíku v DIPEA je více chráněn než atom dusíku v triethylaminu. Triethylamin je však o něco silnější báze než DIPEA; the pKAs příslušného konjugované kyseliny v dimethylsulfoxid jsou 9,0, respektive 8,5.[10]
Reference
- ^ Hünig, S .; Kiessel, M. (1958). „Spezifische Protonenacceptoren als Hilfsbasen bei Alkylierungs- und Dehydrohalogenierungsreaktionen“. Chemische Berichte. 91 (2): 380–392. doi:10,1002 / cber.19580910223.
- ^ Armarego, W. L. F. (2012-10-17). Čištění laboratorních chemikálií. Chai, Christina Li Lin (sedmé vydání). Amsterdam. ISBN 9780123821621. OCLC 820853648.
- ^ Keiper, Sonja; Vyle, Joseph S. (2006-05-12). "Reverzibilní fotokontrola štěpení RNA deoxyribozymem katalyzované RNA za podmínek mnohonásobného obratu". Angewandte Chemie International Edition. 45 (20): 3306–3309. doi:10.1002 / anie.200600164. ISSN 1433-7851. PMID 16619331.
- ^ Sorgi, K.L. (2001). „Diisopropylethylamin“. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rd254. ISBN 978-0471936237.
- ^ Dunetz, Joshua R .; Magano, Javier; Weisenburger, Gerald A. (02.02.2016). „Velké aplikace amidových vazebných činidel pro syntézu farmaceutik“. Výzkum a vývoj organických procesů. 20 (2): 140–177. doi:10.1021 / op500305s. ISSN 1083-6160.
- ^ Moore, J. L .; Taylor, S. M .; Soloshonok, V. A. (2005). „Efektivní a provozně pohodlná obecná syntéza terciárních aminů přímou alkylací sekundárních aminů alkylhalogenidy v přítomnosti Huenigovy báze“. Arkivoc. 2005 (část vi): 287–292. EJ-1549C. Archivovány od originál dne 2008-03-04. Citováno 2006-06-16.
- ^ Činčila, Rafael; Nájera, Carmen (2011). „Nedávný pokrok v Sonogashirových reakcích“. Recenze chemické společnosti. 40 (10): 5084. doi:10.1039 / c1cs15071e. ISSN 0306-0012. PMID 21655588.
- ^ Walba, David M .; Thurmes, William N .; Haltiwanger, R. Curtis (1988). "Vysoce stereokontrolovaná cesta k monensinovému spiroketálnímu kruhovému systému". The Journal of Organic Chemistry. 53 (5): 1046–1056. doi:10.1021 / jo00240a022. ISSN 0022-3263.
- ^ Rees, W .; Marcos, C. F .; Polo, C .; Torroba, T .; Rakitin O. A. (1997). „Od Hünigovy základny po Bis ([1,2] dithiolo) - [1,4] thiaziny v jedné nádobě: Rychlá cesta k vysoce nasyceným heterocyklům“. Angewandte Chemie International Edition. 36 (3): 281–283. doi:10.1002 / anie.199702811.
- ^ Lepore, Salvatore D .; Khoram, Anita; Bromfield, Deborah C .; Cohn, Pamela; Jairaj, Vinod; Silvestri, Maximilian A. (2005). "Studie na manganem zprostředkovanou izomerizaci alkynylkarbonylu na allenylkarbonyly". The Journal of Organic Chemistry. 70 (18): 7443–7446. doi:10.1021 / jo051040u. ISSN 0022-3263.