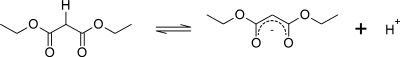Diethyl malonát - Diethyl malonate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Diethyl malonát[1] | |
| Preferovaný název IUPAC Diethyl propandioát | |
| Ostatní jména Diethyl malonát | |
| Identifikátory | |
3D model (JSmol ) | |
| Zkratky | DEM |
| 774687 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.003.006 |
| Číslo ES |
|
| Pletivo | Diethyl + malonát |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C7H12Ó4 | |
| Molární hmotnost | 160,17 g / mol |
| Vzhled | bezbarvá kapalina |
| Hustota | 1,05 g / cm3, kapalný |
| Bod tání | -50 ° C (-58 ° F; 223 K) |
| Bod varu | 199 ° C (390 ° F; 472 K) |
| zanedbatelný | |
| Kyselost (strK.A) | 14 |
| -92.6·10−6 cm3/ mol | |
| Nebezpečí | |
| Hlavní nebezpečí | Zdraví škodlivý (X), hořlavý (F) |
| Bezpečnostní list | Bezpečnostní list Oxfordské univerzity |
| Bod vzplanutí | 200 ° C (392 ° F; 473 K) |
| Související sloučeniny | |
Související sloučeniny | Dimethyl malonát Kyselina malonová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Diethyl malonát, také známý jako DEM, je diethyl ester z kyselina mallonová. Vyskytuje se přirozeně v hrozny a jahody jako bezbarvý kapalný s jablko -jako zápach, a používá se v parfémy. Je také zvyklý syntetizovat jiný sloučeniny jako barbituráty, umělé příchutě, vitamin B1, a vitamin B6.
Struktura a vlastnosti
Kyselina malonová je poměrně jednoduchá dikarboxylová kyselina, se dvěma karboxylové skupiny blízko u sebe. Při tvorbě diethylmalonátu z kyseliny malonové se hydroxyl skupina (-OH) na obou karboxylových skupinách je nahrazena skupinou ethoxy skupina (-OEt; -OCH2CH3). Methylenová skupina (-CH2-) ve středu malinové části molekuly diethylmalonátu sousedí dva karbonylové skupiny (-C (= O) -).[2]
Atomů vodíku na uhlíku sousedících s karbonylovou skupinou v molekule je podstatně více kyselé než atomy vodíku na uhlíku sousedícím s alkylové skupiny (až 30 řádů). (Toto je známé jako poloha α vzhledem ke karbonylu.) Atomy vodíku na uhlíku sousedícím se dvěma karbonylovými skupinami jsou ještě kyselější, protože karbonylové skupiny pomáhají stabilizovat karbanion vznikající odstraněním protonu z methylenové skupiny mezi nimi.
Rozsah rezonanční stabilizace konjugované báze této sloučeniny je znázorněn níže uvedenými třemi rezonančními formami:
Příprava
Dietylmalonát lze připravit reakcí sodné soli produktu kyselina chloroctová s kyanid sodný, následován základní hydrolýza výslednice nitril čímž se získá sodná sůl kyseliny malónové. Fischerova esterifikace dává diethyl malonát:
Reakce
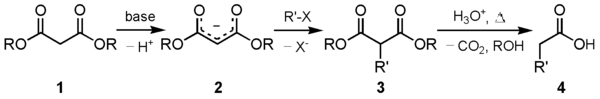
Malonicesterová syntéza
Jedno z hlavních použití této sloučeniny je v syntéza mallonového esteru. Karbanion (2) vytvořený reakcí diethyl malonátu (1) s vhodnou bází lze alkylovat vhodným elektrofil. Tato alkylovaná 1,3-dikarbonylová sloučenina (3) snadno podstoupí dekarboxylace se ztrátou oxidu uhličitého, čímž se získá substituovaná kyselina octová (4):
Obecně jsou jako báze výhodné soli alkoxidového aniontu, jehož alkylová část odpovídá soli použité při výše uvedené alkylaci. Může použít konvenční základnu základní hydrolýza produkty - například hydroxid sodný by jednoduše produkoval malonát sodný a alkohol - zatímco jiné alkoxidové soli způsobí míchání transesterifikace. Pouze "stejný" alkoxidový anion jako ten, který se použil k alkylaci deprotonovaného aktivního methylenového místa, zabrání jak bazické hydrolýze, tak transesterifikaci.
Další reakce
Stejně jako mnoho jiných esterů prochází tato sloučenina Kondenzace esteru Claisen. Výhodou použití této sloučeniny je to, že se zamezí nechtěným samokondenzačním reakcím. Stejně jako ostatní estery i tato sloučenina prochází bromace na alfa pozici.[3]
Diethylmalonát lze nitrosovat přebytkem dusitanu sodného v kyselině octové, čímž se získá diethyloximinomalonát, jehož katalytická hydrogenolýza v ethanolu nad Pd / C poskytne diethylaminomalonát (DEAM). DEAM může být acetylován za vzniku diethylacetamidomalonátu (použitelného při syntéze aminokyselin), nebo může být přidán s 3-substituovanými 2,4-diketony k vroucí kyselině octové, aby v maximálním výtěžku byly získány různě substituované ethylpyrrol-2-karboxyláty syntéza porfyrinu. (Ref. J.B. Paine III, D. Dolphin, J. Org. Chem. 1985, 50, 5598-5604.)
Reference
- ^ „kyselina malónová“ je uznávána jako platný, odborníkem ověřený název pro to, co by se podle ChemSpider.
- ^ "IR spektrum kyseliny malonové". Archivovány od originál dne 26.06.2010. Citováno 2010-02-14.
- ^ C. S. Palmer a P. W. McWherter. "Ethylbromomalonát". Organické syntézy.; Kolektivní objem, 1, str. 245