Hexamethylfosforamid - Hexamethylphosphoramide
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Triamid hexamethylfosforečné kyseliny[1] | |
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.010.595 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H18N3ÓP | |
| Molární hmotnost | 179,20 g / mol |
| Vzhled | čirá, bezbarvá kapalina[2] |
| Zápach | aromatický, jemný, podobný aminu[2] |
| Hustota | 1,03 g / cm3 |
| Bod tání | 7,20 ° C (44,96 ° F; 280,35 K) |
| Bod varu | 232,5 ° C (450,5 ° F; 505,6 K) CRC[3] |
| mísitelný[2] | |
| Tlak páry | 0,03 mmHg (4,0 Pa) při 20 ° C[2] |
| Nebezpečí | |
| Hlavní nebezpečí | Podezření na karcinogen[2] |
| Bezpečnostní list | Oxford MSDS |
| Bod vzplanutí | 104,4 ° C (219,9 ° F; 377,5 K) |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | žádný[2] |
REL (Doporučeno) | Ca.[2] |
IDLH (Okamžité nebezpečí) | Ca [N.D.][2] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
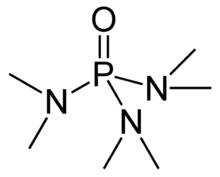
Hexamethylfosforamid, často zkráceně HMPA, je fosforamid (an amide z kyselina fosforečná ) s vzorec [(CH3)2N]3PO. Tato bezbarvá kapalina je užitečné činidlo organická syntéza.
Struktura a reaktivita
HMPA je oxid vysoce bazického terciárního fosfinu hexamethylfosforečnanu triamidu (HMPT[poznámka 1]), P (NMe2)3. Stejně jako ostatní fosfinoxidy (např trifenylfosfin oxid ), molekula má čtyřboké jádro a P = O vazbu, která je vysoce polarizovaná, s významným záporným nábojem na atomu kyslíku.
Sloučeniny obsahující a dusík –Fosforová vazba je obvykle degradována kyselina chlorovodíková za vzniku protonovaného aminu a fosfátu.
Rozpouští alkalické kovy a vytváří modré roztoky, které jsou stabilní několik hodin.[4] Rozpuštěné elektrony jsou přítomny v těchto modrých řešeních.[5]
Aplikace
HMPA je specialita solventní pro polymery, plyny, a organokovové sloučeniny. Zlepšuje selektivitu lithiačních reakcí rozbitím oligomery z lithium základny jako butyllithium. Protože HMPA selektivně solvátuje kationty, zrychluje jinak pomalu SN2 reakce generováním více holých aniontů. Základní dusík centra v HMPA koordinovat silně Li+.[6]
HMPA je ligand v užitečných činidlech na bázi molybden peroxid komplexy, například MoO (O2)2(HMPA) (H2O) se používá jako oxidant v organické syntéze.[7]
Alternativní činidla
Dimethylsulfoxid lze často použít místo HMPA jako spolurozpouštědla. Oba jsou silní vodíková vazba akceptory a jejich atomy kyslíku váží kov kationty. Mezi další alternativy k HMPA patří N,N′ -Tetraalkylmočoviny DMPU (dimethylpropylenmočovina)[8][9] nebo DMI (1,3-dimethyl-2-imidazolidinon).[10] Uvádí se, že triamid kyseliny tripyrrolidinofosforečné (TPPA) je dobrým náhradním činidlem pro HMPA v redukce s jodidem samarnatým[11] a jako Lewisova základna aditivum k mnoha reakcím samarium ketyly.[12]
Toxicita
HMPA je jen mírně toxický, ale bylo prokázáno, že způsobuje rakovinu u potkanů.[6] HMPA může být degradován působením kyselina chlorovodíková.
Poznámky
- ^ Matoucí je, že některé zdroje (například e-EROS) uvádějí HMPT jako zkratku pro O = P (NMe2)3 (hexamethylfosforečný triamid), stejně jako zkratka pro P (NMe2)3 (hexamethylfosfor triamid).[Citace je zapotřebí ]
Reference
- ^ A b „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. str. P001 – P004. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A b C d E F G h NIOSH Kapesní průvodce chemickými nebezpečími. "#0321". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Haynes, William M. (2010). Příručka chemie a fyziky (91 ed.). Boca Raton, Florida, USA: CRC Press. str. 3-280. ISBN 978-1-43982077-3.
- ^ Luehrs, Dean C .; Kohut, John P. (1974). "Hexamethylfosforamidové solváty solí alkalických kovů". Journal of Anorganic and Nuclear Chemistry. 36 (7): 1459–1460. doi:10.1016/0022-1902(74)80605-6.
- ^ Gremmo, Norberto; Randles, John E. B. (1974). „Rozpuštěné elektrony v hexamethylfosforamidu. Část 1. - Vodivost roztoků alkalických kovů“. Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases. 70: 1480–1487. doi:10.1039 / F19747001480.
- ^ A b Dykstra, R. R. (2001). "Hexamethylfosforečný triamid". Encyklopedie činidel pro organickou syntézu. New York, NY: John Wiley & Sons. doi:10.1002 / 047084289X.rh020. ISBN 978-0471936237.
- ^ Dickman, Michael H .; Papež, Michael T. (1994). "Peroxo a Superoxo komplexy chromu, molybdenu a wolframu". Chemické recenze. 94 (3): 569–584. doi:10.1021 / cr00027a002.
- ^ Mukhopadhyay, T .; Seebach, D. (1982). „Substituce HMPT cyklickou močovinou DMPU jako pomocného rozpouštědla pro vysoce reaktivní nukleofily a báze“. Helvetica Chimica Acta. 65 (1): 385–391. doi:10,1002 / hlca.19820650141.
- ^ Beck, A. K .; Seebach, D. (2001). "N,N"- dimethylpropylenmočovina". Encyklopedie činidel pro organickou syntézu. New York: John Wiley & Sons. doi:10.1002 / 047084289X.rd366. ISBN 978-0471936237.
- ^ Lo, Chi-Chu; Chao, Pei-Min (1990). „Nahrazení karcinogenního rozpouštědla HMPA DMI při syntéze feromonů podle pohlaví hmyzu“. Journal of Chemical Ecology. 16 (12): 3245–3253. doi:10.1007 / BF00982095. PMID 24263426.
- ^ McDonald, Chriss E .; Ramsey, Jeremy D .; Sampsell, David G .; Butler, Julie A .; Cecchini, Michael R. (2010). „Triamid kyseliny tripyrrolidinofosforečné jako aktivátor při snižování obsahu jodidu samaria“. Organické dopisy. 12 (22): 5178–5181. doi:10.1021 / ol102040s. PMID 20979412.
- ^ Berndt, Mathias; Hölemann, Alexandra; Niermann, André; Bentz, Christoph; Zimmer, Reinhold; Reissig, Hans-Ulrich (2012). „Nahrazení HMPA v cyklizacích a reakcích organolithných sloučenin podporovaných jodidem samarnatým“. European Journal of Organic Chemistry. 2012 (7): 1299–1302. doi:10.1002 / ejoc.201101830. ISSN 1099-0690.
Triamid kyseliny tripyrrolidinofosforečné (TPPA) může nahradit karcinogenní HMPA jako Lewisovu základní přísadu v mnoha reakcích zahrnujících samariové ketyly. Ve většině případů jsou výtěžky a selektivity cyklizace (het) arylových, alkenylových a alkynylketonů podobné.
externí odkazy
- "Hexamethylfosforamid CAS č. 680-31-9" (PDF). Zpráva o karcinogenech (12. vydání). Národní toxikologický program, ministerstvo zdravotnictví a sociálních služeb. 2011.
- „Hexamethylfosforamid“. NIOSH Kapesní průvodce chemickými nebezpečími. Centra pro kontrolu a prevenci nemocí, ministerstvo zdravotnictví a sociálních služeb. 2011.
- Index společnosti Merck. 4761 (12. vydání).
