HLA-A - HLA-A
| MHC třída I, A | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (heterodimer) | ||||||||||
 Ilustrace HLA-A | ||||||||||
| Proteinový typ | Receptor buněčného povrchu | |||||||||
| Funkce | Prezentace peptidů pro imunitní rozpoznání | |||||||||
| ||||||||||
HLA-A je skupina lidské leukocytové antigeny (HLA), které jsou kódovány pro HLA-A místo, který se nachází na lidském chromozomu 6p21.3.[1] HLA je a hlavní komplex histokompatibility (MHC) antigen specifický pro člověka. HLA-A je jedním ze tří hlavních typů člověka MHC třída I buněčné povrchové receptory. Ostatní jsou HLA-B a HLA-C.[2] Receptor je a heterodimer, a je složen z těžkého α řetězce a menší β řetězce. Řetězec α je kódován variantou Gen HLA-A a β řetězec (β2-mikroglobulin) je neměnný β2 mikroglobulin molekula.[3] Β2 mikroglobulinový protein je kódován samostatnou oblastí lidského genomu.[4]
Molekuly MHC třídy I, jako je HLA-A, jsou součástí procesu, který imunitnímu systému představuje krátké polypeptidy. Tyto polypeptidy mají obvykle délku 7 až 11 aminokyselin a pocházejí z proteinů exprimovaných buňkou. Existují dvě třídy polypeptidů, které mohou být prezentovány proteinem HLA: ty, u nichž se předpokládá, že jsou exprimovány buňkou (vlastní) a skupiny cizího původu (jiné než vlastní).[5] Za normálních podmínek cytotoxické T buňky, které normálně hlídají tělo v krvi, „čte“ peptid prezentovaný komplexem. T buňky, pokud fungují správně, se vážou pouze na jiné peptidy. Pokud dojde k navázání, zahájí se řada událostí, které vyvrcholí smrtí buněk prostřednictvím apoptóza.[6] Tímto způsobem lidské tělo vylučuje všechny buňky infikované virem nebo exprimující proteiny, které by neměly být (např. Rakovinné buňky).
Pro člověka, stejně jako ve většině populací savců, jsou molekuly MHC třídy I extrémně variabilní primární struktura a HLA-A se řadí mezi geny u lidí s nejrychleji se rozvíjející kódující sekvencí. V prosinci 2013 je známo 2432 HLA-A alely kódování pro 1740 aktivních bílkoviny a 117 nulové proteiny.[2] Tato úroveň variace na MHC třídy I je primární příčinou odmítnutí transplantátu, protože je nepravděpodobné, že by náhodná transplantace mezi dárcem a hostitelem vedla k porovnání antigenů HLA-A, B nebo C. Evoluční biologové se rovněž domnívají, že široká variabilita HLA je výsledkem rovnováhy mezi protichůdnými patogenními tlaky. Větší rozmanitost HLA snižuje pravděpodobnost, že celá populace bude zničena jediným patogenem, protože někteří jedinci budou vysoce rezistentní vůči každému patogenu.[5] Účinek variací HLA-A na progresi HIV / AIDS je diskutováno níže.
Gen HLA-A
Gen HLA-A je umístěn na krátkém rameni chromozomu 6 a kóduje větší složku α-řetězce HLA-A. Variace HLA-A α-řetězce je klíčem k HLA funkci. Tato variace podporuje genetickou rozmanitost populace. Protože každá HLA má odlišnou afinitu k peptidům určitých struktur, větší rozmanitost HLA znamená větší rozmanitost antigenů, které mají být „prezentovány“ na buněčném povrchu, což zvyšuje pravděpodobnost, že podmnožina populace bude rezistentní vůči danému cizímu útočníkovi. To snižuje pravděpodobnost, že jediný patogen má schopnost vyhladit celou lidskou populaci.
Každý jedinec může vyjádřit až dva typy HLA-A, jeden od každého ze svých rodičů. Někteří jedinci zdědí stejnou HLA-A od obou rodičů, čímž se sníží jejich individuální rozmanitost HLA; většina jednotlivců však obdrží dvě různé kopie HLA-A. Stejný vzorec následuje pro všechny skupiny HLA.[10] Jinými slovy, každá osoba může exprimovat pouze jednu nebo dvě z 2432 známých alel HLA-A.
Alely
Všem HLA je pojmenován Výbor pro pojmenování faktorů systému HLA Světové zdravotnické organizace. Tento název je uspořádán tak, aby poskytoval co nejvíce informací o konkrétní alele při zachování co nejkratšího názvu. Název HLA vypadá asi takto:
HLA-A * 02: 01: 01: 02L
Všechny alely dostávají alespoň čtyřmístnou klasifikaci (HLA-A * 02: 12). A znamená, ke kterému HLA genu alela patří. Existuje mnoho alel HLA-A, takže klasifikace podle sérotypu zjednodušuje kategorizaci. Další dvojice číslic označuje toto přiřazení. Například, HLA-A * 02: 02, HLA-A * 02: 04, a HLA-A * 02: 324 jsou všichni členové sérotypu A2 (označený předponou * 02).[2] Tato skupina je primárním faktorem odpovědným za kompatibilitu HLA. Všechna tato čísla nelze určit sérotypizací a jsou označena sekvenováním genů. Druhá sada číslic označuje, co se produkuje HLA protein. Ty jsou přiřazeny v pořadí podle objevu a od prosince 2013 je známo 456 různých proteinů HLA-A * 02 (přiřazené názvy HLA-A * 02: 01 až HLA-A * 02: 456). Nejkratší možný název HLA zahrnuje obě tyto podrobnosti.[1] Každé další rozšíření znamená synonymní mutace v kódující oblasti a mutace mimo kódující oblast. Výklad rozšíření je podrobněji popsán v současný systém pojmenování HLA.
Protein
Protein kódovaný genem HLA-A je dlouhý 365 aminokyselin a váží zhruba 41 000 daltonů (Da).[11] Obsahuje 8 exonů.[12]
| Exon | Proteinový segment |
|---|---|
| 1 | Signální peptid |
| 2 | doména α1 |
| 3 | doména α2 |
| 4 | doména α3 |
| 5 | transmembránová oblast |
| 6 | cytoplazmatický ocas |
| 7 | cytoplazmatický ocas |
| 8 | Nespecifikováno |
HLA-A signální peptid je řada hydrofobních aminokyselin přítomných v N-konec proteinu, který ho směruje na endoplazmatické retikulum kde je přeloženo zbývajících sedm domén.[11][12][13] Tři α domény tvoří vazebnou drážku, která drží peptid pro prezentaci CD8 + t-buňky. Transmembránová oblast je oblast, která je zabudována do fosfolipidové dvojvrstvy obklopující lumen ER.[12] Protein HLA-A je jednoprůchodový transmembránový protein.[11] Jinými slovy, první čtyři domény proteinu jsou uvnitř lumenu ER, zatímco poslední tři domény jsou přítomny mimo lumen, což dává proteinu požadovanou orientaci pro správnou funkci. Poslední tři domény proteinu tvoří ocas primárně β-listy který zůstává v cytosolu buňky.[12]
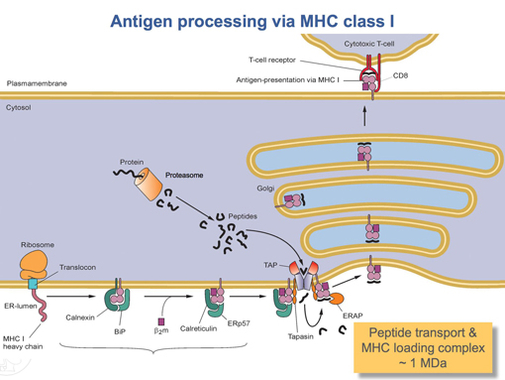
Jakmile je protein HLA-A zcela přeložen, musí být složen do správného tvaru. Molekulární chaperonový protein volala kalnexin a enzym zvaný ERp57 pomáhají při skládání. Calnexin drží těžký řetězec HLA-A, zatímco Erp57 katalyzuje disulfidové vazby mezi těžkým řetězcem a lehkým, β2-mikroglobulinový řetězec. Tato vazba indukuje konformační změnu v těžkém řetězci a vytváří vazebnou drážku. Calnexin poté disociuje s komplexem, který se nyní označuje jako peptidový komplex, a je nahrazen kalretikulin, další chaperonový protein. Krátké peptidy jsou neustále transportovány z buňky do lumenu ER pomocí speciálního transportního proteinu TAP. TAP se poté váže na peptidový komplex s dalším proteinem, tzv tapasin. V tomto bodě se peptidový zaváděcí komplex skládá z HLA-A (těžký řetězec), β2-mikroglobulin (lehký řetězec), enzym ERp57, kalretikulin chaperonový protein, TAP (s vázaným peptidovým fragmentem) a tapasin. Tapasin zvyšuje stabilitu TAP, kromě toho stabilizuje celý peptidový komplex. V tomto okamžiku TAP uvolňuje peptid, který transportoval, do lumenu ER. Blízkost vazebné drážky HLA-A k TAP je zajištěna komplexem zavádění peptidu. To zvyšuje pravděpodobnost, že peptid najde drážku. Pokud je afinita peptidu k proteinu HLA-A dostatečně velká, váže se v drážce.[15] Výzkum naznačuje, že tapasin může aktivně zavádět peptidy z TAP do komplexu HLA-A a zároveň zadržovat molekuly třídy I v lumenu ER, dokud se nenaváže peptid s vysokou afinitou.[16]
Poté, co se peptid s dostatečně vysokou afinitou naváže na MHC třídy I, uvolní molekulu kalretikulin, ERp57, TAP a tapasin.[15] V tomto okamžiku se komplex třídy I skládá z proteinu HLA-A navázaného na β2-mikroglobulin a krátký peptid. Je stále ukotven v membráně ER transmembránovou doménou. V určitém okamžiku ER přijme signál a část membrány, která drží komplex, se uvolní a bude transportována do golgiho těl pro další zpracování. Z těl golgi je komplex transportován, opět transportem vezikul, do buněčné membrány. Toto je bod, ve kterém se výše uvedená orientace stává důležitou. Část komplexu HLA-A, která drží peptid, musí být na vnějším povrchu buněčné membrány. Toho je dosaženo fúzí vezikul s buněčnou membránou.[13]
Funkce
Přirozená funkce
Molekuly MHC třídy I představují imunitnímu systému malé peptidy, obvykle o délce 7 až 10 aminokyselin. Volal glykoprotein CD8 váže se na zbytky 223-229 v doméně α3 HLA-A a tento glykoprotein stabilizuje interakce mezi receptorem t-buněk na cytotoxické (CD8+) T-lymfocyty a MHC I. třídy.[17] Receptor T-buněk má také potenciál vázat se na peptid prezentovaný MHC. Ve správně fungujícím imunitním systému jsou z brzlíku povoleny pouze T-buňky, které se neváží na vlastní peptidy, takže pokud se T-buňka váže na peptid, musí to být cizí nebo abnormální peptid. Poté se iniciuje T-buňka apoptóza nebo programovaná buněčná smrt. K tomuto procesu může dojít až 5 minut po počátečním podání cizího antigenu, ačkoli obvykle trvá několik hodin, než se projeví smrt.[18] Tento proces je základem získané imunity a slouží jako primární obrana proti virům a dalším intracelulárním patogenům.
Další aktivity
V šedesátých letech se ukázalo, že faktory na darovaných orgánech a tkáních často vedly k destrukci darované tkáně imunitním systémem hostitele. MHC byly původně objeveny jako výsledek tohoto pozorování (viz historie HLA Více podrobností).[5] Existují dva typy komplexů prezentujících peptidy, MHC třídy I a třídy II. Každý z nich má více HLA genů, z nichž HLA-A je pouze jeden. Existují tři hlavní HLA, které by se měly shodovat mezi dárci a příjemci. Jsou to HLA-A, HLA-B (oba MHC třídy I) a HLA-DR (MHC třídy II).[10] Pokud mají dvě tkáně stejné geny kódující tyto tři HLA, je pravděpodobnost a závažnost odmítnutí minimalizována.[19]
Role v nemoci
| Přidružená nemoc | Sérotypy | ||
| Ankylozující spondylitida | A24 | ||
| Cukrovka typu I[20] | A1 | A24 | |
| Hemochromatóza (nižší buňky CD8 +) | A3 | ||
| Myasthenia gravis | A3 | A24 | A30 |
| Leukémie, T-buňky, dospělí | A26 | A68 | |
| Roztroušená skleróza | A3 | ||
| Susept viru papilomu. | A11 | ||
| Spontánní potrat | A2 | ||
HLA slouží jako jediné spojení mezi imunitním systémem a tím, co se děje uvnitř buněk. Jakákoli změna na straně HLA, ať už je to snížená vazba na určitý peptid nebo zvýšená vazba na určitý peptid, je tedy vyjádřena jako zvýšená náchylnost k nemoci nebo snížená náchylnost k nemoci. Jinými slovy, určité HLA nemusí být schopné vázat se na jakýkoli z krátkých peptidů produkovaných proteolýza patogenních proteinů. V takovém případě neexistuje žádný způsob, jak imunitní systém zjistit, že je buňka infikována. Infekce se tedy může množit nekontrolovaně. Funguje to i opačně. Některé HLA váží patogenní peptidové fragmenty s velmi vysokou afinitou. To v podstatě „přeplňuje“ jejich imunitní systém, pokud jde o konkrétní patogen, což jim umožňuje zvládnout infekci, která by jinak mohla být zničující.[5]
HIV / AIDS
Jedním z nejvíce prozkoumaných příkladů diferenciální imunitní regulace patogenu je virus lidské imunodeficience. Protože HIV je virus RNA, mutuje neuvěřitelně rychle. To mění peptidy produkované proteolýzou, což mění peptidy, které mohou být prezentovány imunitnímu systému MHC infikované buňky. Jakýkoli virus s mutací, který vytváří peptid s vysokou afinitou pro konkrétní HLA, je rychle zabit imunitním systémem, a tak nepřežije a tento vysoce afinitní peptid se již nevyrábí. Ukázalo se však, že i HIV má ve svém genomu některé konzervované oblasti, a pokud je HLA schopná vázat se na peptid produkovaný ze konzervované oblasti, existuje jen málo, co může HIV udělat, aby se vyhnul imunitní detekci a destrukci.[5] Toto je princip, který stojí za HLA zprostředkovaným rozdílným zatížením HIV.
S více než 2 000 variacemi MHC kódovaných HLA-A je obtížné určit dopad všech variant na zátěž HIV. Bylo však zapleteno několik vybraných. Ukázalo se, že HLA-A * 30 snižuje virovou nálož na méně než 10 000 kopií / kubický milimetr, což je považováno za poměrně nízké. Na druhou stranu, HLA-A * 02 se podílí na vysoké virové zátěži (více než 100 000 kopií / kubický milimetr), když je spojena s HLA-B * 45. Kromě toho haplotypy HLA-A * 23-C * 07 a HLA-A * 02-C * 16 typicky exprimovaly zvýšené virové zátěže v populaci vzorků Zambie. Jedním z nejúčinnějších haplotypů inhibujících HIV byl HLA-A * 30-C * 03, zatímco jedním z nejméně účinných byl HLA-A * 23 * B * 14. Souhrnně lze říci, že HLA-A * 23 vysoce koreloval se zvýšenou zátěží HIV mezi populací vzorku, i když je důležité poznamenat, že u vzorků různého etnického původu tato korelace významně klesá.[21]
Ačkoli je klasifikace vlivu jednotlivých HLA genů a alel na přítomnost HIV obtížná, stále lze učinit určité silné závěry. Jedinci, kteří jsou homozygotní v jednom nebo více HLA genech třídy I, typicky postupují k AIDS mnohem rychleji než heterozygoti. U některých homozygotních jedinců je rychlost progrese dvojnásobná u heterozygotů. Tato diferenciální progrese koreluje poměrně těsně se stupněm heterozygotnosti.[22] V souhrnu jsou určité alely HLA-A spojeny s rozdílnou virovou zátěží u pacientů infikovaných HIV; vzhledem k rozmanitosti těchto alel je však obtížné klasifikovat dopad každé alely na imunitní regulaci HIV. Přesto je možné korelovat heterozygotnost u alel HLA-A se sníženou rychlostí progrese k AIDS.
Nejen, že určité alely HLA předepisují zvýšenou nebo sníženou rezistenci na HIV, ale HIV je schopen změnit expresi HLA, a to selektivně vede ke snížené eliminaci přirozené zabijácké buňky (NK buňky). Výzkum ukázal, že HIV snižuje expresi MHC třídy I v infikovaných buňkách. To však bez rozdílu otevírá možnost útoku NK buňkami, protože NK buňky reagují na downregulaci HLA-C a HLA-E. Je zřejmé, že tento mechanismus vyvíjel selektivní tlak na virus HIV. HIV tedy vyvinulo schopnost downregulace HLA-A a HLA-B bez významného narušení exprese HLA-C a HLA-E.[23] Protein kódovaný genomem HIV, negativní regulační faktor (Nef), indukuje tuto změnu vazbou na cytoplazmatický ocas MHC třídy I, zatímco je ještě v endoplazmatickém retikulu nebo příležitostně, když je v raných fázích obchodování s těly golgi. Tento komplex MHC a Nef pak způsobí, že adaptorový protein 1 (AP-1) nasměruje MHC k degradaci lysozomů místo na buněčnou membránu, kde normálně funguje.[24] Kromě selektivní HLA downregulace, negativní regulační faktor (Nef) umožňuje HIV downregulaci CD4 a CD8. Tyto glykoproteiny jsou nezbytné pro vázání pomocných t-buněk a cytotoxických t-buněk na MHC. Bez těchto kofaktorů je méně pravděpodobné, že se oba typy t-buněk vážou na HLA a iniciují apoptózu, i když HLA exprimuje peptid odvozený od HIV. Oba tyto proteiny jsou také zaměřeny na jejich cytoplazmatickou ocasní doménu.[24] Kombinace těchto schopností výrazně zvyšuje schopnost HIV vyhnout se detekci imunitním systémem.
souhrn
HLA-A je jedna konkrétní skupina lidských MHC třídy I. Skládá se z několika stovek různých genů a několika tisíc variantních alel. HLA-A je rozhodující pro cytotoxickou imunitní odpověď řízenou t-buňkami na viry a jiné intracelulární patogeny. Protože každý gen HLA-A má vysokou afinitu k mírně odlišným peptidům, určité HLA-As jsou spojeny se zvýšeným rizikem, rychlejší progresí a / nebo zvýšenou závažností mnoha nemocí. Z podobných důvodů je shoda HLA-A nezbytná pro úspěšné transplantace tkáně.
Reference
- ^ A b „HLA Nomenclature @ hla.alleles.org“. Výzkumný ústav Anthonyho Nolana. 10. listopadu 2013. Citováno 8. prosince 2013.
- ^ A b C "Statistika". Evropský bioinformatický institut (EBI) / Evropská laboratoř molekulární biologie (EMBL). Citováno 13.prosince 2013.
- ^ Ponoří PJ (srpen 2013). „Systém lidského leukocytového antigenu (HLA): biologie imunitního systému“. Manuál Merck Professional. Merck Sharp & Dohme Corp. Citováno 14.prosince 2013.
- ^ „B2M Gene“. Genové karty. Weizmann Institute of Science. 7. listopadu 2013. Citováno 14.prosince 2013.
- ^ A b C d E Daniel M. Davis (2014). Gen kompatibility. Jak naše těla bojují s nemocemi, přitahují ostatní a definují naše já. Oxford: Oxford University Press. ISBN 978-0-19-931641-0.
- ^ Accorsi D (14. září 2012). „Montáž a prezentace MHC třídy I“. Youtube. Citováno 8. prosince 2013.
- ^ A b C ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 GRCh38: Ensembl uvolnění 89: ENSG00000206505, ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b Fix M (1998). „HLA shoda, protilátky a vy“. Transplantace ledvin: minulost, současnost a budoucnost. Lékařské centrum University of Michigan / Stanford University. Citováno 14.prosince 2013.
- ^ A b C „Major Histocompatibility Complex, Class I, A“. Genové karty. Weizmann Institute of Science. 7. listopadu 2013. Citováno 16. prosince 2013.
- ^ A b C d „HLA-A hlavní histokompatibilní komplex, třída I, A [Homo sapiens (člověk)]". Národní centrum pro biotechnologické informace. Americká národní lékařská knihovna. 12. prosince 2013. Citováno 16. prosince 2013.
- ^ A b Alberts, Bruce (2010). Základní buněčná biologie (Třetí vydání.). Věnec věnec. ISBN 9780815341291.
- ^ Tampé, Robert. „P16 translokační mechanismus a virová inhibice komplexu MHC I s peptidem“. Molekulární porozumění transmembránovým procesům. Ústav biochemie Biocenter. Citováno 16. prosince 2013.
- ^ A b Accorsi, Diego (14. září 2012). „Montáž a prezentace MHC třídy I“. Imunologie v Torontu. Katedra imunologie a biochemie a biomedicínských komunikací na University of Toronto. Citováno 16. prosince 2013.
- ^ Grandea AG, Van Kaer L (duben 2001). "Tapasin: chaperon ER, který kontroluje sestavení MHC třídy I s peptidem". Trendy v imunologii. 22 (4): 194–9. doi:10.1016 / S1471-4906 (01) 01861-0. PMID 11274924.
- ^ „CD8“. Skupina modulace T-buněk. tcells.org. 2009. Archivovány od originál dne 18. února 2013. Citováno 17. prosince 2013.
- ^ Janeway, Charles A. (2001). "8". Imunobiologie imunitní systém zdraví a nemoci (5. vyd.). New York: Garland. ISBN 978-0815336426. Citováno 17. prosince 2013.
- ^ Solomon S, Pitossi F, Rao MS (únor 2015). „Bankovnictví na iPSC - je to proveditelné a stojí to za to?“. Recenze kmenových buněk. 11 (1): 1–10. doi:10.1007 / s12015-014-9574-4. PMC 4333229. PMID 25516409.
- ^ Noble JA, Valdes AM, Bugawan TL, Apple RJ, Thomson G, Erlich HA (srpen 2002). „Lokalita HLA třídy I A ovlivňuje náchylnost k cukrovce 1. typu“. Lidská imunologie. 63 (8): 657–64. doi:10.1016 / S0198-8859 (02) 00421-4. PMC 4049513. PMID 12121673.
- ^ Tang J, Tang S, Lobashevsky E, Myracle AD, Fideli U, Aldrovandi G, Allen S, Musonda R, Kaslow RA (srpen 2002). „Příznivé a nepříznivé alely a haplotypy HLA třídy I v Zambii převážně infikované virem lidské imunodeficience typu 1 kladu C.“. Journal of Virology. 76 (16): 8276–84. doi:10.1128 / JVI.76.16.8276-8284.2002. PMC 155130. PMID 12134033.
- ^ Carrington M, Nelson GW, Martin MP, Kissner T, Vlahov D, Goedert JJ, Kaslow R, Buchbinder S, Hoots K, O'Brien SJ (březen 1999). „HLA a HIV-1: výhoda heterozygotů a nevýhoda B * 35-Cw * 04“. Věda. 283 (5408): 1748–52. Bibcode:1999Sci ... 283.1748C. doi:10.1126 / science.283.5408.1748. PMID 10073943.
- ^ Cohen GB, Gandhi RT, Davis DM, Mandelboim O, Chen BK, Strominger JL, Baltimore D (červen 1999). „Selektivní downregulace hlavních proteinů histokompatibilního komplexu třídy I pomocí HIV-1 chrání buňky infikované HIV před NK buňkami“. Imunita. 10 (6): 661–71. doi:10.1016 / S1074-7613 (00) 80065-5. PMID 10403641.
- ^ A b Leonard JA, Filzen T, Carter CC, Schaefer M, Collins KL (červenec 2011). „HIV-1 Nef narušuje intracelulární přenos hlavního histokompatibilního komplexu třídy I, CD4, CD8 a CD28 odlišnými cestami, které sdílejí společné prvky“. Journal of Virology. 85 (14): 6867–81. doi:10.1128 / JVI.00229-11. PMC 3126561. PMID 21543478.
externí odkazy
- Molekulární antropologie Yahoo Group
- Frekvenční databáze alel a haplotypů HLA
- NLA nomenklatura HLA Úplný seznam proteinů I. třídy
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P04439 (HLA třída I histokompatibilního antigenu, alfa řetězec) na PDBe-KB.