Ferredoxin - NADP (+) reduktáza - Ferredoxin—NADP(+) reductase
| ferredoxin-NADP + reduktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 1.18.1.2 | ||||||||
| Číslo CAS | 9029-33-8 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a ferredoxin-NADP+ reduktáza (ES 1.18.1.2 ) zkráceně FNR, je enzym že katalyzuje the chemická reakce
- 2 redukované ferredoxin + NADP+ + H+ 2 oxidovaný ferredoxin + NADPH
3 substráty tohoto enzymu jsou snížena ferredoxin, NADP+, a H+, zatímco jeho dva produkty jsou oxidovaný ferredoxin a NADPH. Má to flavin kofaktor, FAD.
Tento enzym patří do rodiny oxidoreduktázy, které používají železo-sirné proteiny jako donory elektronů a NAD+ nebo NADP+ jako akceptory elektronů.
Tento enzym se účastní fotosyntéza.
Nomenklatura
The systematické jméno této třídy enzymů je ferredoxin: NADP+ oxidoreduktáza. Mezi další běžně používaná jména patří:
- adrenodoxin reduktáza,
- ferredoxin-NADP+ reduktáza,
- ferredoxin-NADP+ oxidoreduktáza,
- ferredoxin-nikotinamid adenin dinukleotid fosfát reduktáza,
- ferredoxin-nikotinamid-adenin dinukleotid fosfát (oxidovaný), reduktáza
- ferredoxin-TPN reduktáza,
- NADP+: ferredoxin oxidoreduktáza,
- NADPH: ferredoxin oxidoreduktáza,
- redukovaný nikotinamid adenin dinukleotid fosfát-adrenodoxin, reduktáza a
- TPNH-ferredoxin reduktáza
Mechanismus
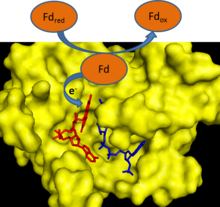
V průběhu fotosyntéza, elektrony jsou odstraněny z vody a přeneseny na jediný elektronový nosič ferredoxin. Ferredoxin: NADP+ reduktáza poté přenáší elektron z každé ze dvou molekul ferredoxinu na jednu molekulu dvou elektronového nosiče NADPH.[1] FNR využívá FAD, které mohou existovat v oxidovaný stav, jeden elektron snížena semichinon stavu a plně redukovaném stavu pro zprostředkování tohoto přenosu elektronů.[2]
FNR má mechanismus indukovaného uložení katalýza.[2] Vazba ferredoxinu na enzym způsobuje tvorbu a vodíková vazba mezi a glutamát zbytek (E312) a a serin zbytek (S96) v Aktivní stránky.[3] Glutamátový zbytek je vysoce konzervovaný, protože stabilizuje semichinonovou formu FAD a je donorem / akceptorem protonu v reakci.[4] Krokem omezujícím rychlost reakce elektronového přenosu je uvolnění první oxidované molekuly ferredoxinu po redukci FAD jedním elektronem.[2] Tento krok je inhibován přítomností oxidovaného ferredoxinu a stimulován přítomností NADP+.[2] Vazba NADP+ k enzymu snižuje vazebnou afinitu enzymu k ferredoxinu.[5]
Tato reakce může také fungovat obráceně a generovat redukovaný ferredoxin, který lze poté použít v různých biosyntetických drahách. Molekuly používají některé bakterie a řasy flavodoxin místo ferredoxinu jako jediné molekuly nosiče elektronů, která má být redukována nebo oxidována.[2]
Struktura
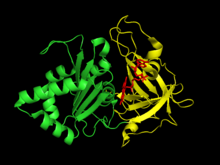
Ferredoxin rostlinného typu: NADP+ reduktáza má dva strukturální domény. První doména je antiparalelní beta barel na amino konec z protein který obsahuje vazebnou doménu pro kofaktor FAD.[6] Druhá doména je na karboxylový konec bílkoviny a obsahuje alfa šroubovice -beta řetězec složit.[6] Tato koncová doména je místem NADP+ váže.[7] The Aktivní stránky protože enzym se vyskytuje na rozhraní mezi dvěma doménami.[8]
Vazba enzymu na thylakoid membrána zahrnuje a polyprolin typu II šroubovice vytvořeno mezi dvěma monomery FNR a několika prolin bohatý integrální membránové proteiny.[9]
Ke konci roku 2007, 54 struktur byl pro tuto třídu enzymů vyřešen pomocí PDB přístupové kódy 1B2R, 1BJK, 1BQE, 1BX0, 1BX1, 1CJC, 1E1L, 1E62, 1E63, 1E64, 1E6E, 1EWY, 1 FDR, 1FNB, 1FNC, 1FND, 1FRN, 1FRQ, 1GAQ, 1GAW, 1GJR, 1GO2, 1GR1, 1H42, 1H85, 1JB9, 1OGI, 1OGJ, 1QFY, 1QFZ, 1QG0, 1QGA, 1QGY, 1QGZ, 1QH0, 1QUE, 1QUF, 1SM4, 1W34, 1W35, 1W87, 2B5O, 2BGI, 2BGJ, 2 BMW, 2BSA, 2C7G, 2GQW, 2GR0, 2GR1, 2GR2, 2GR3, 2OK7, a 2OK8.
Funkce
Ferredoxin: NADP+ reduktáza je posledním enzymem při přenosu elektrony v průběhu fotosyntéza z fotosystém I do NADPH.[1] NADPH se poté použije jako redukční ekvivalent v reakcích Calvinův cyklus.[1] Cyklování elektronů z ferredoxinu na NADPH probíhá pouze ve světle částečně, protože aktivita FNR je inhibována ve tmě.[10] U nefotosyntetických organismů FNR pracuje primárně opačně a poskytuje redukovaný ferredoxin pro různé metabolické cesty. Mezi tyto cesty patří fixace dusíkem, terpenoidní biosyntéza, steroid metabolismus, oxidační stres reakce a biogeneze proteinů železo-síra.[6]
FNR je a rozpustný bílkovina, která se v chloroplast stroma a navázané na tylakoidní membránu. K této vazbě dochází naproti aktivnímu místu enzymu a nezdá se, že by ovlivňoval strukturu aktivního místa nebo neměl významný dopad na aktivitu enzymu.[9] Po navázání na tylakoidní membránu existuje enzym jako dimer, ale pokud je ve stromatu volný, je monomerní.[9] Vazba FNR na integrální membránové proteiny na tylakoidní membráně je za kyselých podmínek zvýšena, takže nábor a navázání FNR na tylakoidní membránu může být metodou skladování a stabilizace enzymu ve tmě, když nedochází k fotosyntéze.[11] Chloroplastový stroma se mírně liší kyselé ve tmě na více zásaditý ve světle.[9] Proto by ve tmě bylo přijato více FNR a vázáno na tylakoidní membránu a ve světle by více FNR distancovat z membrány a být volný ve stromatu.
Vývoj
Ferredoxin NADP+ reduktázy jsou přítomny v mnoha organismech, včetně rostliny, bakterie a mitochondrie eukaryot. Tyto proteiny však patří do dvou nesouvisejících proteinových rodin a jsou příkladem konvergentní evoluce.[6] FNR rostlinného typu (InterPro: IPR015701, InterPro: IPR033892 ) zahrnují plastidové FNR pozorované v rostlinách.[6] The glutathion-reduktáza -typ FNR (InterPro: IPR022890, InterPro: IPR021163 ), někdy pojmenovaný adrenodoxin-NADP + reduktáza pro rozlišení, jsou vidět v mitochondriích eukaryot.[6] Obě rodiny jsou vidět v bakteriích. Dvě rodiny navíc, jedna thioredoxin reduktáza -like (TRLF) a druhý s jedinečným mechanismem (NfnAB), byl identifikován.[12]
V rostlinné rodině FNR vedl selektivní evoluční tlak k rozdílům v katalytické účinnosti FNR ve fotosyntetických a nefotosyntetických organismech. Přenos elektronů pomocí FNR je krok omezující rychlost fotosyntézy, takže plastidový FNR v rostlinách se vyvinul jako vysoce účinný.[7] Tyto plastidové FNR jsou 20–100krát aktivnější než bakteriální FNR.[13] Tato vyšší katalytická účinnost přenosu elektronů z FAD na NADP+ souvisí se strukturálními změnami v aktivním místě, které snižují vzdálenost mezi N5 ve FAD a C4 v NADP+.[14] Plastidické FNR v rostlinách se také vyvinuly tak, aby měly vysoký stupeň specificity substrátu pro NADP+ přes NAD+; studie mutací aminokyselin ukázaly, že terminál tyrosin zbytek v plastidových FNR hraje klíčovou roli v této specificitě substrátu.[7] Naproti tomu některé nefosyntetické FNR se přednostně neváží na NADP+ a chybí tento tyrosinový zbytek.[14]
Relevance nemoci
Několik hlavních lidských onemocnění je způsobeno obligátním intracelulárním prvoky paraziti ve kmeni Apicomplexa. The apicoplast organela v těchto organismech se předpokládá, že pocházejí z endosymbiotikum událost, ve které prastarý předek pohltil řasa buňka.[6] Tyto apikoplasty obsahují rostlinné FNR, které protozoan používá ke generování redukovaných ferredoxin, který se poté používá jako redukční činidlo v základních biosyntetických drahách.[15] FNR ze dvou hlavních paraziti ovlivňující lidi, Plasmodium falciparum, Který způsobuje malárie, a Toxoplasma gondii, Který způsobuje toxoplazmóza, byly seřazeny.[16] Protože lidé nemají homologní protein, tyto enzymy jsou možné nové cíle pro lékové terapie proti těmto chorobám.[16]
Reference
- ^ A b C Berg, Jeremy M .; Tymoczko, John L .; Stryer, Lubert (2007). Biochemie (6. vydání). New York: W.H. Freemane. ISBN 978-0-7167-8724-2.
- ^ A b C d E Carrillo, N .; Ceccarelli, EA. (Květen 2003). „Otevřené otázky ve ferredoxinu-NADP+ katalytický mechanismus reduktázy ". Eur J Biochem. 270 (9): 1900–15. doi:10.1046 / j.1432-1033.2003.03566.x. PMID 12709048.
- ^ Kurisu, G .; Kusunoki, M .; Katoh, E .; Yamazaki, T .; Teshima, K .; Ve dne.; Kimata-Ariga, Y .; Hase, T. (únor 2001). "Struktura komplexu elektronového přenosu mezi ferredoxinem a ferredoxinem-NADP+ reduktáza ". Nat Struct Biol. 8 (2): 117–21. doi:10.1038/84097. PMID 11175898. S2CID 13611907.
- ^ Dumit, VI .; Essigke, T .; Cortez, N .; Ullmann, GM. (Duben 2010). "Mechanistické poznatky o katalýze ferredoxin-NADP (H) reduktázy zahrnující konzervovaný glutamát v aktivním místě". J Mol Biol. 397 (3): 814–25. doi:10.1016 / j.jmb.2010.01.063. PMID 20132825.
- ^ Medina, M. (srpen 2009). „Strukturální a mechanické aspekty flavoproteinů: přenos fotosyntetických elektronů z fotosystému I do NADP+". FEBS J. 276 (15): 3942–58. doi:10.1111 / j.1742-4658.2009.07122.x. PMID 19583765. S2CID 42610724.
- ^ A b C d E F G Aliverti, A .; Pandini, V .; Pennati, A .; de Rosa, M .; Zanetti, G. (červen 2008). „Strukturální a funkční rozmanitost ferredoxinu-NADP+ reduktázy " (PDF). Arch Biochem Biophys. 474 (2): 283–91. doi:10.1016 / j.abb.2008.02.014. hdl:2434/41439. PMID 18307973.
- ^ A b C Paladini, DH .; Musumeci, MA .; Carrillo, N .; Ceccarelli, EA. (Červen 2009). "Indukované přizpůsobení a rovnovážná dynamika pro vysokou katalytickou účinnost ferredoxin-NADP (H) reduktáz". Biochemie. 48 (24): 5760–8. doi:10.1021 / bi9004232. PMID 19435322.
- ^ Arakaki, AK .; Ceccarelli, EA .; Carrillo, N. (únor 1997). „Rostlinný typ ferredoxinu-NADP+ reduktázy: bazální strukturální rámec a rozmanitost funkcí ". FASEB J. 11 (2): 133–40. doi:10.1096 / fasebj.11.2.9039955. PMID 9039955. S2CID 99698.
- ^ A b C d Alte, F .; Stengel, A .; Benz, JP .; Petersen, E .; Soll, J .; Groll, M .; Bölter, B. (listopad 2010). „Ferredoxin: NADPH oxidoreduktáza je přijímána do thylakoidů vazbou na šroubovice polyprolinu typu II způsobem závislým na pH“. Proc Natl Acad Sci U S A. 107 (45): 19260–5. Bibcode:2010PNAS..10719260A. doi:10.1073 / pnas.1009124107. PMC 2984204. PMID 20974920.
- ^ Talts, E .; Oja, V .; Rämma, H .; Rasulov, B .; Anijalg, A .; Laisk, A. (říjen 2007). „Tmavá inaktivace ferredoxin-NADP reduktázy a cyklický tok elektronů pod daleko červeným světlem ve slunečnicových listech“. Photosynth Res. 94 (1): 109–20. doi:10.1007 / s11120-007-9224-7. PMID 17665150. S2CID 416310.
- ^ Benz, JP .; Lintala, M .; Soll, J .; Mulo, P .; Bölter, B. (listopad 2010). „Nový koncept pro vazbu ferredoxin-NADP (H) oxidoreduktázy na rostlinné tylakoidy“. Trends Plant Sci. 15 (11): 608–13. doi:10.1016 / j.tplantts.2010.08.008. PMID 20851663.
- ^ Spaans, SK; Weusthuis, RA; van der Oost, J; Kengen, SW (2015). „Systémy generující NADPH v bakteriích a archaeách“. Hranice v mikrobiologii. 6: 742. doi:10.3389 / fmicb.2015.00742. PMC 4518329. PMID 26284036.
- ^ Orellano, EG .; Calcaterra, NB .; Carrillo, N .; Ceccarelli, EA. (Září 1993). „Zkoumání role karboxylové koncové oblasti ferredoxinu-NADP+ reduktáza místně cílenou mutagenezí a deleční analýzou ". J Biol Chem. 268 (26): 19267–73. PMID 8366077.
- ^ A b Peregrina, JR .; Sánchez-Azqueta, A .; Herguedas, B .; Martínez-Júlvez, M .; Medina, M. (září 2010). „Úloha specifických zbytků ve vazbě koenzymu, tvorbě komplexu náboje a přenosu a katalýze v Anabaena ferredoxinu NADP+-reduktáza ". Biochim Biophys Acta. 1797 (9): 1638–46. doi:10.1016 / j.bbabio.2010.05.006. PMID 20471952.
- ^ Balconi, E .; Pennati, A .; Crobu, D .; Pandini, V .; Cerutti, R .; Zanetti, G .; Aliverti, A. (červenec 2009). "Systém přenosu elektronů ferredoxin-NADP + reduktáza / ferredoxin z Plasmodium falciparum". FEBS J. 276 (14): 3825–36. doi:10.1111 / j.1742-4658.2009.07100.x. PMID 19523113. S2CID 24183752.
- ^ A b Seeber, F .; Aliverti, A .; Zanetti, G. (2005). „Systém rostlinného typu ferredoxin-NADP + reduktáza / ferredoxin redox jako možný lékový cíl proti lidským parazitům apicomplexan“. Curr Pharm Des. 11 (24): 3159–72. doi:10.2174/1381612054864957. PMID 16178751.
Další čtení
- Omura T, Sanders E, Estabrook RW, Cooper DY, Rosenthal O (1966). „Izolace nehemového železného proteinu z kůry nadledvin a flavoproteinu fungujícího jako redukovaná trifosfopyridinová nukleotid-cytochrom P-450 reduktáza“. Oblouk. Biochem. Biophys. 117 (3): 660–673. doi:10.1016/0003-9861(66)90108-1.
- Shin M, Tagawa K, Arnon DI (1963). „Krystalizace ferredoxin-TPN reduktázy a její role ve fotosyntetickém aparátu chloroplastů“. Biochem. Z. 338: 84–96. PMID 14087348.
externí odkazy
 Média související s Ferredoxin - NADP (+) reduktáza na Wikimedia Commons
Média související s Ferredoxin - NADP (+) reduktáza na Wikimedia Commons

