Fixace dusíku - Nitrogen fixation
Fixace dusíku je proces, při kterém molekulární dusík v vzduch je převeden na amoniak (NH
3) nebo příbuzné dusíkaté sloučeniny v půdě.[1] Atmosférický dusík je molekulární dinitrogen, relativně nereaktivní molekula, která je metabolicky nepoužitelná pro všechny mikroorganismy kromě několika. Převádí se biologická fixace dusíku N
2 na amoniak, který je metabolizován většinou organismů.
Fixace dusíku je pro život nezbytná, protože jsou potřebné fixované anorganické sloučeniny dusíku biosyntéza všech obsahujících dusík organické sloučeniny, jako aminokyseliny a bílkoviny, nukleosid trifosfáty a nukleové kyseliny. Jako součást dusíkový cyklus, je to nezbytné pro zemědělství a výroba hnojivo. Rovněž je nepřímo relevantní pro výrobu všech dusíkatých chemických sloučenin, které zahrnují některé výbušniny, léčiva a barviva.
Fixace dusíku se provádí přirozeně v půda podle mikroorganismy nazval diazotrofy které zahrnují bakterie jako Azotobacter a archaea. Některé bakterie fixující dusík mají symbiotický zejména vztahy se skupinami rostlin luštěniny.[2] Volnější nesymbiotické vztahy mezi diazotrofy a rostlinami jsou často označovány jako asociativní, jak je patrné z fixace dusíku na rýže kořeny. Mezi některými dochází k fixaci dusíku termiti a houby.[3] Přirozeně se vyskytuje ve vzduchu pomocí NEX výroba do Blesk.[4][5]
Všechny biologické reakce zahrnující proces fixace dusíku jsou katalyzovány tzv. Enzymy nitrogenázy.[6] Tyto enzymy obsahují žehlička, obvykle s druhým kovem, obvykle molybden ale někdy vanadium.
Fixace
Nebiologické

2 zahájení tvorby kyseliny dusité.
Dusík lze stanovit pomocí Blesk který přeměňuje plynný dusík (N
2) a plynný kyslík (Ó
2) přítomné v atmosféře do NE
X (oxidy dusíku ). NE
X může reagovat s vodou kyselina dusitá nebo kyselina dusičná, který prosakuje do půdy, kde se tvoří dusičnan, což je užitečné pro rostliny. Dusík v atmosféře je vysoce stabilní a nereaktivní kvůli trojná vazba mezi atomy v N
2 molekula.[7] Blesk produkuje dostatek energie a tepla, aby rozbilo toto pouto[7] umožňující atomům dusíku reagovat s kyslíkem a tvořit se NE
X. Tyto sloučeniny nemohou rostliny použít, ale když se tato molekula ochladí, reaguje s kyslíkem a tvoří se NE
2.[8] Tato molekula zase reaguje s vodou za vzniku HNO
3 (kyselina dusičná ), nebo jeho ion NE−
3 (dusičnan ), který je rostlinami použitelný.[9][7]
Biologický
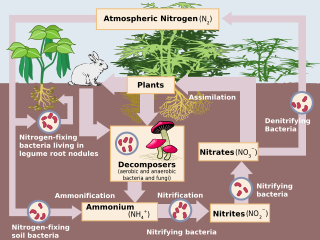
Biologická fixace dusíku byla objevena německým agronomem Hermann Hellriegel[10] a nizozemský mikrobiolog Martinus Beijerinck.[11] Biologická fixace dusíku (BNF) nastává, když je atmosférický dusík přeměněn na amoniak pomocí a dusičnan enzym.[1] Celková reakce pro BNF je:
Tento proces je spojen s hydrolýza 16 ekvivalentů ATP a je doprovázeno společnou tvorbou jednoho ekvivalentu H
2.[12] Přeměna N
2 do amoniaku dochází při a kovový shluk volala FeMoco, zkratka pro železomolybden kofaktor. Mechanismus probíhá prostřednictvím řady protonace a redukční kroky, při nichž FeMoco Aktivní stránky hydrogenuje the N
2 Podklad.[13] Ve volném bydlení diazotrofy, je amoniak generovaný dusičnanem asimilován na glutamát skrz glutamin syntetáza / glutamát syntáza. Mikrobiální geny NIF potřebné pro fixaci dusíku jsou široce distribuovány v různých prostředích.[14][15]
Nitrogenázy se rychle odbourávají kyslíkem. Z tohoto důvodu mnoho bakterií zastaví produkci enzymu v přítomnosti kyslíku. Mnoho organismů vázajících dusík existuje pouze v anaerobní podmínky, respirační ke snižování hladin kyslíku nebo vázání kyslíku pomocí a protein jako leghemoglobin.[1]
Mikroorganismy
Diazotrofy jsou v doméně velmi rozšířené Bakterie počítaje v to sinice (např. velmi významné Trichodesmium a Kyanothece ), stejně jako zelené bakterie síry, Azotobacteraceae, rhizobia a Frankia. Několik povinně anaerobních bakterií fixuje dusík, včetně mnoha (ale ne všech) Clostridium spp. Nějaký archaea také opravit dusík, včetně několika methanogenní taxony, které významně přispívají k fixaci dusíku v půdách s nedostatkem kyslíku.[16]
Sinice obývají téměř všechna osvětlená prostředí na Zemi a hrají klíčovou roli v uhlíku a dusíkový cyklus z biosféra. Obecně mohou sinice používat různé anorganické a organické zdroje kombinovaného dusíku, jako je např dusičnan, dusitany, amonný, močovina, nebo některé aminokyseliny. Několik kmenů sinic je také schopných diazotrofního růstu, což je schopnost, která mohla být přítomna u jejich posledního společného předka v Archean věk.[17] Fixace dusíku sinicemi v korálové útesy dokáže fixovat dvakrát tolik dusíku než na souši - kolem 660 kg /ha /rok. Koloniální mořská sinice Trichodesmium Předpokládá se, že fixuje dusík v takovém měřítku, že představuje téměř polovinu fixace dusíku v mořských systémech na celém světě.[18]
Mořské povrchové lišejníky a nefotosyntetické bakterie patřící do Proteobacteria a Planctomycetes fixují významný atmosférický dusík.[19]
Kořenové uzliny symbiózy
Rodina luštěnin
Mezi rostliny, které přispívají k fixaci dusíku, patří rostliny lusk rodina —Fabaceae - s taxony jako kudzu, jetel, sója, vojtěška, lupina, arašíd a rooibos. Obsahují symbiotický rhizobia bakterie uvnitř uzlíky v jejich kořenové systémy, produkující sloučeniny dusíku, které pomáhají rostlině růst a konkurovat jiným rostlinám.[20] Když rostlina zemře, fixovaný dusík se uvolní a zpřístupní ho dalším rostlinám; to pomáhá oplodnit půda.[1][21] Velká většina luštěnin má toto sdružení, ale jen několik rody (např., Styphnolobium ) ne. V mnoha tradičních zemědělských postupech jsou pole otočeno prostřednictvím různých druhů plodin, které obvykle zahrnují plodinu sestávající převážně nebo zcela z jetel.[Citace je zapotřebí ]
Účinnost fixace v půdě závisí na mnoha faktorech, včetně lusk a podmínky vzduchu a půdy. Například fixace dusíku červeným jetelem se může pohybovat od 50 do 200 lb./akr.[22]
Non-luštěniny

Mezi další rodiny fixující dusík patří:
- Parasponia, tropický rod v rodině Cannabaceae, které jsou schopné interagovat s rhizobií a vytvářet uzliny fixující dusík[23]
- Aktinorhizální rostliny jako olše a bobule může tvořit uzliny fixující dusík díky symbiotickému spojení s Frankia bakterie. Tyto rostliny patří do 25 rodů[24] distribuováno mezi osm rodin.
Schopnost fixovat dusík je přítomna v jiných rodinách, které patří do skupiny objednávky Cucurbitales, Fagales a Rosales, které spolu s Fabales tvoří clade z eurosidy. Schopnost fixovat dusík není v těchto rodinách všeobecně přítomná. Například ze 122 Rosaceae rody, pouze čtyři fixují dusík. Fabales byli první linií, která odbočila z tohoto kladu fixujícího dusík; schopnost fixovat dusík tedy může být plesiomorfní a následně ztracen u většiny potomků původního závodu na fixaci dusíku; Může se však stát, že základní genetický a fyziologický požadavky byly přítomny v počátečním stavu v nejnovější společné předky všech těchto rostlin, ale u některých se vyvinuly, aby plně fungovaly.
| Rodina: Rody Betulaceae: Alnus (olše) |
|
|
Zahrnuje několik symbiotických asociací vázajících dusík sinice (jako Nostoc ):
- Některé lišejníky jako např Lobaria a Peltigera
- Komárová kapradina (Azolla druh)
- Cykasy
- Gunnera
- Blasia (jaterník )
- Hornworts[25]
Endosymbióza v rozsivkách
Rhopalodia gibba, a rozsivka řasa, je eukaryot s sinicemi N
2-fixování endosymbiont organely. Sféroidní těla sídlí v cytoplazmě rozsivek a jsou neoddělitelně od svých hostitelů.[26][27]
Inženýrství eukaryotické nitrogenázy
Někteří vědci pracují na zavedení genů odpovědných za fixaci dusíku přímo do rostlinné DNA. Protože všechny známé příklady fixace dusíku probíhají u prokaryot, je přenos funkčnosti na eukaryota, jako je rostlina, výzvou; jeden tým používá kvasinky jako svůj eukaryotický testovací organismus. Hlavním problémem, který je třeba překonat, je citlivost produkovaných enzymů na kyslík a také energetické požadavky. Uvažuje se o tom, že by proces probíhal uvnitř mitochondrií nebo chloroplastů.[28]
Průmyslové procesy
Možnost, že atmosférický dusík reaguje s určitými chemikáliemi, byla poprvé pozorována u Desfosses v roce 1828. Všiml si, že směsi alkalický kov oxidy a uhlík reagují při vysokých teplotách s dusíkem. S použitím uhličitan barnatý jako výchozí materiál byl první komerční proces k dispozici v 60. letech 19. století a byl vyvinut Margueritte a Sourdeval. Výsledný kyanid barnatý mohl reagovat s párou za vzniku amoniaku.
Dějiny
Před rokem 1900, Tesla experimentoval s průmyslovou fixací dusíku „použitím proudů extrémně vysoké frekvence nebo rychlosti vibrací“.[29][30]
Frank-Caro proces
V roce 1898 Upřímný a Caro oddělil proces a vyrobil karbid vápníku a v následujícím kroku reagoval s dusíkem na kyanamid vápenatý. The Ostwaldův proces pro výrobu kyselina dusičná byl objeven v roce 1902. The Frank-Caro a Ostwaldovy procesy dominovaly průmyslové fixaci až do objevení Haberův proces v roce 1909.[31][32]
Haberův proces

Nejběžnější metodou výroby čpavku je Haberův proces. Výroba hnojiv je nyní největším zdrojem fixovaného dusíku produkovaného člověkem v suchozemských zemích ekosystém. Amoniak je povinným předchůdcem hnojiva, výbušniny a další produkty. Haberův proces vyžaduje vysoké tlaky (kolem 200 atm) a vysoké teploty (alespoň 400 ° C), což jsou běžné podmínky pro průmyslovou katalýzu. Tento proces využívá zemní plyn jako zdroj vodíku a vzduch jako zdroj dusíku.[33]
Bylo provedeno mnoho výzkumů o objevu katalyzátorů pro fixaci dusíku, často s cílem snížit energetické nároky. Takový výzkum však dosud nedokázal přiblížit efektivitu a snadnost Haberova procesu. Mnoho sloučenin reaguje s atmosférickým dusíkem dinitrogenové komplexy. První dinitrogen komplex být nahlášeno bylo Ru (NH
3)
5(N
2)2+.[34]
Redukce okolního dusíku
Dosažení katalytické chemické fixace dusíku za okolních podmínek je pokračujícím vědeckým úsilím. Na základě příkladu dusičnanu tato oblast homogenní katalýzy pokračuje, se zvláštním důrazem na hydrogenaci.[35]
Kovový lithium hoří v atmosféře dusíku a poté se přemění na nitrid lithný. Hydrolýzou výsledného nitridu se získá amoniak. V souvisejícím procesu trimethylsilylchlorid, lithium a dusík reagují v přítomnosti katalyzátoru za vzniku tris (trimethylsilyl) amin. To pak může být použito pro reakci s α, δ, ω-triketony dát tricyklické pyrroly.[36] Procesy zahrnující kovový lithium však nemají žádný praktický význam, protože jsou nekatalytické a znovu redukují Li+
iontový zbytek je obtížný.
Počínaje šedesátými lety bylo identifikováno několik homogenních systémů, které přeměňují dusík na amoniak, někdy katalyticky, ale často fungují pomocí nedefinovaných mechanismů. Původní objev je popsán v rané recenzi:
„Vol'pin a spolupracovníci pomocí neprotické Lewisovy kyseliny, tribromidu hlinitého, dokázali prokázat skutečně katalytický účinek titanu zpracováním dinitrogenu směsí chloridu titaničitého, kovového hliníku a tribromidu hlinitého při 50 ° C , buď v nepřítomnosti, nebo v přítomnosti rozpouštědla, např. benzenu. Až 200 mol amoniaku na mol ethanolu TiCl
4 byl získán po hydrolýze.… “[37]

Hledání dobře definovaných meziproduktů vedlo k charakterizaci mnoha komplexy dinitrogenů s přechodnými kovy. I když několik z těchto dobře definovaných komplexů funguje katalyticky, jejich chování osvětlovalo pravděpodobné fáze fixace dusíku. Plodné rané studie zaměřené na (MN20−
2)(dppe )2 (M = Mo, W), který protonuje za vzniku meziproduktů s ligand M = N−N
2. V roce 1995 molybden Bylo zjištěno, že (III) amido komplex se štěpí N
2 dát odpovídající molybden (VI) nitrid.[39] Tento a související terminální nitridové komplexy byly použity k výrobě nitrily.[40]
V roce 2003 bylo zjištěno, že amido-molybdenový komplex katalyzuje redukci N
2, i když s několika obraty.[38][41][42][43] V těchto systémech, stejně jako biologický, je vodík dodáván do substrátu heterolyticky, pomocí protonů a silných látek redukční činidlo spíše než s H
2.
V roce 2011 byl objeven další systém na bázi molybdenu, ale s difosforem klešťový ligand.[44] Fotolytický uvažuje se také o rozdělení dusíku.[45][46][47][48][49]

Fixace dusíku při a p-blok prvek byl publikován v roce 2018, přičemž jedna molekula dinitrogenu je vázána dvěma přechodnými Lewisova základna -stabilizovaný borylen druh.[50] Výsledný dianion byl následně oxidovaný na neutrální sloučeninu a redukován pomocí vody.
Fotochemická a elektrochemická redukce dusíku
S pomocí katalýzy a energie poskytované elektřinou a světlem, NH
3 lze vyrábět přímo z dusíku a vody při okolní teplotě a tlaku.[Citace je zapotřebí ]
Výzkum
Od roku 2019 výzkum zvažoval alternativní způsoby dodávek dusíku v zemědělství. Místo použití hnojiv vědci zvažovali použití různých druhů bakterií a odděleně potahování semen probiotika které podporují růst bakterie fixující dusík.[51]
Viz také
- Proces Birkeland – Eyde: proces výroby průmyslových hnojiv
- George Washington Carver: americký botanik
- Denitrifikace: organický proces uvolňování dusíku
- Heterocysta
- Nitrifikace: biologická produkce dusíku
- Dusíkový cyklus: tok a přeměna dusíku prostředím
- Nedostatek dusíku
- Balíček pro fixaci dusíku pro kvantitativní měření fixace dusíku rostlinami
- Nitrogenáza: enzymy používané organismy k fixaci dusíku
- Ostwaldův proces: chemický proces výroby kyseliny dusičné (HNO
3) - Technologie push-pull: využití repelentních i atraktivních organismů v zemědělství
Reference
- ^ A b C d Postgate, J. (1998). Fixace dusíku (3. vyd.). Cambridge: Cambridge University Press.
- ^ Zahran, HH (prosinec 1999). „Symbióza luštěnin a fixace dusíku za těžkých podmínek a ve vyprahlém podnebí“. Recenze mikrobiologie a molekulární biologie. 63 (4): 968–89, obsah. doi:10.1128 / MMBR.63.4.968-989.1999. PMC 98982. PMID 10585971.
- ^ Sapountzis, P (2016). „Potenciál pro fixaci dusíku v symbióze termitů s růstem hub“. Hranice v mikrobiologii. 7: 1993. doi:10.3389 / fmicb.2016.01993. PMC 5156715. PMID 28018322.
- ^ Slosson, Edwin (1919). Kreativní chemie. New York, NY: The Century Co. pp.19 –37.
- ^ Hill, R. D .; Rinker, R. G .; Wilson, H. Dale (1979). „Atmosférická fixace dusíku bleskem“. J. Atmos. Sci. 37 (1): 179–192. Bibcode:1980JAtS ... 37..179H. doi:10.1175 / 1520-0469 (1980) 037 <0179: ANFBL> 2.0.CO; 2.
- ^ Wagner SC (2011). „Biologická fixace dusíku“. Znalosti o výchově k přírodě. 3 (10): 15. Archivováno z původního dne 13. září 2018. Citováno 29. ledna 2019.
- ^ A b C Tuck, A. F. (říjen 1976). "Produkce oxidů dusíku bleskovými výboji". Quarterly Journal of the Royal Meteorological Society. 102 (434): 749–755. Bibcode:1976QJRMS.102..749T. doi:10,1002 / qj.49710243404. ISSN 0035-9009.
- ^ Hill, R.D. (srpen 1979). „Atmosférická fixace dusíku bleskem“. Journal of the Atmospheric Sciences. 37: 179–192. Bibcode:1980JAtS ... 37..179H. doi:10.1175 / 1520-0469 (1980) 037 <0179: ANFBL> 2.0.CO; 2. ISSN 1520-0469.
- ^ LEVIN, JOEL S (1984). „Troposférické zdroje NOx: blesky a biologie“. Citováno 29. listopadu 2018.
- ^ Hellriegel, H .; Wilfarth, H. (1888). Untersuchungen über die Stickstoffnahrung der Gramineen und Leguminosen [Studie o příjmu dusíku u Gramineae a Leguminosae]. Berlín: Buchdruckerei der "Post" Kayssler & Co.
- ^ Beijerinck, M. W. (1901). „Über oligonitrophile Mikroben“ [O oligonitrofilních mikrobech]. Centralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene. 7 (2): 561–582.
- ^ Chi Chung, Lee; Markus W., Ribbe; Yilin, Hu (2014). „Kapitola 7. Štěpení trojitého vazby N, N: Transformace dinitrogenu na amoniak nitrogenázami“. V Kroneck, Peter M. H .; Sosa Torres, Martha E. (eds.). Kovem řízená biogeochemie plynných sloučenin v životním prostředí. Kovové ionty v biologických vědách. 14. Springer. 147–174. doi:10.1007/978-94-017-9269-1_7. PMID 25416394.
- ^ Hoffman, B. M .; Lukoyanov, D .; Dean, D.R .; Seefeldt, L. C. (2013). „Nitrogenase: A Draft Mechanism“. Př. Chem. Res. 46 (2): 587–595. doi:10,1021 / ar300267m. PMC 3578145. PMID 23289741.
- ^ Gaby, J. C .; Buckley, D. H. (2011). "Globální sčítání rozmanitosti dusíkatých látek". Environ. Microbiol. 13 (7): 1790–1799. doi:10.1111 / j.1462-2920.2011.02488.x. PMID 21535343.
- ^ Hoppe, B .; Kahl, T .; Karasch, P .; Wubet, T .; Bauhus, J .; Buscot, F .; Krüger, D. (2014). „Síťová analýza odhaluje ekologické vazby mezi bakteriemi, které fixují N, a houbami, které se rozpadají na dřevo“. PLOS ONE. 9 (2): e88141. Bibcode:2014PLoSO ... 988141H. doi:10.1371 / journal.pone.0088141. PMC 3914916. PMID 24505405.
- ^ Bae, Hee-Sung; Morrison, Elise; Chanton, Jeffrey P .; Ogram, Andrew (1. dubna 2018). „Methanogeny jsou hlavními přispěvateli k fixaci dusíku v půdách Florida Everglades“. Aplikovaná a environmentální mikrobiologie. 84 (7): e02222–17. doi:10.1128 / AEM.02222-17. PMC 5861825. PMID 29374038.
- ^ Latysheva, N .; Junker, V. L .; Palmer, W. J .; Codd, G. A .; Barker, D. (2012). „Vývoj fixace dusíku v sinicích“. Bioinformatika. 28 (5): 603–606. doi:10.1093 / bioinformatika / bts008. PMID 22238262.
- ^ Bergman, B .; Sandh, G .; Lin, S .; Larsson, H .; Carpenter, E. J. (2012). "Trichodesmium - rozšířená mořská sinice s neobvyklými vlastnostmi fixace dusíku “. FEMS Microbiol. Rev. 37 (3): 1–17. doi:10.1111 / j.1574-6976.2012.00352.x. PMC 3655545. PMID 22928644.
- ^ „Velká studie naznačuje nové, hojné mikroby vázající dusík v povrchovém oceánu“. ScienceDaily. Archivováno z původního dne 8. června 2019. Citováno 8. června 2019.
- ^ Kuypers, MMM; Marchant, HK; Kartal, B (2011). „Mikrobiální síť pro cyklování dusíku“. Příroda Recenze Mikrobiologie. 1 (1): 1–14. doi:10.1038 / nrmicro.2018.9. PMID 29398704. S2CID 3948918.
- ^ Smil, Václav (2000). Cykly života. Vědecká americká knihovna.
- ^ „Fixace dusíku a očkování luštěnin pícnin“ (PDF). Archivovány od originál (PDF) dne 2. prosince 2016.
- ^ Op den Camp, Rik; Streng, A .; De Mita, S .; Cao, Q .; Polone, E .; Liu, W .; Ammiraju, J. S. S .; Kudrna, D .; Wing, R .; Untergasser, A .; Bisseling, T.; Geurts, R. (2010). "Mykorhizní receptor typu LysM byl přijat pro Rhizobium Symbióza v nonlegume Parasponia". Věda. 331 (6019): 909–912. Bibcode:2011Sci ... 331..909O. doi:10.1126 / science.1198181. PMID 21205637. S2CID 20501765.
- ^ Dawson, J. O. (2008). "Ekologie aktinorhizálních rostlin". Aktinorhizální symbiózy fixující dusík. Fixace dusíku: počátky, aplikace a pokrok ve výzkumu. 6. Springer. 199–234. doi:10.1007/978-1-4020-3547-0_8. ISBN 978-1-4020-3540-1.
- ^ Rai, A. N. (2000). "Cyanobacterium-plant symbioses". Nový fytolog. 147: 449–481. doi:10.1046 / j.1469-8137.2000.00720.x.
- ^ Prechtl, Julia; Kneip, Christoph; Lockhart, Peter; Wenderoth, Klaus; Maier, Uwe-G. (2004). "Intracelulární sféroidní těla Rhopalodia gibba mít zařízení na fixaci dusíku sinic “. Mol. Biol. Evol. 21 (8): 1477–81. doi:10.1093 / molbev / msh086. PMID 14963089.
- ^ Nakayama, Takuro; Inagaki, Yuji (2014). „Jedinečný vývoj genomu v intracelulárním prostředí N
2- fixační symbiont rhopalodiaceanské rozsivky ". Acta Soc. Bot. Pol. 83 (4): 409–413. doi:10.5586 / asbp.2014.046. - ^ Stefan Burén a Luis M. R (2018), „Nejmodernější technologie v eukaryotickém nitrogenázovém inženýrství“, Mikrobiologické dopisy FEMS, 365 (2), doi:10.1093 / femsle / fnx274, PMC 5812491, PMID 29240940, archivováno z původního dne 2. června 2018, vyvoláno 26. listopadu 2019CS1 maint: používá parametr autoři (odkaz)
- ^ ""Problém zvyšování lidské energie „Nikola Tesla“. Archivováno z původního dne 6. června 2011. Citováno 22. června 2016.
- ^ Tesla, Nikola (1900). „Problém zvyšování lidské energie“. The Century Magazine. 60 (n.s. v. 38) (1900 květen – říjen): 175. Archivováno z původního dne 1. září 2013. Citováno 23. června 2014.
- ^ Heinrich, H .; Nevbner, Rolf (1934). „Die Umwandlungsgleichung Ba (CN)
2 → BaCN
2 + C im temperaturgebiet von 500 bis 1000 ° C " [Konverzní reakce Ba (CN)
2 → BaCN
2 + C v teplotním rozsahu od 500 do 1 000 ° C]. Z. Elektrochem. Angew. Phys. Chem. 40 (10): 693–698. doi:10,1002 / bbpc.19340401005 (neaktivní 6. listopadu 2020). Archivováno z původního dne 20. srpna 2016. Citováno 8. srpna 2016.CS1 maint: DOI neaktivní od listopadu 2020 (odkaz) - ^ Curtis, Harry Alfred (1932). Fixovaný dusík.
- ^ Vitousek, Peter M .; Aber, John; Howarth, Robert W .; Likens, Gene E .; Matson, Pamela A .; Schindler, David W .; Schlesinger, William H .; Tilman, G. David. „Lidská změna globálního cyklu dusíku: příčiny a důsledky“ (PDF). Americká agentura na ochranu životního prostředí. Archivováno (PDF) z původního dne 24. srpna 2014. Citováno 9. září 2014.
- ^ Allen, A. D .; Senoff, C. V. (1965). "Nitrogenopentammineruthenium (II) komplexy". J. Chem. Soc., Chem. Commun. (24): 621. doi:10.1039 / C19650000621.
- ^ Schrock, Richard R. (2006). „Snížení obsahu dusíku“ (PDF). PNAS. 103 (46): 17087. Bibcode:2006PNAS..10317087S. doi:10.1073 / pnas.0603633103. PMC 1859893. PMID 17088548. Archivováno (PDF) z původního dne 22. května 2018. Citováno 21. května 2018.
- ^ Brook, Michael A. (2000). Křemík v organické, organokovové a polymerní chemii. New York: John Wiley & Sons, Inc., str. 193–194.
- ^ Chatt, J .; Leigh, G. J. (1972). "Fixace dusíku". Chem. Soc. Rev. 1: 121. doi:10.1039 / cs9720100121.
- ^ A b Yandulov, Dmitry V .; Schrock, Richard R.; Rheingold, Arnold L .; Ceccarelli, Christopher; Davis, William M. (2003). „Syntéza a reakce komplexů triamidoamin molybdenu s obsahem hexaisopropylterfenylových složek“. Inorg. Chem. 42 (3): 796–813. doi:10.1021 / ic020505l. PMID 12562193.
- ^ Laplaza, Catalina E .; Cummins, Christopher C. (1995). „Štěpení dinitrogenu komplexem molybdenu se třemi souřadnicemi“. Věda. 268 (5212): 861–863. Bibcode:1995Sci ... 268..861L. doi:10.1126 / science.268.5212.861. PMID 17792182. S2CID 28465423.
- ^ Curley, John J .; Sceats, Emma L .; Cummins, Christopher C. (2006). „Cyklus pro syntézu organického nitrilu štěpením dinitrogenem“. J. Am. Chem. Soc. 128 (43): 14036–14037. doi:10.1021 / ja066090a. PMID 17061880.
- ^ Yandulov, Dmitry V .; Schrock, Richard R. (2003). „Katalytická redukce dinitrogenu na amoniak v jednom centru molybdenu“. Věda. 301 (5629): 76–78. Bibcode:2003Sci ... 301 ... 76Y. doi:10.1126 / science.1085326. PMID 12843387. S2CID 29046992.
- ^ Katalyzátor je odvozen od chlorid molybdenu (V) a tris (2-aminoethyl) amin N-substituovaný třemi objemnými hexa-isopropylterfenylovými skupinami (HIPT). Dusík přidává na konec atomu molybdenu a objemné substituenty HIPT zabraňují tvorbě stabilního a nereaktivního Mo − N = N − Mo dimer. V této izolované kapse je Mo-N
2. Dárcem protonu je a pyridinium sůl slabě koordinujícího proti aniontu. The redukční činidlo je dekametylchromocen. Veškerý vzniklý amoniak se zachytí jako HC1 sůl zachycením destilátu s roztokem HC1. - ^ Ačkoli je komplex dinitrogenů uveden v závorkách, lze tento druh izolovat a charakterizovat. Závorky neznamenají, že meziprodukt není dodržen.
- ^ Arashiba, Kazuya; Miyake, Yoshihiro; Nishibayashi, Yoshiaki (2011). „Komplex molybdenu nesoucí klešťové ligandy typu PNP vede ke katalytické redukci dinitrogenu na amoniak.“ Přírodní chemie. 3 (2): 120–125. Bibcode:2011NatCh ... 3..120A. doi:10,1038 / nchem.906. PMID 21258384.
- ^ Rebreyend, C .; de Bruin, B. (2014). „Fotolytický N
2 Rozdělení: Cesta k udržitelnosti NH
3 Výroba?". Angew. Chem. Int. Vyd. 54 (1): 42–44. doi:10,1002 / anie.201409727. PMID 25382116. - ^ Solari, E .; Da Silva, C .; Iacono, B .; Hesschenbrouck, J .; Rizzoli, C .; Scopelliti, R .; Floriani, C. (2001). „Photochemical Activation of the N≡N Bond in a Dimolybdenum-Dinitrogen Complex: Formation of a Molybdenum Nitride“. Angew. Chem. Int. Vyd. 40 (20): 3907–3909. doi:10.1002 / 1521-3773 (20011015) 40:20 <3907 :: AID-ANIE3907> 3.0.CO; 2- #. PMID 29712125.
- ^ Huss, Adam S .; Curley, John J .; Cummins, Christopher C .; Blank, David A. (2013). „Relaxace a disociace po fotoexcitaci (μ-N
2) [Mo (N [t-Bu] Ar)3]2 Meziprodukt štěpení dinitrogenu ". J. Phys. Chem. B. 117 (5): 1429–1436. doi:10.1021 / jp310122x. PMID 23249096. - ^ Kunkely, H .; Vogler, A. (2010). „Fotolýza vodných [(NH
3)5Os (μ-N
2) Os (NH
3)5]5+: Štěpení dinitrogenu intramolekulární fotoredoxní reakcí “. Angew. Chem. Int. Vyd. 49 (9): 1591–1593. doi:10.1002 / anie.200905026. PMID 20135653. - ^ Miyazaki, T .; Tanaka, H .; Tanabe, Y .; Yuki, M .; Nakajima, K .; Yoshizawa, K .; Nishibayashi, Y. (2014). „Štěpení a tvorba molekulárního dinitrogenu v jediném systému za pomoci komplexů molybdenu nesoucích ferrocenyldifosfin“. Angew. Chem. Int. Vyd. 53 (43): 11488–11492. doi:10,1002 / anie.201405673. PMID 25214300.
- ^ Broere, Daniël L. J .; Holland, Patrick L. (23. února 2018). „Sloučeniny boru bojují proti dinitrogenu. Věda. 359 (6378): 871. Bibcode:2018Sci ... 359..871B. doi:10.1126 / science.aar7395. ISSN 0036-8075. PMC 6101238. PMID 29472470.
- ^ Grist (3. října 2018). „Miliardáři a bakterie závodí, aby nás zachránili před smrtí hnojivem“. Střední. Archivováno z původního dne 17. srpna 2019. Citováno 17. srpna 2019.
externí odkazy
- Hirsch, Ann M. (2009). „Stručná historie objevu organismů vázajících dusík“ (PDF). University of California, Los Angeles.
- "Laboratoř fixace dusíku v mořích". University of Southern California.
- „Travis P. Hignett Sbírka laboratorních fotografií z výzkumu fixního dusíku // Vědecké historické ústavy digitálních sbírek“. digital.sciencehistory.org. Citováno 16. srpna 2019. Science History Institute Digitální sbírky (Fotografie zobrazující četné fáze procesu fixace dusíku a různá zařízení a přístroje používané při výrobě atmosférického dusíku, včetně generátorů, kompresorů, filtrů, termostatů a vakuových a vysokých pecí).


