Valsartan - Valsartan - Wikipedia
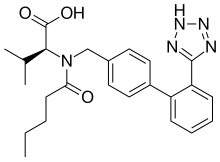 | |
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Diovan, další |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a697015 |
| Licenční údaje | |
| Těhotenství kategorie | |
| Trasy z správa | Pusou |
| Třída drog | Antagonista receptoru pro angiotenzin II |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 25% |
| Vazba na bílkoviny | 95% |
| Odstranění poločas rozpadu | 6 hodin |
| Vylučování | Ledviny 30%, žlučové 70% |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.113.097 |
| Chemické a fyzikální údaje | |
| Vzorec | C24H29N5Ó3 |
| Molární hmotnost | 435.528 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
Valsartan, prodávané pod obchodním názvem Diovan mimo jiné je lék používaný k léčbě vysoký krevní tlak, srdeční selhání, a diabetické onemocnění ledvin.[3] Jedná se o rozumnou počáteční léčbu vysokého krevního tlaku.[3] Užívá se ústy.[3] Verze jsou k dispozici jako kombinace valsartan / hydrochlorothiazid, valsartan / amlodipin, valsartan / amlodipin / hydrochlorothiazid nebo valsartan / sacubitril.[3][4]
Mezi časté nežádoucí účinky patří pocit únavy, závratě, vysoká hladina draslíku v krvi, průjem a bolesti kloubů.[3] Mezi další závažné nežádoucí účinky mohou patřit problémy s ledvinami, nízký krevní tlak, a angioedém.[3] Použití v těhotenství může poškodit dítě a používat, když kojení se nedoporučuje.[5] Je to antagonista receptoru angiotensinu II a funguje blokováním účinků angiotensin II.[3]
Valsartan byl patentován v roce 1990 a do lékařského použití se dostal v roce 1996.[6] Je k dispozici jako generické léky.[7] V roce 2017 se jednalo o 85. nejčastěji předepisovanou léčbu ve Spojených státech s více než devíti miliony receptů.[8][9]
Lékařské použití
Valsartan se používá k léčbě vysoký krevní tlak, srdeční selhání a snížit úmrtnost lidí s dysfunkce levé komory poté, co měl infarkt.[10][11]
Vysoký krevní tlak
Jedná se o rozumnou počáteční léčbu vysokého krevního tlaku ACE inhibitory, blokátory kalciových kanálů, a thiazidová diuretika.[3]
Srdeční selhání
Pokud jde o, existují protichůdné důkazy léčba lidí se srdečním selháním s kombinací blokátor receptoru angiotensinu jako valsartan a inhibitor angiotensin-konvertujícího enzymu, přičemž dvě hlavní klinické studie ukazují snížení úmrtí a dvě další nevykazují žádné výhody a více nežádoucích účinků včetně infarktu, hypotenze a renální dysfunkce.[10]
Diabetické onemocnění ledvin
U lidí s typem 2 cukrovka a vysoký krevní tlak nebo albumin v moči, valsartan se používá ke zpomalení zhoršování a rozvoje konečné onemocnění ledvin.[12]
Kontraindikace
Balení pro valsartan obsahuje varování, že lék by neměl být používán s inhibitor reninu aliskiren u lidí s diabetes mellitus. Rovněž uvádí, že droga by neměla být používána u lidí s nemoc ledvin.[11]
Valsartan spadne Úřad pro kontrolu potravin a léčiv (FDA) těhotenství kategorie D a zahrnuje a varování černé skříňky pro toxicitu pro plod.[11][5] Přerušení léčby těmito látkami se doporučuje ihned po zjištění těhotenství a měla by být zahájena alternativní léčba.[11] Americké označení nedává doporučení ohledně pokračování nebo vysazení valsartanu u kojících matek.[11] Kanadské označení nedoporučuje použití u kojících žen.[13]
Vedlejší efekty
Sazba nežádoucích účinků závisí na důvodu užívání léku.
Srdeční selhání
Míry nepříznivých účinků jsou založeny na srovnání versus placebo u lidí se srdečním selháním.[11] Mezi nejčastější nežádoucí účinky patří závrať (17% proti 9%), nízký krevní tlak (7% proti 2%) a průjem (5% proti 4%).[11] Mezi méně časté nežádoucí účinky patří bolest kloubů, únava a bolesti zad (všechny 3% proti 2%).[11]
Hypertenze
Klinické studie léčby hypertenze valsartanem versus placebo prokázaly vedlejší účinky, jako je virová infekce (3% vs 2%), únava (2% vs 1%) a bolest břicha (2% vs 1%). Mezi menší nežádoucí účinky, které se vyskytly u> 1%, ale byly podobné míře ve skupině s placebem, patří:[11]
- bolest hlavy
- závrať
- infekce horních cest dýchacích
- kašel
- průjem
- rýma /zánět vedlejších nosních dutin
- nevolnost
- zánět hltanu
- otok
- artralgie
Selhání ledvin
Lidé léčeni ARB, včetně valsartanu nebo diuretika a jsou náchylní k podmínkám rozvoje nízkého průtoku krve ledvinami, jako je abnormální zúžení cév v ledvinách, hypertenze, stenóza renální arterie, srdeční selhání, chronické onemocnění ledvin, těžké městnavé srdeční selhání nebo vyčerpání objemu jejichž funkce ledvin je částečně závislá na aktivitě systému renin-angiotensin, jako je eferentní arteriolární vazokonstrikce prováděná angiotensinem II, je vystavena vysokému riziku zhoršení funkce ledvin zahrnující akutní selhání ledvin, oligurie zhoršení azotemie nebo zvýšené sérového kreatininu.[11] Když je průtok krve ledvinami snížen, ledviny aktivují řadu reakcí, které spouštějí uvolňování angiotenzinu, aby zúžily krevní cévy a usnadnily průtok krve ledvinami.[14] Pokud je degradace nefronové funkce progresivní nebo dosáhne klinicky významné úrovně, je pozastavení nebo vysazení valsartanu oprávněné.[11][15][16][17]
Interakce
Informace o předepisování v USA uvádí následující lékové interakce pro valsartan:
- Jiné inhibitory systému renin-angiotensin mohou zvyšovat riziko nízkého krevního tlaku, problémů s ledvinami a hyperkalemie.
- Draslík šetřící diuretika, draslík doplňky, sůl náhražky obsahující draslík mohou zvyšovat riziko hyperkalemie.
- NSAID může zvýšit riziko problémů s ledvinami a může ovlivnit účinky na snížení krevního tlaku.
- Valsartan může zvyšovat koncentraci lithium.[11]
- Valsartan a další léky na krevní tlak související s angiotensinem mohou interagovat s antibiotika kotrimoxazol nebo ciprofloxacin zvýšit riziko náhlé smrti v důsledku srdeční zástava.[18]
Interakce s jídlem
S tabletou jídlo snižuje expozici uživatele valsartanu tabletám valsartanu přibližně o 40% a maximální plazmatickou koncentraci (Cmax) přibližně o 50%, o čemž svědčí změna AUC.[11]
Farmakologie
Mechanismus účinku
Valsartan blokuje působení angiotensin II, které zahrnují zúžení krevních cév a aktivaci aldosteron, ke snížení krevního tlaku.[19] Lék se váže na receptory angiotensinu typu I (AT1) a působí jako antagonista. Tento mechanismus účinku se liší od mechanismu účinku inhibitorů ACE, které blokují přeměnu angiotensinu I na angiotensin II. Protože valsartan působí na receptor, může poskytnout úplnější antagonismus angiotensinu II, protože angiotensin II je generován jinými enzymy i ACE. Valsartan také neovlivňuje metabolismus bradykininu, jako to dělají ACE inhibitory.[19]
Farmakodynamika
Farmakokinetika
Hodnoty AUC a Cmax valsartanu jsou v rozmezí terapeutických dávek přibližně lineárně závislé na dávce. Vzhledem k relativně krátkému přisuzování eliminačního poločasu se koncentrace valsartanu v plazmě nehromadí v reakci na opakované podávání.[11]
Společnost a kultura
Ekonomika
V roce 2010 dosáhl valsartan (obchodní název Diovan) ročního obratu 2,052 USD miliard ve Spojených státech a 6,053 USD miliardy na celém světě.[20] Platnost patentů na valsartan a valsartan / hydrochlorothiazid vypršela v září 2012.[21][22]
Kombinace
Valsartan je kombinován s amlodipin nebo hydrochlorothiazid (HCTZ) (nebo obojí) do formulací s jednou pilulkou pro léčbu hypertenze s více léky.[3][23][24][25] Valsartan je také k dispozici v kombinaci valsartan / sacubitril.[4][26][27] Používá se k léčbě srdečního selhání se sníženou ejekční frakcí.[27][28]
Připomíná
Dne 6. Července 2018 Evropská agentura pro léčivé přípravky (EMA) připomněla určité šarže potahovaných tablet valsartanu a valsartanu / hydrochlorothiazidu distribuovaných ve 22 zemích Evropy a Kanadě.[29] Zhejiang Huahai Pharmaceutical Co. (ZHP) v Linhai, Čína vyrobil hromadnou složku kontaminovanou N-nitrosodimethylamin (NDMA), a karcinogen.[30] The aktivní farmaceutická složka byl následně dovezen řadou výrobců generických drog, včetně Novartis a prodávány v Evropě a Asii pod jejich dceřinou společností Sandoz etiketování a ve Velké Británii Dexcel Pharma Ltd. a Accord Healthcare.[29] V Kanadě se odvolání účastní pět společností a hromadná žaloba byla zahájena soukromou právnickou firmou.[31][32] Úřady se domnívají, že míra kontaminace je zanedbatelná, a doporučují těm, kteří drogu užívají, aby se poradili s lékařem a nepřestali s užíváním léků náhle. Dne 12. července 2018 oznámila Národní agentura pro kontrolu léčiv a potravin (NA-DFC nebo Badan POM Indonésie) dobrovolné svolávání dvou produktů obsahujících valsartan vyráběných společnostmi Actavis Indonesia a Dipa Pharmalab Intersains.[33] Dne 13. července 2018 USA Úřad pro kontrolu potravin a léčiv (FDA) oznámila dobrovolné stažení určitých dodávek valsartanu a valsartan / hydrochlorothiazid v USA distribuuje Solco Healthcare LLC, Hlavní farmaceutika, a Teva Pharmaceutical Industries.[34][30] Podobné odvolání zahájilo hongkonské ministerstvo zdravotnictví.[35] Dne 2. srpna 2018 zveřejnila FDA dva zdlouhavé aktualizované seznamy, které klasifikovaly stovky konkrétních amerických produktů obsahujících valsartan do těch, které byly zahrnuty oproti vyloučeným z odvolání.[36][37] O týden později FDA citovala další dva výrobce drog, Zhejiang Tianyu Pharmaceuticals Číny a Hetero Labs Limited Indie jako další zdroje kontaminovaného valsartanu přísada.[38][37]
V září 2018 FDA oznámila, že opakovaným testováním všech dodávek valsartanu byla zjištěna druhá karcinogenní nečistota, N-nitrosodiethylamin (NDEA), u stažených produktů vyrobených společností ZHP v Číně a prodávaných v USA pod Torrent Pharmaceuticals (Indie) značka.[39]
Podle roku 2018 Reuters analýza záznamů národních agentur pro léčivé přípravky si více než 50 společností z celého světa připomnělo mono-přípravky nebo kombinované výrobky valsartanu vyrobené ze znečištěné složky valsartanu. Kontaminace je pravděpodobně přítomna od roku 2012, kdy byl změněn a schválen výrobní proces EDQM a úřady FDA. Na základě inspekcí koncem roku 2018 obě agentury pozastavily osvědčení čínského a indického výrobce o vhodnosti pro dodávky valsartanu v EU a USA[40]
V roce 2019 bylo z důvodu přítomnosti kontaminujícího NDMA odvoláno mnohem více přípravků valsartanu a jeho kombinací.[41][42]
V srpnu 2020 se Evropská agentura pro léčivé přípravky (EMA) poskytl držitelům rozhodnutí o registraci pokyny, jak zabránit přítomnosti nitrosaminových nečistot v humánních léčivých přípravcích, a požádal je, aby přezkoumali všechny chemické a biologické humánní léčivé přípravky z hlediska možné přítomnosti nitrosaminů a testovali rizikové přípravky.[43]
Nedostatky
Od července 2018 byla mnohokrát svolána losartan, valsartan a irbesartan drogové produkty způsobily značný nedostatek těchto život zachraňujících léků v Severní Americe a Evropě, zejména u valsartanu. V březnu 2019 schválila FDA pro řešení problému další obecnou verzi Diovan ™.[44] Podle agentury byl nedostatek valsartanu vyřešen dne 3. 4. 2020,[45] dostupnost generické formy však zůstala nestabilní do července 2020. Lékárnám v Evropě bylo oznámeno, že dodávky léku, zejména u vyšších dávkových forem, zůstanou nestabilní až do prosince 2020.[46]
Výzkum
U lidí se sníženou glukózovou tolerancí může valsartan snížit výskyt vývinu diabetes mellitus typu 2. Absolutní snížení rizika je však malé (méně než 1 procento ročně) a dieta, cvičení nebo jiné léky mohou mít větší ochranu. Ve stejné studii nebylo prokázáno žádné snížení výskytu kardiovaskulárních příhod (včetně úmrtí).[47]
V jedné studii u lidí bez cukrovky snížil valsartan riziko rozvoje cukrovky amlodipin, zejména u pacientů s hypertenzí.[48]
Prospektivní studie prokázala snížení výskytu a progrese Alzheimerovy choroby a demence.[49]
Reference
- ^ A b „Užívání valsartanu během těhotenství“. Drugs.com. 28. března 2019. Citováno 12. února 2020.
- ^ „Valsartan 160 mg tobolky - Souhrn údajů o přípravku (SmPC)“. (emc). 19. února 2019. Citováno 12. února 2020.
- ^ A b C d E F G h i „Valsartanská monografie pro profesionály“. Drugs.com. Americká společnost farmaceutů zdravotnického systému. Citováno 3. března 2019.
- ^ A b „Monografie Sacubitril a Valsartan pro profesionály“. Drugs.com. 7. listopadu 2019. Citováno 12. února 2020.
- ^ A b „Varování týkající se těhotenství a kojení valsartanem“. Drugs.com. Citováno 3. března 2019.
- ^ Fischer J, Ganellin CR (2006). Analogový objev drog. John Wiley & Sons. p. 470. ISBN 9783527607495.
- ^ Britské národní složení: BNF 76 (76 ed.). Pharmaceutical Press. 2018. str. 179. ISBN 9780857113382.
- ^ „Top 300 roku 2020“. ClinCalc. Citováno 11. dubna 2020.
- ^ "Valsartan - Statistika užívání drog". ClinCalc. Citováno 11. dubna 2020.
- ^ A b Randa H (2011). „Kapitola 26. Renin a angiotensin“. V Brunton LL, Chabner B, Knollmann BC (eds.). Goodman & Gilman's The Pharmacological Basis of Therapeutics (12. vydání). New York: McGraw-Hill. ISBN 978-0-07-162442-8.
- ^ A b C d E F G h i j k l m n „Diovanvalsartanová tableta“. DailyMed. 12. června 2019. Citováno 12. února 2020.
- ^ Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M a kol. (Leden 2015). „Řízení hyperglykémie u cukrovky typu 2, 2015: přístup zaměřený na pacienta: aktualizace prohlášení o postoji Americké diabetologické asociace a Evropské asociace pro studium diabetu“. Péče o cukrovku. 38 (1): 140–9. doi:10.2337 / dc14-2441. PMID 25538310.
- ^ "Monografie produktu Diovan". Databáze léčivých přípravků Health Canada. Novartis Pharmaceuticals Canada Inc.. Citováno 5. listopadu 2015.
- ^ Kumar A, Fausto A (2010). „11“. Patologické základy nemoci (8. vydání). Saunders Elsevier. p. 493. ISBN 978-1-4160-3121-5.
- ^ Smith SC, Benjamin EJ, Bonow RO, Braun LT, Creager MA, Franklin BA a kol. (Listopad 2011). „Sekundární prevence AHA / ACCF a terapie snižující riziko u pacientů s koronárními a jinými aterosklerotickými vaskulárními chorobami: aktualizace z roku 2011: směrnice American Heart Association a American College of Cardiology Foundation“. Oběh. Ovid Technologies (Wolters Kluwer Health). 124 (22): 2458–73. doi:10.1161 / cir.0b013e318235eb4d. PMID 22052934.
- ^ „Směrnice klinické praxe KDIGO 2012 pro hodnocení a zvládání chronických onemocnění ledvin“ (PDF). 3 (1). KDIGO. Leden 2013. Archivovány od originál (PDF) dne 6. února 2019. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Zar T, Graeber C, Perazella MA (7. června 2007). "Uznání, léčba a prevence toxicity propylenglykolu". Semináře v dialýze. Wiley. 20 (3): 217–9. doi:10.1111 / j.1525-139x.2007.00280.x. PMID 17555487.
- ^ Fralick M, Macdonald EM, Gomes T, Antoniou T, Hollands S, Mamdani MM a kol. (Říjen 2014). „Co-trimoxazol a náhlá smrt u pacientů užívajících inhibitory systému renin-angiotensin: populační studie“. BMJ. 349: g6196. doi:10.1136 / bmj.g6196. PMC 4214638. PMID 25359996.
- ^ A b Katzung BG, Trevor AJ (2015). „Kapitola 11“. Základní a klinická farmakologie (13 ed.). McGraw-Hill Education. ISBN 978-0071825054.
- ^ „Výroční zpráva společnosti Novartis za rok 2010“ (PDF).
- ^ Philip Moeller (29. dubna 2011). „Blockbuster Drugs that Will Go Go Generic Soon“. US News & World Report.
- ^ Eva Von Schaper (5. srpna 2011). „Jimenez společnosti Novartis má revoluční plány pro Diovana po vypršení platnosti patentu“. Bloomberg.
- ^ „Tablety přípravku Exforge - amlodipin-besylát a valsartan, potažené filmem“. DailyMed. 12. června 2019. Citováno 12. února 2020.
- ^ "Tableta Diovan HCT - valsartan a hydrochlorothiazid, potažená filmem". DailyMed. Citováno 12. února 2020.
- ^ „Tablety přípravku Exforge HCT - amlodipin-valsartan a hydrochlorothiazid, potažené filmem“. DailyMed. Citováno 12. února 2020.
- ^ "Entresto - tableta s sacubitrilem a valsartanem, potažená filmem". DailyMed. 1. září 2019. Citováno 12. února 2020.
- ^ A b Fala L (září 2015). „Entresto (Sacubitril / Valsartan): Angiotenzinový receptor prvotřídní inhibitory neprilysinu FDA schválený pro pacienty se srdečním selháním“. Ah & Db. 8 (6): 330–334. PMC 4636283. PMID 26557227.
- ^ Khalil P, Kabbach G, Said S, Mukherjee D (2018). „Entresto, nový všelék pro srdeční selhání?“. Kardiovaskulární a hematologické látky v léčivé chemii. 16 (1): 5–11. doi:10.2174/1871525716666180313121954. PMID 29532764.
- ^ A b Christensen J. „Společná droga na srdce připomínána ve 22 zemích kvůli možnému odkazu na rakovinu“. CNN. Citováno 14. července 2018.
- ^ A b Edney A, Berfield S, Yu E (12. září 2019). „Karcinogeny infiltrovaly dodávky generických drog v USA“ Bloomberg News. Citováno 17. září 2019.
- ^ „Několik léků obsahujících valsartan je odvoláváno kvůli kontaminaci potenciálním karcinogenem“. Health Canada. Citováno 15. července 2018.
- ^ „Valsartan Class Action“. valsartanclassaction.com. Citováno 15. července 2018.
- ^ „Penjelasan BPOM RI Tentang Penarikan Obat Antihipertensi Yang Mengandung Zat Aktif Valsartan“. Národní agentura pro kontrolu drog a potravin Indonéské republiky (Badan POM) (v indonéštině). Citováno 18. července 2018.
- ^ Christensen J. „FDA se připojuje ke stažení běžných léků na srdce ve 22 zemích“. CNN. Citováno 15. července 2018.
- ^ „Hongkongské ministerstvo zdravotnictví odvolává pět léků na srdce obsahujících valsartan, které byly vyrobeny v Číně“. South China Morning Post. 20. července 2018. Citováno 20. července 2018.
- ^ „Aktualizace FDA týkající se stažení valsartanu“. Úřad pro kontrolu potravin a léčiv (FDA). 2. srpna 2018. Citováno 8. srpna 2018.
- ^ A b „Aktualizace FDA a tisková oznámení týkající se stažení blokátorů receptorů pro angiotensin II (ARB) (Valsartan, Losartan a Irbesartan)“. Úřad pro kontrolu potravin a léčiv (FDA). 20. srpna 2018. Citováno 17. září 2019.
- ^ Patrice Wendling (13. srpna 2018). „Více výrobců drog označeno jako Valsartan Recall roste“. WebMD. Citováno 13. srpna 2018.
- ^ „FDA poskytuje aktuální informace o probíhajícím vyšetřování produktů valsartanu a podává zprávy o nálezu další nečistoty zjištěné u již stažených produktů jedné firmy“. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 13. září 2018. Citováno 14. září 2018.
- ^ Harney A, Hirschler B (22. srpna 2018). „Toxin v srdci vyvolávání drog ukazuje díry v lékařské záchranné síti“. Reuters. Citováno 23. listopadu 2018.
- ^ Radcliffe S, Radcliffe S (19. června 2019). „Připomeňme si léky na krevní tlak“. Healthline. Citováno 16. září 2019.
- ^ „ARB připomíná: Valsartan, Losartan a Irbesartan“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 3. února 2020. Citováno 12. února 2020.
- ^ „Nitrosaminové nečistoty“. Evropská agentura pro léčivé přípravky. 23. října 2019. Citováno 6. srpna 2020. Text byl zkopírován z tohoto zdroje, kterým je © Evropská agentura pro léčivé přípravky. Reprodukce je povolena za předpokladu, že je uveden zdroj.
- ^ Clanton, N. (13. března 2019). FDA schvaluje generické léky na krevní tlak ke zmírnění nedostatků způsobených četnými svoláváními Atlanta Journal-Constitution. Vyvolány 13 July 2020.
- ^ Aktuální a vyřešené nedostatky a přerušení léčby hlášené FDA accessdata.fda.gov. Vyvolány 13 July 2020.
- ^ Lieferengpass Valsartan-CT 160 mg . Gelbe Liste (v němčině). Pharmindex. Vyvolány 13 July 2020.
- ^ McMurray JJ, Holman RR, Haffner SM, Bethel MA, Holzhauer B, Hua TA a kol. (Duben 2010). „Vliv valsartanu na výskyt cukrovky a kardiovaskulárních příhod“. The New England Journal of Medicine. 362 (16): 1477–90. doi:10.1056 / NEJMoa1001121. hdl:2381/21817. PMID 20228403.
- ^ Kjeldsen SE, McInnes GT, Mancia G, Hua TA, Julius S, Weber MA a kol. (2008). „Progresivní účinky valsartanu ve srovnání s amlodipinem v prevenci cukrovky podle kategorií diabetogenního rizika u pacientů s hypertenzí: studie HODNOTA“. Krevní tlak. 17 (3): 170–7. doi:10.1080/08037050802169644. PMID 18608200. S2CID 3426921.
- ^ Li NC, Lee A, Whitmer RA, Kivipelto M, Lawler E, Kazis LE a kol. (Leden 2010). „Použití blokátorů receptorů pro angiotensin a riziko demence u převážně mužské populace: prospektivní kohortní analýza“. BMJ. 340: b5465. doi:10.1136 / bmj.b5465. PMC 2806632. PMID 20068258.
externí odkazy
- "Valsartan". Informační portál o drogách. Americká národní lékařská knihovna.
- „Amlodipinová směs s valsartanem“. Informační portál o drogách. Americká národní lékařská knihovna.
- „Směs amlodipin-besylátu s hydrochlorothiazidem a valsartanem“. Informační portál o drogách. Americká národní lékařská knihovna.
- „Hydrochlorothiazidová směs s valsartanem“. Informační portál o drogách. Americká národní lékařská knihovna.
- „Sacubitrilová směs s valsartanem“. Informační portál o drogách. Americká národní lékařská knihovna.
