NADPH oxidáza - NADPH oxidase
| NAD (P) H oxidáza | |
|---|---|
| Identifikátory | |
| EC číslo | 1.6.3.1 |
| Číslo CAS | 77106-92-4 |
| Databáze | |
| IntEnz | IntEnz pohled |
| BRENDA | Vstup BRENDA |
| EXPASY | Pohled NiceZyme |
| KEGG | Vstup KEGG |
| MetaCyc | metabolická cesta |
| PRIAM | profil |
| PDB struktur | RCSB PDB PDBe PDBsum |
| Železitá reduktáza | |
|---|---|
| Identifikátory | |
| Symbol | NADPH oxidáza |
| Pfam | PF01794 |
| InterPro | IPR013130 |
| TCDB | 5.B.1 |
| OPM nadčeleď | 464 |
| OPM protein | 5o05 |
NADPH oxidáza (nikotinamid adenin dinukleotid fosfát oxidáza) je vázán na membránu enzym komplex, který čelí extracelulárnímu prostoru. Nachází se v plazmatické membráně i v membránách fagozomy používá neutrofily bílých krvinek pohltit mikroorganismy. Člověk izoformy katalytické složky komplexu zahrnují NOX1, NOX2, NOX3, NOX4, NOX5, DUOX1, a DUOX2.[1]
Reakce
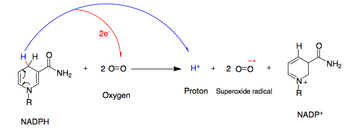
NADPH oxidáza katalyzuje produkci a superoxid volný radikál převodem jednoho elektronu do kyslík z NADPH. Během tohoto procesu O2 je transportován z extracelulárního prostoru do vnitřku buňky a H+ je exportován.
- NADPH + 2O2 ↔ NADP+ + 2O2− + H+
Biologická funkce
Komplex oxidázy NADPH za normálních okolností spí, ale je aktivován, aby se během membrán shromáždil respirační výbuch. Aktivovaná NADPH oxidáza generuje superoxid, který hraje roli v imunitní odpovědi zvířat a v rostlinné signalizaci.
Superoxid lze vyrábět v fagozomy které požily bakterie a houby, nebo může být produkován mimo buňku. Superoxid zabíjí bakterie a houby mechanismy, které dosud nejsou plně pochopeny.[2] Předpokládá se, že superoxid zabíjí bakterie přímo, protože virulence mnoha patogenů je dramaticky oslabena, když jejich superoxiddismutáza Geny (SOD) jsou odstraněny. Superoxid však může také spontánně vytvářet peroxid vodíku, který prochází dalšími reakcemi za vzniku dalších reaktivní formy kyslíku (ROS) jako kyselina chlorná (reaktivní činidlo v bělidlo ). Může také inaktivovat kritické metabolické enzymy a iniciovat peroxidace lipidů, poškození klastry železo-síra,[3] a uvolnit redox-aktivní železo, což umožňuje tvorbu nerozlišujících oxidačních činidel, jako je hydroxylový radikál.[2]
Nařízení
Pečlivá regulace aktivity NADPH oxidázy je zásadní pro udržení zdravé hladiny ROS v těle. Enzym v klidových buňkách spí, ale rychle se aktivuje několika podněty, včetně bakteriálních produktů a cytokinů.[4] Vaskulární NADPH oxidázy jsou regulovány řadou hormonů a faktorů, o nichž je známo, že jsou důležitými hráči v remodelaci a nemoci cév. Tyto zahrnují trombin, růstový faktor odvozený z krevních destiček (PDGF), faktor nekrózy nádorů (TNFa), laktozylceramid, interleukin-1 a oxiduje LDL.[5] Je také stimulován agonisty a kyselina arachidonová.[5] Naopak, montáž komplexu může být inhibována apocynin a difenylenjodonium. Apocynin snižuje chřipkou vyvolaný zánět plic u myší in vivo a tak může mít klinický přínos při léčbě chřipky.[6]
Typy
U zvířat se NADPH oxidáza nachází ve dvou typech: jeden v bílé krvinky (neutrofilní) a další v cévní buňky, lišící se biochemickou strukturou a funkcemi.[7] Neutrofilní NADPH oxidáza produkuje superoxid téměř okamžitě, zatímco vaskulární enzym produkuje superoxid během několika minut až hodin.[8] Navíc se zjistilo, že v bílých krvinkách superoxid přenáší elektrony přes membránu na extracelulární kyslík, zatímco ve vaskulárních buňkách se zdá, že radikální anion se uvolňuje hlavně intracelulárně.[9][10]
Patologie
Superoxidy mají zásadní význam při zabíjení cizích bakterií v lidském těle. Následkem toho může nedostatečná aktivita vést ke zvýšené náchylnosti k organismům, jako jsou mikroby pozitivní na katalázu, a nadměrná aktivita může vést k oxidační stres a poškození buněk.
Nadměrná produkce ROS ve vaskulárních buňkách způsobuje mnoho forem kardiovaskulárních onemocnění včetně hypertenze, ateroskleróza, infarkt myokardu, a cévní mozková příhoda.[11] Ateroskleróza je způsobena akumulací makrofágů obsahujících cholesterol (pěnové články ) ve stěnách tepny (v intima ). ROS produkované NADPH oxidázou aktivují enzym, díky kterému makrofágy ulpívají na stěně tepny (polymerací aktinových vláken). Tento proces je vyvážen inhibitory NADPH oxidázy a antioxidanty. Nerovnováha ve prospěch ROS vyvolává aterosklerózu. Studie in vitro zjistily, že inhibitory NADPH oxidázy apocynin a difenylenjodonium spolu s antioxidanty N-acetylcysteinem a resveratrolem depolymerizovaly aktin, rozbily adheze a umožnily pěnovým buňkám migrovat z intimy.[12][13]
Jedna studie naznačuje roli NADPH oxidázy v ketamin -indukovaná ztráta neuronů parvalbumin a GAD67 výraz.[14] Podobná ztráta je pozorována u schizofrenie a výsledky mohou ukazovat na NADPH oxidázu jako možného hráče v patofyziologii onemocnění.[15] Nitro modrá tetrazolium se používá v diagnostickém testu, zejména pro chronické granulomatózní onemocnění, onemocnění, při kterém je porucha NADPH oxidázy; proto fagocyt není schopen vytvářet reaktivní formy kyslíku nebo radikály potřebné pro zabíjení bakterií, což vede k prosperitě bakterií ve fagocytu. Čím vyšší je modré skóre, tím lépe buňka produkuje reaktivní formy kyslíku.
Bylo také prokázáno, že NADPH oxidáza hraje roli v mechanismu, který indukuje tvorbu sFlt-1, protein, který deaktivuje určité proangiogenní faktory, které hrají roli ve vývoji placenty, usnadněním tvorby reaktivní formy kyslíku, které jsou podezřelými zprostředkovateli při tvorbě sFlt-1. Tyto účinky jsou částečně odpovědné za vyvolání preeklampsie u těhotných žen[16]
Mutace
Mutace v genech podjednotky NADPH oxidázy způsobují několik Chronické granulomatózní nemoci (CGD), vyznačující se extrémní náchylností k infekci.[5] Tyto zahrnují:
- X-vázané chronické granulomatózní onemocnění (CGD)
- Autozomálně recesivní cytochrom b-negativní CGD
- Autosomálně recesivní cytochrom b-pozitivní CGD typu I.
- Autozomálně recesivní cytochrom b-pozitivní CGD typu II.
U těchto onemocnění mají buňky nízkou kapacitu pro fagocytózu a dochází k přetrvávajícím bakteriálním infekcím. Oblasti infikovaných buněk jsou běžné, granulomy. Podobná porucha se nazývá syndrom neutrofilní imunodeficience je spojen s mutací v RAC2, která je také součástí komplexu.
Inhibice
NADPH oxidáza může být inhibována apocynin, oxid dusnatý (NE) a difenylenjodonium. Apocynin působí tak, že brání shromažďování podjednotek NADPH oxidázy. Apocynin snižuje chřipkou vyvolaný zánět plic u myší in vivo a tak může mít klinické přínosy při léčbě chřipky.[6]
Inhibice NADPH oxidázy NO blokuje zdroj oxidačního stresu ve vaskulatuře. ŽÁDNÉ dárcovské léky (nitrovasodilatátory ) se proto používají k léčbě již více než století ischemická choroba srdeční, hypertenze, a srdeční selhání prevencí nadbytku superoxidu ve zhoršování zdravých cévních buněk.[7]
Mezi pokročilejší inhibitory NADPH oxidázy patří GKT-831 (Dříve GKT137831 ), duální inhibitor izoforem NOX4 a NOX1[17] který byl patentován v roce 2007.[18] Sloučenina byla původně vyvinuta pro Idiopatická plicní fibróza a získané lék na vzácná onemocnění označení podle FDA a EMA na konci roku 2010.[19]
Struktura
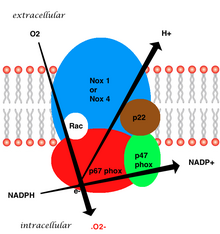
Cévní enzym vázaný na membránu se skládá z pěti částí: dvou cytosolický podjednotky (p47phox a p67phox), cytochrom b558, který se skládá z gp91phox, p22phox a malého G proteinu Rac.[7] Generování superoxidu ve vaskulárním NADPH nastává redukcí kyslíku o jeden elektron pomocí podjednotky gp91phox s použitím redukovaného NADPH jako donoru elektronů. Malý G protein má zásadní roli v aktivaci oxidázy přepínáním mezi GDP-vázanou (neaktivní) a GTP-vázanou (aktivní) formou.[20]
Neutrofilní typ
Izoforma nalezená v neutrofilech je tvořena šesti podjednotkami. Tyto podjednotky jsou:
- A Rho GTPáza, obvykle Rac1 nebo Rac2 (Rac znamená C3 související s Rho botulotoxin Podklad)
- Pět fagocytující oxidázové podjednotky:
- gp91phox (NOX2)
- p22phox (CYBA)
- p40phox (NCF4)
- p47phox (NCF1)
- str. 67phox (NCF2)
Cévní typ
Existuje několik vaskulárních izoforem komplexu, které používají paralogy podjednotky NOX2:
Typ štítné žlázy
Ve štítné žláze existují dva další paralogy podjednotky NOX2:
Reference
- ^ Sahoo, S .; Meijles, D. N .; Pagano, P. J. (2016). „NADPH oxidázy: klíčové modulátory stárnutí a kardiovaskulárních onemocnění souvisejících s věkem?“. Klinická věda. 130 (5): 317–335. doi:10.1042 / CS20150087. ISSN 0143-5221. PMC 4818578. PMID 26814203.
- ^ A b Slauch JM (květen 2011). „Jak oxidační výbuch makrofágů zabíjí bakterie? Stále otevřená otázka.“. Molekulární mikrobiologie. 80 (3): 580–3. doi:10.1111 / j.1365-2958.2011.07612.x. PMC 3109634. PMID 21375590.
- ^ Djaman O, Outten FW, Imlay JA (říjen 2004). "Oprava oxidovaných klastrů železa a síry v Escherichia coli". The Journal of Biological Chemistry. 279 (43): 44590–9. doi:10,1074 / jbc.M406487200. PMID 15308657.
- ^ Geiszt M (červenec 2006). „NADPH oxidázy: nové děti v bloku“. Kardiovaskulární výzkum. 71 (2): 289–99. doi:10.1016 / j.cardiores.2006.05.004. PMID 16765921.
- ^ A b C Griendling KK, Sorescu D, Ushio-Fukai M (březen 2000). „NAD (P) H oxidáza: role v kardiovaskulární biologii a nemoci“. Výzkum oběhu. 86 (5): 494–501. doi:10.1161 / 01.res.86.5.494. PMID 10720409.
- ^ A b Vlahos R, Stambas J, Bozinovski S, Broughton BR, Drummond GR, Selemidis S (únor 2011). „Inhibice aktivity Nox2 oxidasy zmírňuje zánět plic vyvolaný virem chřipky A“. PLoS patogeny. 7 (2): e1001271. doi:10.1371 / journal.ppat.1001271. PMC 3033375. PMID 21304882.
- ^ A b C Dusting GJ, Selemidis S, Jiang F (březen 2005). "Mechanismy pro potlačení NADPH oxidázy ve vaskulární stěně". Memorias do Instituto Oswaldo Cruz. 100 Suppl 1: 97–103. doi:10.1590 / S0074-02762005000900016. PMID 15962105.
- ^ Pagano PJ, Chanock SJ, Siwik DA, Colucci WS, Clark JK (srpen 1998). „Angiotensin II indukuje expresi mRNA p67phox a generaci superoxidu NADPH oxidázy v adventních fibroblastech králičí aorty“. Hypertenze. 32 (2): 331–7. doi:10.1161 / 01.hyp 32.2.231. PMID 9719063.
- ^ Griendling KK, Minieri CA, Ollerenshaw JD, Alexander RW (červen 1994). „Angiotensin II stimuluje aktivitu NADH a NADPH oxidázy v kultivovaných buňkách hladkého svalstva cév“. Výzkum oběhu. 74 (6): 1141–8. doi:10.1161 / 01.res.74.6.1141. PMID 8187280.
- ^ Zafari AM, Ushio-Fukai M, Akers M, Yin Q, Shah A, Harrison DG, Taylor WR, Griendling KK (září 1998). „Role NADH / NADPH oxidasy odvozené H2O2 ve vaskulární hypertrofii vyvolané angiotensinem II“. Hypertenze. 32 (3): 488–95. doi:10.1161 / 01.hyp.32.3.488. PMID 9740615.
- ^ Wattanapitayakul SK, Bauer JA (únor 2001). "Oxidační dráhy u kardiovaskulárních onemocnění: role, mechanismy a terapeutické důsledky". Farmakologie a terapeutika. 89 (2): 187–206. doi:10.1016 / S0163-7258 (00) 00114-5. PMID 11316520.
- ^ Park YM, Febbraio M, Silverstein RL (2009). „CD36 moduluje migraci myších a lidských makrofágů v reakci na oxidovaný LDL a může přispívat k zachycení makrofágů v arteriální intimě“. J Clin Invest. 119: 136–45.
- ^ Curtiss LK, Clinical, Research B (2009). „Reverzní ateroskleróza?“. N Engl J Med. 360: 1114–1116.
- ^ Behrens MM, Ali SS, Dao DN, Lucero J, Shekhtman G, Quick KL, Dugan LL (2007). „Ztráta fenotypu rychle spikujících se interneuronů vyvolaná ketaminem je zprostředkována NADPH-oxidázou“. Věda. 318 (5856): 1645–7. Bibcode:2007Sci ... 318.1645B. doi:10.1126 / science.1148045. PMID 18063801.
- ^ Tom Fagan. Souvisí oxidativní stres s NMDA a GABA hypotézami o schizofrenii? Archivováno 2007-12-30 na Wayback Machine Fórum pro výzkum schizofrenie. 9. prosince 2007.
- ^ Huang QT, Zhang M, Zhong M, Yu YH, Liang WZ, Hang LL, Gao YF, Huang LP, Wang ZJ (2013). „Pokročilé konečné produkty glykace jako upstream molekula spouští produkci sFlt-1 vyvolanou ROS v extravilózních trofoblastech: nový most mezi oxidačním stresem a preeklampsií“. Placenta. 34: 1177–1182. doi:10.1016 / j.placenta.2013.09.017.
- ^ Aoyama, Tomonori; Paik, Yong-Han; Watanabe, Sumio; Laleu, Benoît; Gaggini, Francesca; Fioraso-Cartier, Laetitia; Molango, Sophie; Heitz, Freddy; Merlot, Cédric (01.12.2012). „Nikotinamid adenin dinukleotid fosfát oxidáza v experimentální fibróze jater: GKT137831 jako nové potenciální terapeutické činidlo“. Hepatologie. 56 (6): 2316–2327. doi:10,1002 / hep. 25938. ISSN 1527-3350. PMC 3493679. PMID 22806357.
- ^ „Espacenet - bibliografická data“. celosvětově.espacenet.com. Citováno 2017-05-04.
- ^ „FDA uděluje Genkyotex Orphan Drug Označení GKT137831 pro IPF - Genkyotex S.A.“ pauahosting.co.nz. Citováno 2017-05-04.[trvalý mrtvý odkaz ]
- ^ Heyworth PG, Knaus UG, Settleman J, Curnutte JT, Bokoch GM (listopad 1993). "Regulace aktivity NADPH oxidázy proteiny aktivujícími Rac GTPázu". Molekulární biologie buňky. 4 (11): 1217–23. doi:10,1091 / mbc.4.11.1217. PMC 275755. PMID 8305740.
externí odkazy
- NADPH + oxidáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- ES 1.6.3.1
