Mandelonitril lyáza - Mandelonitrile lyase
| mandelonitril-lyáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 4.1.2.10 | ||||||||
| Číslo CAS | 9024-43-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a mandelonitril-lyáza (ES 4.1.2.10, (R) -HNL, (R) -oxynitriláza, (R) -hydroxynitril lyáza) je enzym že katalyzuje the chemická reakce
- mandelonitril kyanovodík + benzaldehyd
Tento enzym tedy jeden má Podklad, mandelonitril a dva produkty, kyanovodík a benzaldehyd.
Tento enzym patří do rodiny lyázy, konkrétně aldehyd-lyázy, které štěpí vazby uhlík-uhlík. The systematické jméno této třídy enzymů je mandelonitril benzaldehyd-lyáza (tvořící kyanovodík). Mezi další běžně používaná jména patří hydroxynitril-lyáza, (R) -oxynitriláza, oxynitriláza, D-oxynitriláza, D-alfa-hydroxynitril lyáza, a mandelonitril benzaldehyd-lyáza. Tento enzym se účastní metabolismus kyanoaminokyselin. Má 2 kofaktory: flavin, a flavoprotein.
Historická perspektiva
Mandelonitrilové lyázy, které se více familiárně označují jako HNL (hydroxynitrilové lyázy), byly poprvé charakterizovány Wöhlerem v roce 1938 na základě jejich vysoké aktivity v mandlích.[1] Od té doby byly HNL izolovány z široké škály rostlin včetně peckovin,[2] zrna čiroku,[3] mnohonožky,[4] a mučenky.[5]
HNL jsou zvláštní v tom, že ve stejném organismu a dokonce ve stejném vzorku existuje celá řada různých izoformy tohoto enzymu. Tyto izoformy nelze navzájem určit na základě faktorů ovlivňujících aktivitu.[6] Tato odrůda také vyplývá z makro-heterogenity, protože některé izoformy se vážou FAD na svém N-konci, zatímco ostatní nejsou schopni vázat FAD. Rozumí se, že tomu tak je, protože N-koncový záhyb je oblast, o které je známo, že podle potřeby váže FAD kofaktor. Zvláštní je také to, že FAD nehraje v aktivním místě žádnou pozorovanou roli oxidačně-redukční reakce tohoto enzymu.[1] Ty HNL, které vážou FAD, tak činí v hydrofobní oblast sousedící s aktivním místem, kde se předpokládá, že vazba FAD poskytuje strukturální stabilitu, která umožňuje enzymatické působení. U těchto HNL, označovaných jako HNL třídy I (nebo HNL I), se také uvádí, že mají N-konec glykosylace a výrazná heterogenita a přítomnost izoforem ve stejném organismu. HNL třídy II (HNL II), na druhé straně, poskytují širší škálu substrátů a obecně ve prospěch (S) stereochemie, zatímco HNL I stereoselektivně produkují (R) -mandelonitril.[1]
Struktura a opatření
Kvůli jednoduchosti čištění tohoto enzymu (k dosažení homogenity postačuje 5-30násobné čištění), byly jeho biologické a biochemické analýzy velmi důkladně studovány.[1] Kromě studia mnoha izoformy v daném organismu existuje studie věnovaná porozumění HNL lokalizace, fyzická struktura enzymu a jeho aktivní místo a mechanismy, kterými je schopen zprostředkovat tuto důležitou sadu reakcí. Po čištění Černá třešeň HNL, výzkum Wu a Poultona [7] zvednutý antisérum na tyto konkrétní HNL, které byly poté použity (s koloidní zlato částice v závěsu) na Black Cherry děloha a endosperm. Zde bylo zjištěno, že HNL se drtivou většinou lokalizuje na buněčné stěny těchto vyvíjejících se rostlin.[7] V těchto regionech bylo natolik obohaceno, že bylo zaznamenáno více než 5% buněčná stěna snímky pořízené prostřednictvím Elektronová mikroskopie zobrazoval částice zlata, které byly nepřímo Značení tyto proteiny.[7]
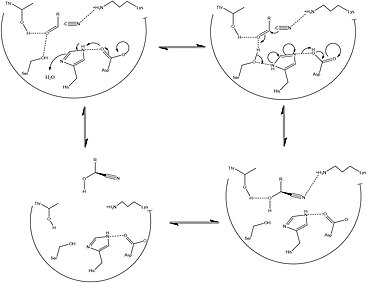
Vědět, kde je tento protein vysoce lokalizovaný, ukazuje obrázek 1 podrobnosti práce, která zdůrazňuje strukturu tohoto proteinu a zbytky v jeho aktivním místě. Specificky zajímavé je, že HNL využívají katalyticky aktivní látky Cys zbytek.[5] Zatímco Cystein zbytky jsou konzervovány u všech druhů na třech samostatných místech (v N-terminál Vazebné místo FAD a dva na C-terminál aktivní místo), zdá se, že katalyticky aktivní zbytek leží v blízkosti aktivního místa, což naznačuje důležitou roli v katalytickém působení HNL. Další strukturální prvky indikující HNL jsou rozděleny na základě jejich třídy. Zatímco je známo, že HNL třídy II jsou heterogennější a častěji se vyskytují v zrna „HNL třídy I jsou typičtější vazbou FAD a fungují jako zásobní proteiny semen. Tato akce umožňuje zvýšení metabolismus aminokyselin při vývoji semen. Protože enzym je schopen tuto reakci rychle zvrátit kyanovodík, HNL hrají zásadní roli v obraně semen[6][1]
Ke konci roku 2007 pouze jeden struktura byl pro tuto třídu enzymů vyřešen pomocí PDB přístupový kód 1JU2.
Mechanismus účinku
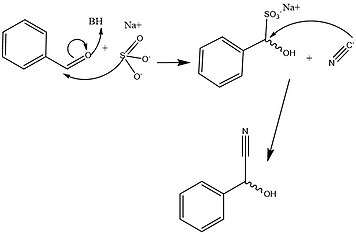
Je známo, že HNL jsou stereospecifické, což dává působení tohoto enzymu velkou výhodu v efektivním vytváření prekurzory zásadní pro metabolický vývoj aminokyseliny a širokou škálu klinicky relevantních malých molekul. Bylo však stanoveno, že široká škála organismů a izoforem, které tvoří rodinu HNL, poskytuje řadu různých mechanismy které usnadňují tuto reakci v a stereospecifické způsob. Obrázky 2 a 3 podrobně popisují typické syntetický a vyřešil biochemické mechanismy pro tvorbu tohoto klíčového metabolického meziproduktu. Klíčové rozdíly mezi těmito cestami se spoléhají hlavně na nedostatek enantiomerní specificita udělené syntetickými cestami navzdory použití podobných tříd reakce. Kromě toho většina syntetických metod pro usnadnění této sady reakcí probíhá v organické rozpouštědlo, zatímco se ukázalo, že aktivita HNL je nejvyšší při a polárně-nepolární rozhraní.[1][13]
Relevance nemoci
HNL a akce, kterou zprostředkovávají, je klíčovým cílem pro studium proteinové inženýrství, protože tvorba mandelonitrilu je klíčovým krokem v široké škále organických syntéz s lékařským a terapeutickým potenciálem. Krok zprostředkovaný těmito enzymy je nezbytný pro syntézu stereospecifické tvorba vazby v (R) -Salbutamolu bronchodilatátory,[14] (S) -amfetaminy,[14] (1R, 2S) - (-) -efedrin bronchodilatátory,[15] kromě mnoha dalších, včetně Lipitor,[16] Thalidomid,[17] a polosyntéza cefalosporin antibiotika.[18] Díky důležitosti těchto mandelonitrilových synthonů je třída HNL enzymů hlavním cílem kontrolovaných katalýza která byla optimalizována prací na rozhraní polárních a nepolárních podmínek rozpouštědla.[1][13]
Reference
- ^ A b C d E F G h Sharma, Monica; Sharma, Nitya Nand; Bhalla, Tek Chand (srpen 2005). „Hydroxynitrilové lyázy: Na rozhraní biologie a chemie“. Enzymová a mikrobiální technologie. 37 (3): 279–294. doi:10.1016 / j.enzmictec.2005.04.013.
- ^ Yemm RS, Poulton JE (1986). "Izolace a charakterizace více forem mandelonitrilové lyázy ze zralých semen černé třešně (Prunus serotina Ehrh.)". Oblouk. Biochem. Biophys. 247 (2): 440–5. doi:10.1016/0003-9861(86)90604-1. PMID 3717954.
- ^ Bovti, C., A CONN, E. E. (1961) J. Bid Cfiem 236,207-210.
- ^ Dadashipour M, Ishida Y, Yamamoto K, Asano Y (2015). „Objev a molekulární a biokatalytické vlastnosti hydroxynitril-lyázy z invazivní stonožky, Chamberlinius hualienensis“. Sborník Národní akademie věd. 112 (34): 10605–10610. Bibcode:2015PNAS..11210605D. doi:10.1073 / pnas.1508311112. PMC 4553793. PMID 26261304.
- ^ A b Nuylert A, Asano Y (2018). „Krystalová struktura a katalytický mechanismus hydroxynitril-lyázy z mučenky Passiflora edulis“. FEBS J. 285 (2): 313–324. doi:10.1111 / febs.14339. PMID 29155493.
- ^ A b Hu Z, Poulton JE (1999). "Molekulární analýza mikroheterogenity (R) - (+) - mandelonitril-lyázy v černé třešni". Plant Physiol. 119 (4): 1535–46. doi:10.1104 / pp.119.4.1535. PMC 32039. PMID 10198113.
- ^ A b C Wu H, Poulton JE (1991). „Imunocytochemická lokalizace mandelonitril-lyázy v semenech zralé černé třešně (Prunus serotina Ehrh.)“. Fyziologie rostlin. 96 (4): 1329–1337. doi:10,1104 / s. 96.4.1329. PMID 16668338.
- ^ Corson, B. B .; Dodge, R. A .; Harris, S. A .; Yeaw, J. S. (1941). „Mandelic Acid“. Organické syntézy .; Souhrnný svazek, 1, s. 336
- ^ Gruber K (2001). "Elucidace způsobu vazby substrátu na hydroxynitril lyázu z Hevea brasiliensis". Proteiny. 44 (1): 26–31. doi:10,1002 / prot.1068. PMID 11354003. S2CID 19757228.
- ^ Dreveny I, Kratky C, Gruber K (2002). "Aktivní místo hydroxynitril Layase z Prunus amydalus, modelové studie poskytují nový pohled na mechanismus cyanogeneze ". Protein Sci. 11: 293–300.
- ^ Lauble H, Miehlich B, Forster S, Wajant H, Effenberger F (2002). "Krystalová struktura hydroxynitrilové lyázy z Čirok bicolor v kombinaci s inhibitorem kyseliny benzoové, novým kyanogenním enzymem “. Biochemie. 41: 12043–12050. doi:10.1021 / bi020300o. PMID 12356304.
- ^ Lauble H, Miehlich B, Forster S, Wajant H, Effenberger (2001). "Mechanické aspekty cyanogensis z mutantu aktivního místa Ser80Ala hydroxynitrilové lyázy pro Manihot escuelenta v komplexu s acetonkyanhydrinem ". Protein Sci. 10 (5): 1015–1022. doi:10.1110 / ps.01301. PMC 2374195. PMID 11316882.
- ^ A b Wehtje E, Adlercreutz P, Mattiasson B (1990). "Tvorba vazeb C-C mandelonitril-lyázou v organických rozpouštědlech". Biotechnologie a bioinženýrství. 36 (1): 39–46. doi:10,1002 / bit. 260360106. PMID 18592607. S2CID 22377329.
- ^ A b Effenberger F, Jager J (1997). „Syntéza adregenergních bronchodilatátorů (R) -terbutalin a (R) -salbutamol z (R) -kyanohydrinů“. J. Org. Chem. 62 (12): 3867–3873. doi:10.1021 / jo970032d.
- ^ Jackson WR., Jacob HA., Matthew BR., Jayatilake GS., Watson KG. Stereoselktivní syntézy efedrinu a souvisejících 2-aminoalkoholů vysoké optické čistoty z chráněných kyanohydrinů. Tetrahedron Lett. 1990; 31: 1447-1450
- ^ Maureen AR. Biocatalysis buzz, Deals podtrhují zájem o biotechnologické metody založené na zlepšení chemických procesů. Chem Eng News 2002; 80:86
- ^ Ziegler T., Horsch B., Effenberger F., Vhodná cesta k (R) -a-hydroxykarboxylovým kyselinám a (2R) -1-amin-2-alkanolům z (R) -kyanohydrinů. Synthesis 1990: 575-578.
- ^ Menendez E., Brieva R., Rebolledo F., Gotor V. Opticky aktivní (S) keton a (R) kyanohydriny prostřednictvím (R) -oxynitrilasy katalyzované transformační chemoenzymatické syntézy 2-kyanotetrahydrofuranu a 2-kyanotetrahydropyranu. J Chem Soc, Chem Commun. 1995: 989-990
- BECKER W, BENTHIN U, ESCHENHOF E, PFEIL E (1963). „[O znalostech syntézy kyanhydrinů. II. Čištění a vlastnosti hydroxynitrilázy z hořkých mandlí (Prunus communis Stokes)]“. Biochem. Z. 337: 156–66. PMID 13970146.
- Becker W; Pfeil E (1964). „Die Darstellung kristallisierter Oxynitrilase aus bitteren Mandeln (Prunus comm. Stks)“. Naturwissenschaften. 51 (8): 193. Bibcode:1964NW ..... 51..193B. doi:10.1007 / BF00600723. S2CID 37760196.
- Gross M, Jacobs GH, Poulton JE (1982). "Rychlý a citlivý spektrofotometrický test na aktivitu prunasin hydrolázy s použitím purifikované mandelonitrilové lyázy". Anální. Biochem. 119 (1): 25–30. doi:10.1016/0003-2697(82)90660-1. PMID 6803611.
- Xu LL, Singh BK, Conn EE (1986). "Čištění a charakterizace mandelonitrilové lyázy z Prunus lyonii". Oblouk. Biochem. Biophys. 250 (2): 322–8. doi:10.1016/0003-9861(86)90733-2. PMID 3777939.
- Yemm RS, Poulton JE (1986). "Izolace a charakterizace více forem mandelonitrilové lyázy ze zralých semen černé třešně (Prunus serotina Ehrh.)". Oblouk. Biochem. Biophys. 247 (2): 440–5. doi:10.1016/0003-9861(86)90604-1. PMID 3717954.
externí odkazy
 Média související s Mandelonitril lyáza na Wikimedia Commons
Média související s Mandelonitril lyáza na Wikimedia Commons