Mechanismus Ei - Ei mechanism
The Ei mechanismus (Elimination Internal / Intramolecular), také známý jako a eliminace tepelné syn nebo a eliminace pericyklických synů, v organická chemie je speciální typ eliminační reakce ve kterém dva vicinální substituenty na alkanu rámec opustit současně cyklicky přechodový stav založit alken v syn odstranění.[1] Tento typ eliminace je jedinečný, protože je tepelně aktivován a nevyžaduje další činidla na rozdíl od běžných eliminací, které vyžadují kyselinu nebo bázi, nebo by v mnoha případech zahrnovaly nabité meziprodukty. Tento mechanismus reakce se často vyskytuje v pyrolýza.
Obecné rysy
Sloučeniny, které po zahřátí podléhají eliminaci cyklickými přechodovými stavy a nejsou přítomna žádná další činidla, dostávají označení jako Ei reakce. V závislosti na sloučenině probíhá eliminace prostřednictvím čtyř, pět nebo šestičlenného přechodového stavu.[1][2]
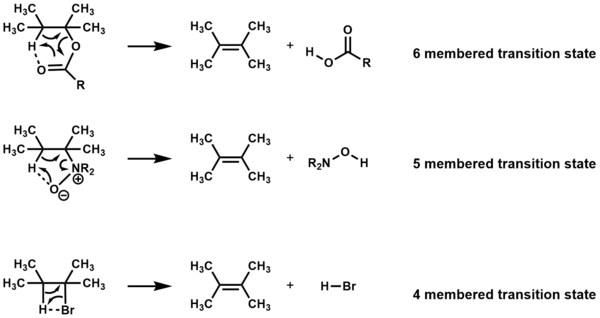
Odstranění musí být syn a atomy koplanární pro čtyř a pětičlenné přechodové stavy,[3] ale koplanárnost není vyžadováno pro šestičlenné přechodové státy.[1]
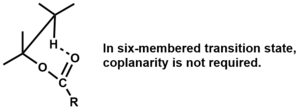
Existuje značné množství důkazů podporujících existenci E.i mechanismus, jako například: 1) kinetika z reakcí bylo zjištěno, že jsou prvního řádu,[4] 2) použití volné radikály Inhibitory neovlivnily rychlost reakcí, což naznačuje, že nejsou zahrnuty žádné radikálové mechanismy[5][6] 3) izotopové studie pro Odstranit Cope označte, že vazby C-H a C-N jsou v přechodovém stavu částečně rozbité,[7] toto také podporuje výpočty které ukazují prodloužení vazby v přechodovém stavu [8] a 4) bez zásahu jiných mechanismů, E.i mechanismus poskytuje výhradně produkty pro eliminaci syn.
Existuje mnoho faktorů, které ovlivňují složení produktu E.i reakce, ale obvykle se řídí Hofmannovým pravidlem a ztrácejí β-vodík z nejméně substituované polohy, což dává alkenu, který je méně substituovaný (opak Zaitsevovo pravidlo ).[1] Některé faktory ovlivňující složení produktu zahrnují sterické účinky, časování, a stabilita vznikajícího alkenu.
U acyklických substrátů platí Z-izomer je obvykle vedlejší produkt v důsledku destabilizace gauche interakce v přechodovém stavu, ale selektivita není obvykle vysoká.[2]

Pyrolýza N, N-dimethyl-2-fenylcyklohexylamin-N-oxid ukazuje, jak konformační účinky a stabilita přechodného stavu ovlivňují složení produktu pro cyklické substráty.[2]
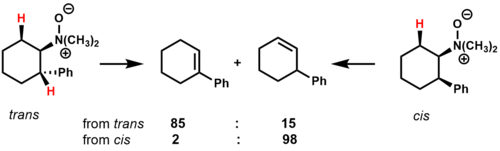
V trans izomer, jsou dva cis-β-vodíky, které mohou eliminovat. Hlavním produktem je alken, který je v konjugaci s fenylovým kruhem, pravděpodobně kvůli stabilizačnímu účinku na přechodový stav. V cis izomer, existuje pouze jeden cis-B-vodík, který může eliminovat, což dává nekonjugovaný regioizomer jako hlavní produkt.
Ester (acetát) pyrolýza
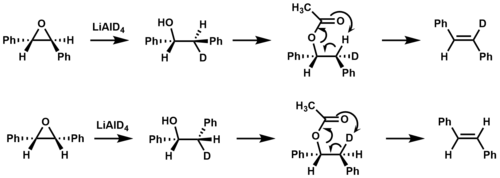
Pyrolytický rozklad estery je příkladem termální syn odstranění. Při vystavení teplotám nad 400 ° C mohou estery obsahující β-vodíky eliminovat a karboxylová kyselina prostřednictvím šestičlenného přechodového stavu, což má za následek alken.[2][6]

Izotopové značení bylo použito k potvrzení toho syn k eliminaci dochází během pyrolýzy esteru při tvorbě stilben.[9]
Na síře
Eliminace sulfoxidu
Bylo zjištěno, že β-hydroxyfenylsulfoxidy podléhají tepelné eliminaci prostřednictvím 5členného cyklického přechodného stavu, čímž se získají β-ketoestery a methylketony po tautomerizace a a kyselina sulfenová.[10]

Allylalkoholy mohou být vytvořeny z β-hydroxyfenylsulfoxidů, které obsahují β'-vodík prostřednictvím Ei mechanismus, který má tendenci dávat β, γ-nenasycení.[11]

1,3-dieny Bylo zjištěno, že vznikly zpracováním allylalkoholu arylsulfidem v přítomnosti triethylamin.[12] Nejprve se vytvoří sulfenátový ester a poté a [2,3] -sigmatropní přesmyk za vzniku allyl sulfoxidu, který podléhá tepelnému působení syn eliminací se získá 1,3-dien.

Vyloučení Chugaev
The Chugaevova eliminace je pyrolýza a xanthátový ester, což má za následek olefin.[1][13] K vytvoření esteru xanthátu, an alkohol reaguje s sirouhlík v přítomnosti báze, což vede k xanthátu kovu, který je zachycen pomocí alkylační činidlo (typicky methyljodid ). Olefin je tvořen tepelnou cestou syn eliminace β-vodíku a xanthátového esteru. Reakce je nevratná, protože výsledné vedlejší produkty, karbonylsulfid a methanthiol, jsou velmi stabilní.

Chugaevova eliminace je velmi podobná esterové pyrolýze, ale k dosažení eliminace vyžaduje výrazně nižší teploty, čímž je cenná pro náchylný k přeskupení substráty.
Burgessova dehydratační reakce
Dehydratace sekundárních a terciárních alkoholů za vzniku olefinu přes meziprodukt sulfamátového esteru se nazývá Burgessova dehydratační reakce.[13][14][15] Použité reakční podmínky jsou obvykle velmi mírné, což jim dává určitou výhodu oproti jiným dehydratačním metodám pro citlivé substráty. Tato reakce byla použita během první úplné syntézy taxol k instalaci exo-methylenové skupiny na C kruh.[16]

Nejprve alkohol vytěsní triethylamin na Burgessovo činidlo za vzniku meziproduktu sulfamátového esteru. Abstrakce β-vodíku a eliminace esteru sulfamátu prostřednictvím 6členného cyklického přechodného stavu vede k alkenu.
Eliminace thiosulfinátu
Thiosulfináty může eliminovat analogickým způsobem jako sulfoxidy. Reprezentativní je fragmentace alicin na thioakrolein, který se bude dále tvořit vinyldithiiny. Takové reakce jsou důležité v antioxidační chemii česnek a další rostliny rodu Allium.

Na základě selenu
Eliminace selenoxidu
The eliminace selenoxidu se používá při přeměně ketonů, esterů a aldehydy na jejich α, β-nenasycené deriváty.[1][17]

Mechanismus této reakce je analogický s eliminací sulfoxidu, což je tepelná reakce syn eliminace prostřednictvím 5členného cyklického přechodového stavu. Selenoxidy jsou preferovány pro tento typ transformace před sulfoxidy kvůli jejich zvýšené reaktivitě vůči β-eliminaci, v některých případech umožňuje eliminaci probíhat při teplotě místnosti.[2]
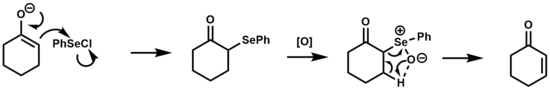
The kyselina areneselenová generované po eliminačním kroku je v rovnováze s difenyldiselenid které mohou reagovat s olefiny za vzniku β-hydroxy selenidů za kyselých nebo neutrálních podmínek. Za základních podmínek je tato vedlejší reakce potlačena.[18]
Odstranění grieka
Dehydratace primárního alkoholu v jedné nádobě za vzniku alkenu prostřednictvím Ó-nitrofenyl selenoxidový meziprodukt se nazývá Grieco eliminace.[19][20]

Reakce začíná tvorbou selenofosfoniové soli, která reaguje s alkoholem za vzniku oxafosfoniové soli. Arylselenium anion vytěsňuje tributylfosfin oxid za vzniku druhů alkyl aryl selenid. Selenid se poté zpracuje s přebytkem peroxidu vodíku, což vede k selenoxidu, který eliminuje p-vodík prostřednictvím 5členného cyklického přechodného stavu, čímž se získá alken.
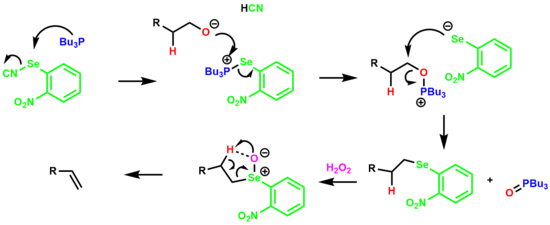
The výběr elektronů nitroskupina Bylo zjištěno, že zvyšuje jak rychlost eliminace, tak konečný výtěžek olefinu.
Na základě dusíku
Eliminace Cope
The Odstranit Cope (Copeova reakce) je eliminace terciárního aminoxid za vzniku alkenu a a hydroxylamin přes Ei mechanismus.[13][21] Eliminace Cope byla použita při syntéze mannopyranosylaminu napodobujícího.[22] Terciární amin byl oxidován na aminoxid pomocí m-chlorperoxybenzoová kyselina (mCPBA) a tepelně vystaveny vysokým teplotám syn eliminace β-vodíku a aminoxidu cyklickým přechodovým stavem, čímž se získá alken. Stojí za zmínku, že uvedený vodík (zeleně) je jediný dostupný vodík syn odstranění.

Cyklické aminoxidy (5, 7-10členné kruhy obsahující dusík) mohou také podstoupit vnitřní syn eliminace za vzniku acyklických hydroxylaminů obsahujících terminální alkeny.[13]
Zvláštní případy pro eliminaci Hofmann
Mechanismus pro Hofmannova eliminace je obecně E2, ale může projít E.i cesta za určitých okolností. U některých stéricky bráněných molekul báze deprotonuje methylovou skupinu na aminu namísto přímého β-vodíku a vytváří ylid meziprodukt, který eliminuje trimethylamin přes 5členný přechodný stav, čímž se vytvoří alken. Studie označování deuteria potvrdily tento mechanismus pozorováním tvorby deuterovaného trimethylaminu (a žádné deuterované vody, která by se vytvořila z mechanismu E2).[23]
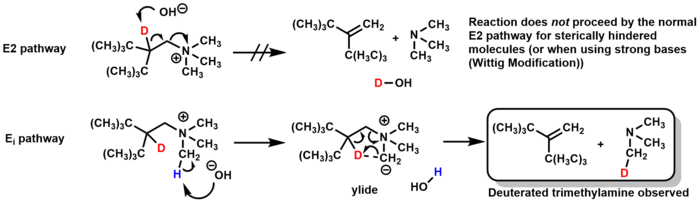
Wittigova modifikovaná Hofmannova eliminace prochází stejným Ei mechanismus, ale místo použití oxid stříbrný a voda jako báze, Wittigova modifikace používá silné báze jako alkylithia nebo KNH2 / kapalný NH3.[24][25]
Eliminace jodoso
Sekundární a terciární alkyljodidy se skupinami silně přitahujícími elektrony na α-uhlík bylo zjištěno, že podstoupily pericyklickou reakci syn eliminace při vystavení m-chlorperbenzoová kyselina (mCPBA).[26] Předpokládá se, že reakce prochází jodoso meziproduktem před syn eliminace kyselina jodovodíková.

Rozsah této reakce nezahrnuje primární alkyljodidy, protože jodoso meziprodukt se přeskupuje na hypojoditový meziprodukt, který se za reakčních podmínek převádí na alkohol. Skupiny silně přitahující elektrony potlačují dráhu přesmyku a umožňují pericyklickou reakci syn eliminační cesta převládat.
Reference
- ^ A b C d E F March, Jerry (2007). Pokročilá organická chemie (6. vydání). New York: Wiley. ISBN 0471720917.
- ^ A b C d E Carey, F. A .; Sunburg, R. J. Advanced Organic Chemistry: Reaction and Synthesis, 5. vydání .; Část B; Springer: New York, 2010
- ^ Branko, J. (1997). "Teoretické studie termální syn eliminační reakce organických aminoxidů, sulfoxidů a fosfoxidů metodami ab initio a hustoty". Theo. Chem. 389 257-263.
- ^ O’Connor, G.L .; Nace, H. R. (1953). „Další studie o Chugaevově reakci a souvisejících reakcích“. J. Am. Chem. Soc. 75 2118-.
- ^ Barton, D.H.R .; Head, A.J .; Williams, R.J. (1953). "Stereospecificita v reakcích tepelné eliminace. Část III. Pyrolýza (-) - menthylbenzoátu". J. Chem Soc. 453 1715- .
- ^ A b Anslyn, E. V .; Dougherty, D. A. Moderní fyzikální organická chemieMurdzek, J., ed. University Science Books, 2006.
- ^ Wright, D.R .; Sims, L.B .; Fry, A. (1983). „Účinky kinetického izotopu uhlíku-14 a kinetické studie v syn-eliminačních reakcích (2-fenyletyl) dimethylaminoxidů“. J. Am. Chem. Soc. 105 3714-.
- ^ Kahn, S.D .; Erickson, J.A. (1994). „Teoretické studie reakcí eliminace termální syn. Relativní sazby eliminace ethyl-formátu, ethyl-xanthátu a ethyl-fosfinátu“. J. Am. Chem. Soc. 116 6271-6276.
- ^ Curtin, D.Y .; Kellom, D.B. (1953). "Eliminační a náhradní reakce dl-erythro- a dl-threo-2-deutero-1,2-difenylethanolu a derivátů". J. Am. Chem. Soc. 75 6011-.
- ^ Kinoshita, M .; Kunieda, N .; Nokami, J. (1975). "Pyrolýza B-hydroxysulfoxidů na ketony". Tetrahedron Lett. 33 2841-2844.
- ^ OKawara, R .; Ueta, K .; Nokami, J. (1978). „Pyrolýza B-hydroxysulfoxidů II. Syntéza allylalkoholů“. Tetrahedron Lett. 49 4903-4904.
- ^ Wollowitz, S .; Reich, HJ (1982). „Konverze allylalkoholů na 1,3-dieny sekvenčním sulfenát-sulfoxidem [2,3] sigmatropním přesmykem a syn eliminací“. J. Am. Chem. Soc. 104 7051-7059.
- ^ A b C d Kurti, L .; Czako, B. Strategické aplikace pojmenovaných reakcí v organické syntéze, Academic Press, 2005.
- ^ Taylor, E.A.; Penton, H. R. Jr.; Burgess, E.M. (1970). "Syntetické aplikace esterů N-karboalkoxysulfamátu". J. Am. Chem. Soc. 92 5224-5226.
- ^ Taylor, E.A.; Penton, H. R. Jr.; Burgess, E.M. (1973). „Thermal Reactions of Alkyl N-Carbomethoxysulfamate Esters“. J. Org. Chem. 38 26-.
- ^ Holton, R.A .; et al. (1994). „První celková syntéza taxolu. 2. Dokončení kruhů C a D“. J. Am. Chem. Soc. 116 1599-1600.
- ^ Lauer, R.F; Young, M.W .; Sharpless, K.B. (1973). „Reakce selenoxidů: eliminace Thermal Syn a výměna H2O-18“. Tetrahedron Lett. 22 1979-1982.
- ^ Reich, H.J .; Wollowitz, S .; Trend, J. E.; Chow, F .; Wendelborn, D.F. (1978). "Syn eliminace alkylselenoxidů. Vedlejší reakce zahrnující kyseliny selenenové. Strukturální a rozpouštědlové účinky na sazby". J. Org. Chem. 43 1697-.
- ^ Grieco, P.A .; Gilman, S .; Nishizawa, M. (1976). "Organoselenium Chemistry. Facile One-Step Synthesis of Alkyl Aryl Selenides from Alcohols". J. Org. Chem. 41 1485-.
- ^ Young, M.W .; Sharpless, B.K. (1975). „Syntéza olefinů. Zvýšení rychlosti eliminace alkyl-aryl-selenenoxidů substitučními elektrony“. J. Org. Chem. 40 947-.
- ^ Cope, A.C .; Foster, T.T .; Towle, P.H. (1949). "Tepelný rozklad aminoxidů na olefiny a dialkylhydroxylaminy". J. Am. Chem. Soc. 71 3929-.
- ^ Vasella, A .; Remen, L. (2002). „Konformačně zkreslené napodobeniny mannopyranosylaminů: inhibitory B-mannosidáz?“. Helv. Chim. Acta. 85 1118-.
- ^ Cope, A.C .; Mehta, A.S. (1963). „Mechanism of the Hofmann Elimination Reaction: an Ylide Intermediate in the Pyrolýze of the Highly Branched Quaternary Hydroxide“. J. Am. Chem. Soc. 85 1949-.
- ^ Wittig, G .; Polster, R. (1957). Ann. Chem. 102 612-.
- ^ Bach, R.D .; Bair, K.W .; Andrzejewski, D. (1972). „Wittigova modifikace Hofmannovy eliminační reakce. Důkazy pro mechanismus alfa“, beta ”. J. Am. Chem. Soc. 94 8608-.
- ^ Reich, H. J., Peake, S. L. (1978). "Hypervalentní organojodová chemie." Syn eliminace alkyl-jodoso sloučenin “. J. Am. Chem. Soc. 100 4888-.
