Adefovir - Adefovir
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Hepsera |
| AHFS /Drugs.com | Monografie |
| Těhotenství kategorie |
|
| Trasy z správa | Ústní |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 59% |
| Vazba na bílkoviny | <4% |
| Odstranění poločas rozpadu | 7,5 hodiny |
| Vylučování | Moč |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.106.235 |
| Chemické a fyzikální údaje | |
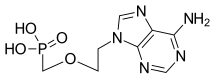
| Vzorec | C8H12N5Ó4P |
| Molární hmotnost | 273.189 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Adefovir je lék na předpis používaný k léčbě (chronických) infekcí virem hepatitidy B. Dříve byla nazývána proléčivá forma adefoviru bis-POM PMEA, s obchodními názvy Preveon a Hepsera. Je to orálně podávaný nukleotidový analog inhibitor reverzní transkriptázy (ntRTI). Lze jej formulovat jako pivoxil proléčivo adefovir dipivoxil.
Použití
Používá se k léčbě žloutenka typu B.[1][2][3][4]
Zkoušky adefoviru u pacientů s HIV neprokázaly žádné jasné výhody.[3][5]
Dějiny
Adefovir byl vynalezen v Ústavu organické chemie a biochemie, Akademie věd České republiky podle Antonín Holý a droga byla vyvinuta Gilead Sciences pro HIV se značkou Preveon. V listopadu 1999 však panel odborníků doporučil USA Úřad pro kontrolu potravin a léčiv (FDA) neschválit lék kvůli obavám o závažnost a frekvenci toxicity ledvin při dávce 60 nebo 120 mg. FDA se touto radou řídila a odmítla schválit adefovir jako léčbu HIV.
Společnost Gilead Sciences ukončila vývoj léčby HIV v prosinci 1999, pokračovala však ve vývoji léku na hepatitidu B (HBV), kde je účinná při mnohem nižší dávce 10 mg. Schválení FDA pro použití při léčbě hepatitidy B bylo uděleno 20. září 2002 a adefovir se pro tuto indikaci prodává pod značkou Hepsera. Adefovir se stal schválenou léčbou HBV v Evropské unii v březnu 2003.
Mechanismus účinku

Adefovir působí blokováním reverzní transkriptáza, enzym zásadní pro reprodukci HBV v těle. Je schválen pro léčbu chronické hepatitidy B u dospělých s prokázanou aktivní replikací virů a buď s prokázaným trvalým zvýšením séra aminotransferázy (primárně ALT) nebo histologicky aktivní onemocnění.
Hlavní přínos adefoviru nad lamivudin (první NRTI schválený pro léčbu HBV) spočívá v tom, že vývoj viru vůči němu trvá mnohem delší dobu.
Adefovir dipivoxil obsahuje dva pivaloyloxymethyl jednotek, což z něj dělá proléčivo forma adefoviru.
Reference
- ^ Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML a kol. (Únor 2003). „Adefovir-dipivoxil k léčbě hepatitidy Be antigen-pozitivní chronické hepatitidy B“. The New England Journal of Medicine. 348 (9): 808–16. doi:10.1056 / NEJMoa020681. PMID 12606735.
- ^ Manolakopoulos S, Bethanis S, Koutsounas S, Goulis J, Vlachogiannakos J, Christias E a kol. (Únor 2008). „Dlouhodobá léčba adefovir-dipivoxilem u pacientů s negativními antigeny hepatitidy B e, u nichž se vyvinula rezistence na lamivudin“. Alimentární farmakologie a terapeutika. 27 (3): 266–73. doi:10.1111 / j.1365-2036.2007.03567.x. PMID 17988233.
- ^ A b Mezinárodní řídící výbor ADHOC (říjen 2002). „Randomizovaná placebem kontrolovaná studie adefovir-dipivoxilu u pokročilé infekce HIV: studie ADHOC“. Lék proti HIV. 3 (4): 229–38. doi:10.1046 / j.1468-1293.2002.00111.x. PMID 12444940.
- ^ „Americká značka Adefovir Dipivoxil“ (PDF). FDA. duben 2013. Citováno 12. února 2017.
- ^ Fisher EJ, Chaloner K, Cohn DL, Grant LB, Alston B, Brosgart CL a kol. (Září 2001). „Bezpečnost a účinnost adefovir-dipivoxilu u pacientů s pokročilým onemocněním HIV: randomizovaná, placebem kontrolovaná studie“. AIDS. 15 (13): 1695–700. doi:10.1097/00002030-200109070-00013. PMID 11546945.
externí odkazy
- CID {{{{1}}} z PubChem
 - Adefovir dipivoxil
- Adefovir dipivoxil
