Předpřirozené geny - Proneural genes
Předpřirozené geny zakódovat transkripční faktory z základní šroubovice-smyčka-šroubovice (bHLH), kteří odpovídají za vývoj neuroektodermální progenitorové buňky. Předonální geny mají v sobě více funkcí neurální vývoj. Integrují informace o poloze a přispívají ke specifikaci identity progenitorové buňky.[1] Ze stejného ektodermální buněčné typy, se mohou vyvíjet nervové nebo epidermální buňky na základě interakcí mezi náchylnými a neurogenními geny.[2] Neurogenní geny se nazývají proto ztráta funkčních mutantů vykazují nárůst počtu vyvinutých nervových prekurzorů. Na druhou stranu mutanti náchylných genů nedokážou vyvinout neurální prekurzorové buňky.[3]
Preoneurální geny jsou exprimovány ve skupinách buněk (proneurálních shlucích), ze kterých bude vyčleněna jedna progenitorová buňka - obvykle ta uprostřed - což povede k tvorbě mnoha různých typů neurony v centrální a periferní nervové systémy.[4][5] Předpřirozené geny kódují skupinu proteinů bHLH, které hrají klíčovou roli v řízení osudu buněk v různých typech tkání.[6] Základní proteiny helix-smyčka-helix jsou charakterizovány dvěma alfa šroubovice oddělené smyčkou. Spirály zprostředkovávají dimerizace a sousední základní oblast je vyžadována pro DNA vazba.[1] The lidský genom obsahuje přibližně 125 faktorů bHLH.[7]
Objev
Preoneurální geny byly poprvé identifikovány ve 20. letech 20. století[kým? ], když mutant mouchy, kterým chyběly podmnožiny vnějších smyslových orgánů nebo štětiny byly nalezeny.[8] Později, v 70. letech, achaete-scute komplex, komplex genů, které se podílejí na regulaci počátečních kroků nervového vývoje v Drosophila, byly identifikovány[kým? ].[9] Pomocí molekulárních nástrojů bylo možné izolovat první čtyři geny tohoto komplexu: achaete (střídavý proud), scute (sc), smrtící scute (lsc) a asense (ase).[9] Další náchylný gen, atonální (ato)[10] byl izolován více nedávno[když? ] a dva ato příbuzné geny, amos a cato, byly později izolovány a definovaly druhou rodinu předonurálních genů - atonální komplex.[11] Nedávno[když? ], první homolog mouchy náchylných k genům u savců byl mash1.[4]
Seznam předpřirozených genů
Tento seznam se týká bHLH bílkoviny nalezené v bezobratlých a obratlovců. Jsou seskupeny do odlišných rodin na základě užších sekvenčních podobností v doméně bHLH:[1]
| Organismy | E-proteiny | atonální rodina | rodina nato | oligo rodina | rodina neuroD | Neurogenin rodina | achate-scute rodina | Rodina Nscl |
|---|---|---|---|---|---|---|---|---|
| bezobratlých | Bez dcery | Atonal, Amos, Cato, Lin32 | Nato3 | Biparous | CnASH, Achaete (AC), Asense (ase), Scute (sc), Smrtící scute (lsc) | |||
| obratlovců | E-12 | Math1, Math5 | Nato3 | Beta3, Beta4, Olig1, Olig2, Olig3 | NeuroD1 (NeuroD), NeuroD2 (Ndrf), NeuroD4 (Math3), NeuroD6 (Math2, Nex1) | amphioxNgn, Ngn1, Ngn2, Ngn3 | Hotovost4, Mash1, Mash2, Xash3 | Nscl1, Nscl2 |
Funkce předonálních genů
Geny ASC a Ngn rodiny, a případně členové rodiny ato homologů, mají podobnou náchylnou funkci v obratlovců k tomu jejich Drosophila protějšky, zatímco jiné neurální bHLH geny se podílejí na specifikaci neuronových osudů nebo na neuronální diferenciaci, ale nemají žádnou předpřirozenou roli.[1]
Neurální funkce
Proneurální proteiny se vážou DNA jako heterodimerní komplexy, které jsou tvořeny bHLH proteiny nebo E proteiny. Protože heterodimerizace je předpokladem pro DNA vazba, faktory, které ovlivňují dimerizace účinně působit jako pasivní represory aktivity předpřirozeného genu. Předonurální proteiny se specificky vážou DNA sekvence, které obsahují jádrový hexanukleotidový motiv, CANNTG, známý jako E-box. Základní oblast a šroubovice 1 z bHLH doména tvoří dlouhou alfa-šroubovice který je spojen s oblastí smyčky na šroubovici 2. Přímé kontakty mezi bHLH zbytky a DNA jsou zodpovědné za společnou nervovou schopnost bHLH proteiny vázat se na jádro Sekvence e-boxu.[1] Buňky v klastru, které exprimují náchylný gen (nazývané náchylný klastr), lze považovat za buňky skupiny ekvivalence. V předoneurálním klastru si buňky navzájem konkurují, takže je vybrána pouze podmnožina buněk, které se vyvinou do neuronových prekurzorů. Tento proces vyčlenění je zprostředkován interakce buňka-buňka interpretován působením neurogenních genů. v neuroectoderm, jsou vyžadovány neurogenní geny k vyčlenění buněk z předonurálních klastrů za vzniku neuronových prekurzorů, přičemž zbývající buňky předoneurálních klastrů se vyvinou do buněk epidermálních.[12] Předpřirozené geny mohou fungovat podobně obratlovců a bezobratlých, konkrétně byly zapleteny brzy neurogeneze.[13] Ačkoli spouštěcí proteiny jsou odpovědné za náchylné proteiny neurogeneze, jsou vyžadovány různé proteiny pro různé neurální a / nebo gliová buňka typy. To znamená, že každý z těchto proteinů je schopen regulovat oba běžné cílové geny pro neurogeneze a jedinečné cílové geny pro charakteristiky neuronových podtypů.[14] Předpřirozený bHLH transkripční faktory, nejen řídit neurogeneze aktivací exprese kaskády neuronových genů, ale inhibují expresi gliové geny.[15] Neurální bHLH geny mají různé funkce v závislosti na: citlivosti na boční inhibice, která určuje, zda se buňka stane epidermální nebo neuronální, a zda je gen exprimován v CNS před nebo po terminálu mitóza.[4]
Proponeální geny se podporují neurogeneze a inhibovat gliogeneze ale některé neurogenní faktory mohou regulovat oba tyto procesy, v závislosti na koncentraci náchylných genů. Například, BMP (kostní morfogenetické proteiny) podporovat neurogeneze u předků, kteří exprimují vysokou hladinu Neurogenin-1 a gliogeneze u předků, kteří exprimují nízké hladiny Neurogenin-1.[5]Gliogeneze procesy závisí na nízkých koncentracích nebo volbě náchylných genů a lze je urychlit v závislosti na tom, které náchylné geny jsou ovlivněny.[16]
U bezobratlých
v Drosophila, předpřirozené geny jsou nejprve exprimovány v klidu ektodermální buňky, které mají jak epidermální, tak neuronální potenciál. Výsledkem předonoční aktivity je výběr progenitorů, kteří se zavázali k neurálnímu osudu, ale zůstávají multipotentní, u nichž vznikají předci smyslových orgánů neurony, glia a další typy neuronových buněk. Navíc některé neuroblasty z centrální nervový systém také generovat obojí neurony a glia. Předci obvodový a centrální nervový systém teprve začněte dělit poté, co ustoupí exprese genů náchylných k genům.[1]
U obratlovců
Předonální geny jsou nejprve exprimovány v neuroepiteliálních buňkách, které jsou již specifikovány pro neurální osud a samy se obnovují. Výsledkem předpřirozené aktivity je tvorba a delaminace progenitorů, které jsou omezeny na neuronální osud a mají omezený mitotický potenciál. V některých liniích jsou přinejmenším proneurální geny zapojeny do závazku nervových předků k neuronálnímu osudu na úkor gliové osud.[1]
V procesu boční inhibice

Boční inhibice je interakce buňka-buňka který se vyskytuje v předpřirozeném shluku, aby určil a omezil buňky, které způsobují vznik neuroblast.[16] Během této interakce rodící se neuroblasty exprimují proneurální geny nad stanovenou prahovou hodnotu a současně exprimují ligand vázaný na membránu zvaný „Delta“, který se váže a aktivuje Zářez receptory exprimované v sousedních buňkách. Jednou Zářez je aktivována, aktivita predonurálních genů v těchto buňkách klesá, pravděpodobně v důsledku aktivace genů v komplexu „Enhancer split E (spl)“ kódujícího inhibičně bHLH transkripční faktory.[17] Pokud jsou inhibovány, předonální geny zabraňují tomu, aby se buňky staly neurálními, ale také snižují jejich hladinu „Delta“. Tyto konkrétní interakce omezují proneurální aktivitu na jednu buňku v každém proneurálním klastru, což vede k vzoru soli a pepře.[2][16]
Ne všechny náchylné geny jsou stejně citlivé na boční inhibice. Například v Xenopus Chitnis a Kintner prokázali, že „XASH-3“ a NeuroD (achaete-scute komplex ) reagovat odlišně boční inhibice, které odrážejí odlišnou schopnost aktivovat cílové geny a rozdílnou náchylnost těchto cílových genů k represi pomocí zářez.[16] Zadní studie ukázaly, že i když Signální dráha Notch / Delta je blokován, Wnt2b je schopen inhibovat neuronovou diferenciaci prostřednictvím downregulace z mRNA exprese více náchylných genů a také Zářez 1. S tímto mechanismem Wnt2b udržuje nediferencované progenitorové buňky tlumením exprese predonurálních a neurogenních genů, brání buňkám dostat se do diferenciační kaskády regulované předonurálními geny a Zářez.[18] Ačkoli signalizace zářezu podílí se na řízení exprese predonurálních genů, smyčky s pozitivní zpětnou vazbou jsou požadovány ke zvýšení nebo udržení úrovně náchylných genů. The transkripční faktory odpovědný za tuto údržbu může jednat prostřednictvím inhibice signální dráha zářezu zejména buňky nebo na post-transkripční úrovni, ovlivňující náchylné geny transkripce a funkce.[1]
V neurogenezi
Neurogeneze v nervovém systému bezobratlých
v bezobratlých, předpřirozené geny, zejména členové achaete-scute komplex (AS-C) propagovat neurogeneze zatímco neurogenní geny zabraňují neurogeneze a usnadnit epidermální vývoj. Formace neuroblasty závisí na tom Achaete-scute komplex geny - achaete (střídavý proud), scute (sc), smrtící scute (lsc) defektní a ventrální nervový systém („vnd“). Tento proces formování však může řídit pouze „vnd“, protože tento gen aktivuje expresi ostatních.[19][20] ac, sc, lsc faktory jsou zpočátku vyjádřeny v primordu embryonálního centrálního nervového systému (neuroectoderm ) v předpřirozených klastrech, z nichž jeden neuroblasty později vzniknou.[20] Každá buňka náchylného klastru sdílí společný potenciál tvorby neuroblastů. Místní inhibice zbývajících buněk zvětšením neuroblasty zajišťuje, že pouze jeden neuroblast vyplývá z náchylného klastru. Všechny buňky klastru si zachovávají svůj potenciál tvorby NB, alespoň zatímco se NB zvětšuje, ale tento potenciál ztrácí v době, kdy se buňka chystá rozdělit. Schémata exprese náchylných genů vedou k různým způsobům neuroblasty tvorba v hlavě a trupu. Koexprese předonurálních genů v mozek neuroblasty je přechodný a mění se podle vývojového stadia.[21]
Neurogeneze stomatogastrického nervového systému v Drosophila
Exprese předonálního genu v DNA neuroektodermální buňky, které tvoří náchylné klastry, je činí kompetentními k delaminaci jako neuroblasty. Ačkoli neuroblasty jsou předchůdci Drosophila centrální nervový systém (CNS), exprese predonurálního genu se také podílí na specifikaci kontroly a morfogeneze z stomatogastrický prekurzory nervových buněk. Tyto geny jsou exprimovány a požadovány během všech fází stomatogastrický nervový systém (SNS) k regulaci počtu, struktury a strukturních charakteristik subpopulací SNS. Správná rovnováha mezi predonurální a neurogenní genovou expresí v DNA SNS placodes se podílí na řízení složité sekvence morfogenetických pohybů (delaminace, invaginace a disociace), díky kterým tyto plakódy vedou k odlišnosti SNS subpopulace.[22]
Neurogeneze v centrálním nervovém systému obratlovců
v centrální nervový systém ne vše bHLH geny jsou zapojeny do neurogeneze protože NeuroD a rodiny „Math3 / NeuroM“ jsou také zapojeny do rozhodování o osudu neuronální versus gliové buňky. Pro vývoj malého počtu neurálních linií je nezbytná další rodina pro-neuronů (která zahrnuje „math1“ a „math5“), zatímco ve specifikaci hraje roli „math1“ interneuron identita. Typy buněk, které závisí na výrazu „“ math1 “, patří do proprioceptivní senzorická cesta.[1] Bertrand a kol. (2002) potvrdili předpřirozenou aktivitu „mash1“, ngn1 a ngn2 a případně math1 a „“ math5 “v myši.[1] Neurogeneze v centrální nervový systém závisí na inhibici náchylnosti genů pomocí Signální dráha zářezu a absence tohoto klíčového regulátoru vede k předčasné diferenciaci neurony. K udržení nervových progenitorových buněk probíhá mezi sousedními buňkami regulační smyčka, která zahrnuje boční inhibice proces (viz laterální inhibice).[23] V nepřítomnosti Boční inhibice některé předpřirozené geny jako např ASCL1 nebo „neuroG“ jsou schopny vyvolat expresi neuronově specifických genů, což vede k předčasné tvorbě časně narozených neuronů.[24] Ratié a kolegové (2013) to zahrnovali Zářez Síť předonurálních genů hraje důležitou roli při obnově a přechodu buněk u myší.[23]
Neurogeneze v periferním nervovém systému obratlovců
V periferní nervový systém, Ngns podílejí se na stanovení všech kraniálních a spinálních senzorických předků. Předpřirozené geny, jako jsou mash1, ngn1 a ngn2 jsou vyjádřeny hlavně u většiny předků viru mícha, a jsou také co-expresní v hřbetní telencephalon. Společně tyto skupiny bHLH faktory podporují vytváření všech mozková kůra předci. Mash1 je jediný gen exprimovaný ve ventrální oblasti telencephalon. Nicméně, ve ventrálních a hřbetních koncích neurální trubice je exprimován jiný typ náchylných genů, jako např ngn3 a „math1“.[1]
V gliogenezi
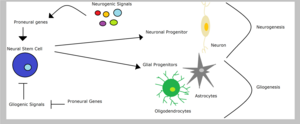
Neurální kmenové buňky může vést k vzniku neuronových nebo gliových progenitorů v závislosti na typu signálů, které dostávají - gliogenních nebo neurogenních signálů. Glial progenitorové buňky se mohly diferencovat na oligodendrocyty nebo astrocyty. Řádkový závazek neurálních předků však zahrnuje potlačení alternativních osudů. Proto, obratlovců proneurální geny podporují osud neuronů a současně inhibují gliové osudy. Například downregulace exprese predonurálního genu ngn2 v mícha potlačuje oligodendrocyt diferenciace. V kontextu omezeného gliové progenitory, předonální geny mohou mít funkce, které se liší od jejich lépe charakterizované role ve specifikaci linie, možná v diferenciaci gliové linie.[1]Sun a kolegové to ukázali předpřirozeně ngn1 inhibuje gliogeneze vazbou transkripční koaktivátory jako CBP /Smad1 nebo p300 /Smad1 zabránění transkripci glialdiferenciace geny.[15]Na druhou stranu Signální dráha zářezu je schopen propagovat gliogeneze v kmenové buňky prostřednictvím inhibice náchylných genů, jako jsou mash1 a neurogeniny.[5]
V osudu regulace buněčného cyklu
v obratlovců, i když předonální geny určují neurální osud progenitorů, také podporují zastavení jejich stadia dělení izolací již specifikovaných progenitorových buněk od vlivu vnějších znaků určujících osud. Předonální geny regulují buněčný cyklus aktivací cyklin-dependentní kináza („Cdk“) inhibitory v některých liniích na úrovni neuronálních diferenciačních genů. Na druhou stranu v bezobratlých jako Drosophila, preoneurální geny jsou exprimovány hlavně v nedělících se buňkách, ale mohly by být také exprimovány v dělících se buňkách, kde Achaete-scute komplex Bylo prokázáno, že náchylné geny inhibují buněčný cyklus postup.[1]
Při vývoji smyslových orgánů
Preoneurální geny mají také důležitou roli při vývoji odlišných typů smyslové orgány, jmenovitě chordotonální orgány (proprioceptorů detekovat mechanické a zvukové vibrace) a vnější smyslové orgány. Členové achaete-scute komplex, jako achaete a scute, jakož i „atonální“ a „„ bez dcery “ ektodermální buňky schopnost stát se smyslovými mateřskými buňkami (SMC).[6][10] Při vývoji smyslové orgány existují dvě hlavní fáze: stanovení a diferenciace, které nemusí být mechanicky oddělitelné. Proneurální proteiny jsou zapojeny do obou procesů prostřednictvím aktivace následných „diferenciačních genů“[25] které zase regulují indukci charakteristik podtypu smyslových orgánů. Specifikace smyslové orgány předpřirozenými geny je složitý proces, protože vyvolávají různé buněčné kontexty. Například v Drosophila, atonal (ato) může podporovat rozvoj chordotonální orgány, pro receptory čichové smyslové orgány, záleží na imaginární disk ve kterém je vyjádřen.[1] v Drosophila embryogeneze, předpřirozený gen achaete je vyjádřena v dobře stanovených oblastech jako v endoderm, odpovědný za formování konkrétních smyslové orgány u dospělých a larev. Podle Ruíz-Gomes a Ghysen (1993) se tato exprese vyskytuje ve dvou odlišných fázích: kompetentní stav, ve kterém je náchylný gen exprimován v buněčném shluku; stanovený stav, ve kterém určitá buňka akumuluje vysoké hladiny transkriptů „ac“ a vytváří neurální předchůdce.[26] Funkce každého z ASC komplex geny se mění s vývojovým stavem (larvy nebo dospělí).[26] Například v dospělém státě ac a sc geny podporují diferenciaci dvou sad komplementárních smyslové orgány a ase gen jako minimální funkce, zatímco ve stavu larev ac a sc geny ovlivňují stejnou sadu smyslové orgány a ase je odpovědný za stanovení doplňkové sady.[27]
V kortikogenezi
V neokortex existuje široká neuronová síť podporovaná astrocyty a oligodendrocyty (gliové buňky ) s různými funkcemi. Během kortikálního vývoje bHLH faktory řídí proliferaci a diferenciaci nervových buněk a jejich funkcí v daném čase a místě závisí na jejich buněčném kontextu. NeuroD, Ngns, Kaše „Olig“ a další rodiny genů náchylných k pohlavnímu styku hrají během rozhodování o osudu buněk zásadní roli kortikogeneze a jejich různé kombinace regulují výběr a načasování diferenciace na a neuron, an astrocyty nebo oligodendrocyt.[28]Vysoká úroveň Ngn1 a Ngn2 jsou povinni specifikovat neuronální identitu kortikálních předků pouze v raných stadiích neokortex rozvoj.[29]Zejména, ngn2 je také důležité regulovat přechod kortikálních předků z komorové zóny do subventrikulární zóna. Na druhou stranu, mash1 je zapojen do časné diferenciace striatum neurony[30] a dostatečné k podpoře dělení bazálních buněk nezávisle na jeho roli ve specifikaci osudu neuronových buněk v pozdějších stádiích. Spolupráce mezi ngn2 a mash1 preoneurální geny regulují přechod kortikálních progenitorů z apikálních do bazálních buněčných kompartmentů.[28] Specifikace různých neuronálních podtypů závisí na skupině zapojených predonurálních genů.[31] Nízká úroveň náchylnosti přepisy v komorové zóně jsou vyjádřeny, když dojde ke specifikaci předka a ke zvýšení jejich výsledků exprese na začátku neurogeneze. Ngns jsou zodpovědní za vznik glutamátergní neurony zatímco mash1 dává vzniknout GABAergický a cholinergní neurony.[31]
v Drosophila vývoj fotoreceptorů
Předběžný protein Atonal (Ato) je zodpovědný za vývoj Drosophila R8 fotoreceptory. Nepůsobí však samostatně, protože dimerizuje s druhým identickým proteinem „Daughterless (Da)“, který posiluje jeho expresi. Společná exprese „Ato“ a „Da“ je důležitá pro migraci různých typů buněk ommatidium a pro represi atonů v meziklastrových prostorech, fungující jako inhibiční signály, které regulují jak počet, tak pozici rodících se buněk R8. Navíc tento výraz vede k aktivaci kináza MAPK to je důležité pro buněčný nábor a represorový efekt, jednou, když k tomu dojde kináza je neaktivní, výraz „„ Ato “je detekován v každé buňce.[32][33] V počátečním stavu Ježek („Hh“) a Decapentaplegic jsou zodpovědní za aktivaci „ato“ v malých buněčných shlucích, což vede k aktivaci MAPK. Za prvé, Ježek indukuje výraz „ato“ ve více než jen v buňkách, které se nakonec stanou fotoreceptorové buňky, takže jeho exprese musí být vylepšena a omezena na jednu předpokládanou buňku R8. Ježková signalizace je také nutné potlačit „atonální“ výraz mezi rodícími se náchylnými klastry, což odhaluje dvojí roli zásadní pro zabudování přesnosti a geometrie do dospělého sítnice. Regulace výrazu „ato“ proto závisí na úrovních Ježek: na nízkých úrovních (to je daleko od zdroje) je tento nukleární gen aktivován a na vysokých úrovních (blízko zdroje) je potlačován. Kombinování boční inhibice s dvojí rolí, kterou hraje Ježek lze si představit, jak lze vzorovat hexagonální pole buněk R8.[33]
Neurální funkce
Kromě jejich role v nervový systém vývoje, jsou náchylné geny také zapojeny do procesů souvisejících s invaze trofoblastů, endokrinní diferenciace buněk (jmenovitě v slinivka břišní a adenohypofýza ), určení pohlaví a plíce, Štítná žláza, nadledvin a slinné vývoj žláz a gastrointestinálního systému.[34]
Při lidské invazi trofoblastů
Kromě jejich zapojení do neuronální a gliové diferenciace určení pohlaví a smyslové orgány vývoj, jsou také zapojeny predonurální geny trofoblast diferenciace během progrese invaze, v placentární formace. Studie odhalily výraz neuroD1, neuroD2 a přepisy „„ ath2 “v různých podskupinách invazivních trofoblast.[35]
Při vývoji pankreatu
Ve vyvíjejícím se slinivce břišní transkripční faktor ngn3 „Označí populace buněk, které procházejí z nediferencovaných epiteliálních progenitorových buněk do zrání endokrinní buňky (prekurzory endokrinních buněk pankreatu), a tedy neexprimují hormony přesto, což naznačuje, že tento gen je vypnutý u diferencovaných hormonálně pozitivních.[36] ngn3 „“ Je nezbytné a postačující k podpoře vzniku buňky ostrůvků během pankreatického vývoje podobným způsobem jako neurální osud u neuroectoderm.[37]
Při určování pohlaví
Ačkoli neurogeneze a určení pohlaví se zdají být různé biologické procesy, existují důkazy o tom, že „bez dcery (da“) - základní gen pro tvorbu celého Drosophila periferní nervový systém - je také vyžadováno pro správné určení pohlaví.[38] V mouchách, scute usměrňuje vývoj neuronů, ale tento gen také získal roli v primární události určení pohlaví – X chromozom počítání - tím, že se stane signálním prvkem chromozomu X (XSE).[39]
V myogenezi
Ačkoli předonální geny fungují v ektoderm, smrtelný scute působí v somatický mezoderm definovat buněčný klastr, ze kterého sval předci budou jediní.[40] Interakce mezi těmito buňkami a ektoderm, vede k tvorbě svalových zakladatelských buněk, obdobným způsobem jako ten, který se vyskytuje v centrální nervový systém.[41]
Při migraci buněk
ngn1 a ngn2 může regulovat nezávisle mechanismy migrace buněk a jsou zapojeni do iniciály downregulace z RhoA těsně předtím, než se neurální progenitorové buňky stanou postmitotickými, zatímco neuroD je primárně zapojen do nepřetržitého potlačování RhoA během kortikální migrace. jiný bHLH faktory jako „math2“, neuroD2 a „„ nscl1 ““ může potlačit RhoA expresi a regulovat migrační mechanizmy v postmitotice neurony.[42]
Reference
- ^ A b C d E F G h i j k l m n Bertrand, N; Castro, D. S .; Guillemot, F (2002). "Předpřirozené geny a specifikace typů nervových buněk". Recenze přírody Neurovědy. 3 (7): 517–30. doi:10.1038 / nrn874. PMID 12094208.
- ^ A b Kunisch, M; Haenlin, M; Campos-Ortega, J. A. (1994). „Laterální inhibice zprostředkovaná deltou neurogenního genu Drosophila je zvýšena pomocí předonálních proteinů“. Sborník Národní akademie věd Spojených států amerických. 91 (21): 10139–43. doi:10.1073 / pnas.91.21.10139. PMC 44973. PMID 7937851.
- ^ Tepass, U; Hartenstein, V (1995). "Neurogenní a náchylné geny řídí specifikaci osudu buněk v endodermu Drosophila". Rozvoj. 121 (2): 393–405. PMID 7768181.
- ^ A b C Brunet, J. F .; Ghysen, A (1999). "Dekonstrukční stanovení buněk: předonální geny a neuronální identita". BioEssays. 21 (4): 313–8. doi:10.1002 / (SICI) 1521-1878 (199904) 21: 4 <313 :: AID-BIES7> 3.0.CO; 2-C. PMID 10377893.
- ^ A b C Morrison, S. J. (2001). „Neuronální diferenciace: Předonální geny inhibují gliogenezi“. Aktuální biologie. 11 (9): R349–51. doi:10.1016 / S0960-9822 (01) 00191-9. PMID 11369245.
- ^ A b Chien, C. T .; Hsiao, C. D .; Jan, L. Y .; Jan, Y. N. (1996). „Informace o neuronovém typu kódované v doméně základní spirála-smyčka-spirála předonálních genů“. Sborník Národní akademie věd Spojených států amerických. 93 (23): 13239–44. doi:10.1073 / pnas.93.23.13239. PMC 24077. PMID 8917575.
- ^ Ledent, V; Paquet, O; Vervoort, M (2002). "Fylogenetická analýza lidských základních proteinů helix-loop-helix". Genome Biology. 3 (6): RESEARCH0030. doi:10.1186 / gb-2002-3-6-research0030. PMC 116727. PMID 12093377.
- ^ Ghysen, A; Dambly-Chaudière, C (1988). „Od DNA k formě: komplex achaete-scute“. Geny a vývoj. 2 (5): 495–501. doi:10,1101 / gad. 2.5.495. PMID 3290049.
- ^ A b González, F; Romani, S; Cubas, P; Modolell, J; Campuzano, S (1989). „Molekulární analýza asense genu, člena achaete-scute komplexu Drosophila melanogaster, a jeho nová role ve vývoji optického laloku“. Časopis EMBO. 8 (12): 3553–62. PMC 402034. PMID 2510998.
- ^ A b Jarman, A. P .; Grau, Y; Jan, L. Y .; Jan, Y. N. (1993). „Atonal je náchylný gen, který řídí tvorbu chordotonálních orgánů v periferním nervovém systému Drosophila“. Buňka. 73 (7): 1307–21. doi:10.1016 / 0092-8674 (93) 90358-w. PMID 8324823.
- ^ Goulding, S.E .; White, N.M .; Jarman, A. P. (2000). „Cato kóduje základní transkripční faktor helix-loop-helix implikovaný ve správné diferenciaci smyslových orgánů Drosophila“. Vývojová biologie. 221 (1): 120–31. doi:10,1006 / dbio.2000,9677. PMID 10772796.
- ^ Jan, Y. N .; Jan, L. Y. (1993). „HLH proteiny, neurogeneze mušek a myogeneze obratlovců“. Buňka. 75 (5): 827–30. doi:10.1016 / 0092-8674 (93) 90525-u. PMID 8252617.
- ^ Campos-Ortega, J. A. (1993). "Mechanismy časné neurogeneze u Drosophila melanogaster". Journal of Neurobiology. 24 (10): 1305–27. doi:10,1002 / neu.480241005. PMID 8228961.
- ^ Powell, L. M .; Jarman, A. P. (2008). "Kontextová závislost náchylných proteinů bHLH". Aktuální názor na genetiku a vývoj. 18 (5): 411–7. doi:10.1016 / j.gde.2008.07.012. PMC 3287282. PMID 18722526.
- ^ A b Sun, Y; Nadal-Vicens, M; Misono, S; Lin, M. Z .; Zubiaga, A; Hua, X; Ventilátor, G; Greenberg, M. E. (2001). „Neurogenin podporuje neurogenezi a inhibuje gliovou diferenciaci nezávislými mechanismy“. Buňka. 104 (3): 365–76. doi:10.1016 / S0092-8674 (01) 00224-0. PMID 11239394.
- ^ A b C d Chitnis, A; Kintner, C (1996). „Citlivost náchylných genů k boční inhibici ovlivňuje strukturu primárních neuronů v embryích Xenopus“. Rozvoj. 122 (7): 2295–301. PMID 8681809.
- ^ Schlatter, R .; Maier, D. (2005). „Zlepšovač komplexů split a Achaete-Scute drosophilidů odvozených z jednoduchých ur-komplexů konzervovaných v komářích a včelách“. BMC Evoluční biologie. 5: 67. doi:10.1186/1471-2148-5-67. PMC 1310631. PMID 16293187.
- ^ Kubo, F; Takeichi, M; Nakagawa, S (2005). „Wnt2b inhibuje diferenciaci progenitorových buněk sítnice v nepřítomnosti aktivity Notch snížením regulace exprese predonurálních genů“. Rozvoj. 132 (12): 2759–70. doi:10.1242 / dev.01856. PMID 15901663.
- ^ Skeath, J. B .; Panganiban, G. F .; Carroll, S. B. (1994). „Defektní gen ventrální nervové soustavy řídí expresi předpřirozeného genu ve dvou odlišných krocích během tvorby neuroblastů v Drosophile“. Rozvoj. 120 (6): 1517–24. PMID 8050360.
- ^ A b Skeath, J. B .; Carroll, S. B. (1992). "Regulace exprese predonurálních genů a osudu buněk během segregace neuroblastů v embryu Drosophila". Rozvoj. 114 (4): 939–46. PMID 1618155.
- ^ Urbach, R; Schnabel, R; Technau, G. M. (2003). „Vzorec tvorby neuroblastů, mitotických domén a exprese predonurálních genů během raného vývoje mozku v Drosophile“. Rozvoj. 130 (16): 3589–606. doi:10,1242 / dev.00528. PMID 12835378.
- ^ Hartenstein, V; Tepass, U; Gruszynski-Defeo, E (1996). "Specifikace kontroly předpřirozených a neurogenních genů a morfogeneze prekurzorů stomatogastrických nervových buněk v Drosophile". Vývojová biologie. 173 (1): 213–27. doi:10.1006 / dbio.1996.0018. PMID 8575623.
- ^ A b Ratié, L; Ware, M; Barloy-Hubler, F; Romé, H; Gicquel, I; Dubourg, C; David, V; Dupé, V (2013). „Nové geny jsou nadregulované, když je během vývoje hypotalamu narušena signalizace NOTCH“. Neurální vývoj. 8: 25. doi:10.1186/1749-8104-8-25. PMC 3880542. PMID 24360028.
- ^ Kageyama, R .; Ohtsuka, T .; Shimojo, H .; Imayoshi, I. (2008). "Dynamická signalizace Notch v nervových progenitorových buňkách a revidovaný pohled na laterální inhibici". Přírodní neurovědy. 11 (11): 1247–1251. doi:10.1038 / č. 2208. PMID 18956012.
- ^ Cubas, P; De Celis, J. F .; Campuzano, S; Modolell, J (1991). „Předpřirozené shluky výrazu achaete-scute a tvorba smyslových orgánů v imaginárním křídlovém disku Drosophila“. Geny a vývoj. 5 (6): 996–1008. doi:10,1101 / gad. 5.6.696. PMID 2044965.
- ^ A b Ruiz-Gómez, M; Ghysen, A (1993). „Exprese a role náchylného genu, achaete, ve vývoji larevního nervového systému Drosophila“. Časopis EMBO. 12 (3): 1121–30. PMC 413313. PMID 8458326.
- ^ Dambly-Chaudiere, C .; Ghysen, A. (1987). „Nezávislé dílčí vzory smyslových orgánů vyžadují nezávislé geny komplexu achaete-scute u larev Drosophila“. Geny a vývoj. 1 (3): 297–306. doi:10.1101 / gad.1.3.297.
- ^ A b Ross, S.E .; Greenberg, M. E.; Stiles, C. D. (2003). "Základní faktory Helix-Loop-Helix v kortikálním vývoji". Neuron. 39 (1): 13–25. doi:10.1016 / S0896-6273 (03) 00365-9. PMID 12848929.
- ^ Schuurmans, C; Armant, O; Nieto, M; Stenman, J. M .; Britz, O; Klenin, N; Brown, C; Langevin, L. M .; Seibt, J; Tang, H; Cunningham, J. M .; Dyck, R; Walsh, C; Campbell, K; Polleux, F; Guillemot, F (2004). „Sekvenční fáze kortikální specifikace zahrnují dráhy závislé na neurogeninu a nezávislé dráhy“. Časopis EMBO. 23 (14): 2892–902. doi:10.1038 / sj.emboj.7600278. PMC 514942. PMID 15229646.
- ^ Yun, K; Fischman, S; Johnson, J; Hrabe De Angelis, M; Weinmaster, G; Rubenstein, J. L. (2002). "Modulace zářezové signalizace pomocí Mash1 a Dlx1 / 2 reguluje sekvenční specifikaci a diferenciaci typů progenitorových buněk v subkortikálním telencephalonu". Rozvoj. 129 (21): 5029–40. PMID 12397111.
- ^ A b Britz, O; Mattar, P; Nguyen, L; Langevin, L. M .; Zimmer, C; Alam, S; Guillemot, F; Schuurmans, C (2006). „Role pro předurální geny při zrání kortikálních progenitorových buněk“. Mozková kůra. 16 Suppl 1: i138–51. doi:10.1093 / cercor / bhj168. PMID 16766700.
- ^ Chen, C. K.; Chien, C. T. (1999). „Negativní regulace atonů v předpřirozené tvorbě shluků fotoreceptorů Drosophila R8“. Sborník Národní akademie věd Spojených států amerických. 96 (9): 5055–60. doi:10.1073 / pnas.96.9,5055. PMC 21815. PMID 10220417.
- ^ A b Domínguez, M (1999). „Dvojí role Ježka v regulaci predonurálního genového atonu během vývoje ommatidia“. Rozvoj. 126 (11): 2345–53. PMID 10225994.
- ^ Pogoda, H. M .; von Der Hardt, S; Herzog, W; Kramer, C; Schwarz, H; Hammerschmidt, M (2006). „Preoneurální gen ascl1a je nutný pro endokrinní diferenciaci a přežití buněk v adenohypofýze zebrafish“. Rozvoj. 133 (6): 1079–89. doi:10.1242 / dev.02296. PMID 16481349.
- ^ Westerman, B. A .; Poutsma, A; Marujama, K; Schrijnemakers, H. F .; Van Wijk, I.J .; Oudejans, C. B. (2002). „Předpřirozené geny NEUROD1 a NEUROD2 jsou exprimovány během lidské invaze trofoblastů“. Mechanismy rozvoje. 113 (1): 85–90. doi:10.1016 / S0925-4773 (01) 00665-7. PMID 11900979.
- ^ Johansson, K. A .; Dursun, U .; Jordan, N .; Gu, G .; Beermann, F .; Gradwohl, G. R .; Grapin-Botton, A. (2007). „Časová kontrola aktivity neurogeninu3 u progenitorů pankreatu odhaluje okna kompetencí pro generování různých typů endokrinních buněk“. Vývojová buňka. 12 (3): 457–465. doi:10.1016 / j.devcel.2007.02.010. PMID 17336910.
- ^ Lee, J. C .; Smith, S. B .; Watada, H; Lin, J; Scheel, D; Wang, J; Mirmira, R. G .; Němec, M. S. (2001). „Regulace pankreatického pro-endokrinního genu neurogeninu3“. Cukrovka. 50 (5): 928–36. doi:10 2337 / diabetes. 50,5 928. PMID 11334435.
- ^ Cline, T. W. (1976). „Sexuálně specifický, teplotně citlivý mateřský účinek mutace Drosophila melanogaster bez dcery“. Genetika. 84 (4): 723–42. PMC 1213604. PMID 827461.
- ^ Wrischnik, L. A .; Timmer, J. R .; Megna, L. A .; Cline, T. W. (2003). „Nábor scény náchylného genu na dráhu určení pohlaví Drosophila“. Genetika. 165 (4): 2007–27. PMC 1462923. PMID 14704182.
- ^ Carmena, A; Bate, M; Jiménez, F (1995). „Lethal of scute, a proneural gen, particips in the specification of muscle progenitors during Drosophila embryogenesis“. Geny a vývoj. 9 (19): 2373–83. doi:10,1101 / gad. 9.19.2373. PMID 7557389.
- ^ Bate, C. M .; Grunewald, E. B. (1981). "Embryogeneze hmyzího nervového systému II: Druhá třída prekurzorových buněk neuronů a původ mezisegmentálních vazeb". Journal of Embryology and Experimental Morfhology. 61: 317–30. PMID 7264548.
- ^ Ge, W; On, F; Kim, K. J .; Blanchi, B; Coskun, V; Nguyen, L; Wu, X; Zhao, J; Heng, J. I .; Martinowich, K; Tao, J; Wu, H; Castro, D; Sobeih, M. M .; Corfas, G; Gleeson, J. G .; Greenberg, M. E .; Guillemot, F; Sun, Y. E. (2006). „Spojení buněčné migrace s neurogenezí pomocí náchylných faktorů bHLH“. Sborník Národní akademie věd. 103 (5): 1319–24. doi:10.1073 / pnas.0510419103. PMC 1345712. PMID 16432194.
