Di-pi-metan přesmyk - Di-pi-methane rearrangement
The di-pi-metan přesmyk je fotochemická reakce a molekulární entita který obsahuje dva π-systémy oddělené nasyceným uhlík atom (1,4-dien nebo allyl - substituovaný aromatický kruh ), za vzniku ene- (nebo aryl-) substituovaného cyklopropan. The přesmyková reakce formálně činí 1,2 posunu jedné enové skupiny (v dien ) nebo arylová skupina (v allyl-aromatickém analogu) a vazba formace mezi postranními uhlíky nemigrující skupiny.[1][2]
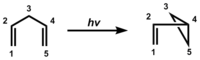
Objev a mechanismus
K tomuto přeskupení došlo původně při fotolýze barrelen dát semibullvalene.[3] Jakmile byl mechanismus uznán jako obecný Zimmerman v roce 1967 bylo jasné, že strukturální požadavek spočíval v připojení dvou pi skupin k sp3-hybridizovanému uhlíku a poté byla získána celá řada dalších příkladů. Jedním z nich byla fotolýza Mariano Compound3,3-methyl-1,1,5,5-tetrafenyl-1,4-pentadien.[4][5][6] Další byla reakce Pratt dien [7]
Rovnice 1. Mechanismus přeskupení mariánského dienu

Naproti tomu v případě přeskupení Pratt dienu existují dvě možné regiochemie - a a b. Výhodný je způsob a, protože ponechává stabilizaci benzhydrylového lichého elektronu neporušenou.
Rovnice 2. Mechanismus přeskupení Pratt dienu; všimněte si regioselektivity

Nyní je představeno barrelenové přeskupení. Je to o něco složitější než příklady Mariana a Pratta, protože existují dva sp3-hybridizované (tj. Metanové) uhlíky. Každý takový uhlík předmostí má tři (ethylenické) pi vazby, zatímco dvě jsou potřebné pro přesmyk di-pi-methanu. Další rozdíl spočívá v tom, že barrelenová reakce vyžaduje triplet vzrušený stav zatímco acyklické dienes Mariano a Pratt používali vzrušený tílko. Tím pádem aceton se používá v barrelenové reakci; aceton zachycuje světlo a poté dodává tripletovou excitaci barrelenovému reaktantu. V posledním kroku přesmyku je tzv. Spin-flip křížení mezi systémy (ISC) poskytnout spárované elektrony a nový sigma vazba.
Rovnice 3. Mechanismus transformace barrelenu na semibullvalen

Závislost úspěchu přesmyku Di-pi-methanu na multiplicitě singletu proti tripletu vychází primárně z efektu Free-Rotor [8] Triplet acyklické 1,4-dieny mohou podstoupit cis-trans interkonverze dienových dvojných vazeb (tj. volná rotace), čímž inhibuje Di-pi-metanový proces. Cis-trans izomerizace probíhá oslabením pi-vazby a následným zkroucením. Vzrušené stavy singletu se neotáčejí a poté mohou podstoupit mechanismus Di-pi-methanu. U cyklických dienů, jako je tomu v příkladu barrelenu, kruhová struktura brání cis-trans izomerizaci a může pak dojít k Di-pi-methanu .
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “přeuspořádání di-π-metanu ". doi:10.1351 / zlatá kniha D01745
- ^ Zimmerman, Howard E .; Armesto, Diego (1996). „Syntetické aspekty přesmyku di-π-metanu“. Chemické recenze. 96 (8): 3065–3112. doi:10.1021 / cr910109c. PMID 11848853.
- ^ Zimmerman, H. E.; Grunewald, G.L. (1966). „The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene“. J. Am. Chem. Soc. 88 (1): 183–184. doi:10.1021 / ja00953a045.
- ^ Zimmerman, Howard E .; Binkley, Roger W .; Givens, Richard S .; Sherwin, Maynard A. (1967). „Mechanická organická fotochemie. XXIV. Mechanismus přeměny barrelenu na semibullvalen. Obecný fotochemický proces“. Journal of the American Chemical Society. 89 (15): 3932–3933. doi:10.1021 / ja00991a064. ISSN 0002-7863.
- ^ Zimmerman, H. E.; Mariano, P. S (1969). „Di-pi-metanové přesmyky. Interakce elektronicky vzrušených vinylových chromoforů“. J. Am. Chem. Soc. 91: 1718–1727. doi:10.1021 / ja01035a021.
- ^ Hixson, Stephen S .; Mariano, Patrick S .; Zimmerman, Howard E. (1973). "Di-pi-metan a oxa-di-pi-metan přesmyky". Chemické recenze. 73 (5): 531. doi:10.1021 / cr60285a005.
- ^ Zimmerman, H. E.; Pratt, A. C (1970). „Nesymetrická substituce a směr přeuspořádání di-pi-metanu; Mechanická a průzkumná organická fotochemie. LVI“. J. Am. Chem. Soc. 92: 6259–6267. doi:10.1021 / ja00724a026.
- ^ Zimmerman, H. E.; Schissel, D. N (1986). „Di-pi-metanové přesmyky vysoce stericky přetížených molekul; Inhibice ztráty energie volným rotorem. Mechanická a průzkumná organická fotochemie“. J. Org. Chem. 51: 196–207. doi:10.1021 / jo00352a013.
