Peptidoglykanový rozpoznávací protein 1 - Peptidoglycan recognition protein 1

Peptidoglykanový rozpoznávací protein 1, PGLYRP1, také známý jako TAG7, je antibakteriální a prozánětlivé imunita protein že u lidí je kódován PGLYRP1 gen.[5][6][7][8]
Objev
PGLYRP1 byl objeven nezávisle dvěma laboratořemi v roce 1998.[5][7] Håkan Steiner a spolupracovníci pomocí diferenciální obrazovky identifikovali a naklonovali Protein pro rozpoznávání peptidoglykanů (PGRP) v můře (Trichoplusia ni ) a na základě této sekvence byly objeveny a klonovány myší a lidské PGRP ortology.[5] Sergei Kiselev a spolupracovníci objevili a klonovali protein z myši adenokarcinom se stejnou sekvencí jako myší PGRP, kterou pojmenovali Tag7.[7] Lidský PGRP byl zakládajícím členem rodiny čtyř PGRP genů nalezených u lidí, které byly pojmenovány PGRP-S, PGRP-L, PGRP-Iα a PGRP-Iβ (pro krátké, dlouhé a středně velké přepisy, analogicky k hmyzu) PGRP).[9] Jejich genové symboly byly následně změněny na PGLYRP1 (protein rozpoznávající peptidoglykany 1), PGLYRP2 (protein rozpoznávající peptidoglykany 2 ), PGLYRP3 (protein rozpoznávající peptidoglykany 3 ), a PGLYRP4 (protein rozpoznávající peptidoglykany 4 ), Výbor pro genovou nomenklaturu organizace pro lidský genom, a tato nomenklatura se v současné době používá i pro jiné savčí PGRP. V roce 2005 Roy Mariuzza a spolupracovníci krystalizovali lidský PGLYRP1 a vyřešili jeho strukturu.[10]
Distribuce a sekrece tkání
PGLYRP1 má nejvyšší úroveň exprese ze všech savčích PGRP. PGLYRP1 je vysoce konstitutivně vyjádřen v kostní dřeň[5][9][11] a v terciárních granulích z polymorfonukleární leukocyty (neutrofily a eosinofily ),[11][12][13][14][15][16] a v menší míře v aktivovaném makrofágy[15][16] a plod játra.[9] PGLYRP1 je také exprimován v laktaci prsní žláza,[17] a na mnohem nižší úroveň v epitel rohovky v oko,[18] v zanícený kůže,[19][20] slezina,[5] brzlík,[5] a v epitelové buňky v respirační[15][16] a střevní plochy.[5][21] PGLYRP1 je prominentně exprimován ve střevě Peyerovy náplasti v mikrofold (M) buňky[22][23] a je také jedním ze značek pro rozlišení Pomocník T 17 (Th17) buněk do T regulační (Treg) buňky u myší.[24] Myš PGLYRP1 je vyjádřena ve vývoji mozek a tento výraz je ovlivněn střevem mikrobiom.[25] Exprese PGLYRP1 v mozku krysy je indukována deprivací spánku[26] a v myším mozku tím ischemie.[27]
Lidský PGLYRP1 se také nachází v séru po uvolnění z leukocyty granule od exocytóza.[28][29] PGLYRP1 je v velbloudím mléce přítomen v koncentraci 120 µg / ml[17] a v granulích polymorfonukleárních leukocytů v dávce 2,9 mg / 109 buňky.[11]
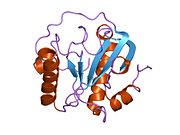
Struktura
Stejně jako u většiny PGRP má PGLYRP1 jeden karboxy-konec peptidoglykan vázající amidázovou doménu typu 2 (také známá jako doména PGRP), kterou však nemá amidáza enzymatická aktivita.[30] Tato doména PGRP se skládá ze tří alfa šroubovic, pěti beta řetězců a cívek a N-koncového segmentu (zbytky 1–30, segment specifický pro PGRP), jehož struktura se mezi PGRP podstatně liší.[10] PGLYRP1 má tři páry konzervovaných cysteiny, které tvoří tři disulfid vazby na pozicích 9 a 133, 25 a 70 a 46 a 52 v lidském PGLYRP1.[10] Disulfid Cys46 – Cys52 je v zásadě konzervován bezobratlý a obratlovců PRGP, disulfid Cys9 – Cys133 je konzervován ve všech savčích PGRP a disulfid Cys25 – Cys70 je jedinečný pro savčí PGLYRP1, PGLYRP3 a PGLYRP4, ale nebyl nalezen v amidázově aktivním PGLYRP2.[9][10] Lidský PGLYRP1 má štěpinu vázající peptidoglykany o délce 25 Å, jejíž stěny jsou tvořeny dvěma a-šroubovicemi a dno β-vrstvou.[10]
Lidský PGLYRP1 je vylučován a tvoří homodimery spojené disulfidem.[29][31] Struktura dimeru vázaného disulfidem není známa, protože byla vyřešena krystalová struktura pouze monomerního lidského PGLYRP1, protože krystalizovanému proteinu chybělo 8 N-koncových aminokyselin, včetně Cys8,[10] který se pravděpodobně podílí na tvorbě dimeru vázaného disulfidem. Potkaní PGLYRP1 je také pravděpodobné, že vytvoří dimery vázané disulfidem, protože obsahuje Cys ve stejné poloze jako Cys8 v lidském PGLYRP1,[26] zatímco myš[5] a skot[11] PGLYRP1 neobsahují tento Cys a pravděpodobně netvoří dimery spojené disulfidem.
Velbloudí PGLYRP1 může tvořit dva nedisulfidově vázané dimery: první s peptidoglykanovými vazebnými místy dvou zúčastněných molekul plně exponovaných na opačných koncích dimeru a druhý s peptidoglykanovými vazebnými místy pohřbenými na rozhraní a na opačných stranách exponovaných na koncích dimeru.[32] Toto uspořádání je pro velblouda PGLYRP1 jedinečné.[32]
PGLYRP1 je glykosylovaný a pro svou baktericidní aktivitu je vyžadována glykosylace.[31][33]
Funkce
Protein PGLYRP1 hraje důležitou roli ve vrozené imunitní odpovědi.
Vazba peptidoglykanu
PGLYRP1 se váže peptidoglykan polymer vázaný na p (1-4) N-acetylglukosamin (GlcNAc) a N-acetylmuramová kyselina (MurNAc) krátce zesítěný peptidy, hlavní složka bakteriální buněčná stěna.[5][9][12][14][34][35] Lidský PGLYRP1 váže GlcNAc-MurNAc-tripeptid s vysokou afinitou (Kd = 5,5 x 10−8 M)[14] a MurNAc-tripeptid, MurNAc-tetrapeptid a MurNAc-pentapeptid s Kd = 0,9-3,3 x 10−7 M[35] s preferencí pro kyselina mesodiaminopimelová (m-DAP) přes L-lysin -obsahující fragmenty peptidoglykanu.[35] m-DAP je přítomen ve třetí poloze peptidoglykanového peptidu v Gramnegativní bakterie a Grampozitivní bacily, zatímco L-lysin je v této poloze v peptidoglykanovém peptidu v grampozitivních kokech. Menší fragmenty peptidoglykanu se neváží nebo se váží s mnohem nižší afinitou.[14][35]
Velbloudí PGLYRP1 váže MurNAc-dipeptid s nízkou afinitou (Kd = 10−7 M)[36] a také váže bakterie lipopolysacharid s Kd = 1,6 x 10−9 M a kyselina lipoteichoová s Kd = 2,4 x 10−8 M na vazebných místech mimo kanonickou štěpinu vázající peptidoglykany s ligandy a PGLYRP1 tvořícími tetramery.[37] Takové tetramery jsou jedinečné pro velbloudí PGLYRP1 a nenacházejí se v lidském PGLYRP1 kvůli stearické zábraně.[37]
Baktericidní aktivita
Lidský PGLYRP1 je přímo baktericidní pro grampozitivní (Bacillus subtilis, Bacillus licheniformis, Lactobacillus acidophilus, Zlatý stafylokok, Streptococcus pyogenes ) a gramnegativní (Escherichia coli, Proteus vulgaris, Salmonella enterica, Shigella sonnei, Pseudomonas aeruginosa ) bakterie[12][14][31][33][38] a je také aktivní proti Chlamydia trachomatis.[39] Myš[12][13] a skot[11][28] PGLYRP1 mají antibakteriální aktivitu proti Bacillus megaterium, Staphylococcus hemolyticus, S. aureus, E-coli, a S. entericaa hovězí PGLYRP1 má také antifungální aktivitu proti Cryptococcus neoformans.[11]
V grampozitivních bakteriích se lidský PGLYRP1 váže na místa separace nově vytvořených dceřiných buněk vytvořených bakteriálními peptidoglykan-lytickými endopeptidázami, LytE a LytF v B. subtilis, které oddělují dceřiné buňky po dělení buněk.[38] Tyto endopeptidázy oddělující buňky pravděpodobně vystavují muramylové peptidy vázající PGLYRP1, jak je ukázáno společnou lokalizací PGLYRP1 a LytE a LytF v místech buněčné separace, a bez vazby PGLYRP1 na jiné oblasti buněčné stěny s vysoce zesítěným peptidoglykanem .[38] Tato lokalizace je nezbytná pro zabíjení bakterií, protože mutanti které postrádají endopeptidázy LytE a LytF a nerozdělí se po buněčném dělení, neváží se na PGLYRP1 a také nejsou snadno usmrcitelné PGLYRP1.[38] U gramnegativních bakterií (E-coli), PGLYRP1 se váže na vnější membránu.[38] U grampozitivních i gramnegativních bakterií zůstává PGLYRP1 vázán na buněčný obal a nevstupuje do cytoplazma.[38]
Mechanismus zabíjení pomocí PGLYRP1 je založen na indukci smrtelného obalového stresu a produkci reaktivní formy kyslíku v bakteriích a následné odstavení transkripce a překlad.[38] Zabíjení bakterií indukované PGLYRP1 nezahrnuje permeabilizaci buněčné membrány, což je typické pro defensiny a další antimikrobiální peptidy, hydrolýza buněčné stěny, nebo osmotický šok.[31][33][38]
Lidský PGLYRP1 má synergickou baktericidní aktivitu s lysozym[14] a antibakteriální peptidy.[33] Streptokoky produkují protein (SP1), který inhibuje antibakteriální aktivitu lidského PGLYRP1.[40]
Obrana proti infekcím
PGLYRP1 hraje omezenou roli v obraně hostitele proti infekcím. PGLYRP1-deficitní myši jsou citlivější na systémové infekce nepatogenními bakteriemi (Micrococcus luteus a B. subtilis)[13] a do P. aeruginosa-indukovaný keratitida,[18] ale ne na systémové infekce patogenními bakteriemi (S. aureus a E-coli).[13] Intravenózní podání PGLYRP1 chrání myši před systémovým podáním Listeria monocytogenes infekce.[41]
Udržování mikrobiomu
Myš PGLYRP1 hraje roli při udržování zdravého mikrobiomu, as PGLYRP1myši s deficitem mají významné změny ve složení jejich střevních a plicních mikrobiomů, které ovlivňují jejich citlivost na kolitida a zánět plic.[21][42][43]
Účinky na zánět
Myš PGLYRP1 hraje roli při udržování protizánětlivé homeostázy ve střevě, kůži, plicích, kloubech, očích a mozku. PGLYRP1-deficitní myši jsou citlivější než myši divokého typu na kolitidu indukovanou dextranem síranem sodným (DSS), což naznačuje, že PGLYRP1 chrání myši před kolitidou vyvolanou DSS.[21][42] V modelu myši z artritida PGLYRP1u deficitních myší se vyvine závažnější artritida než u divokých myší.[44] Také myši s nedostatkem obou PGLYRP1 a PGLYRP2 vyvinout závažnější artritidu než PGLYRP2-deficitní myši, které jsou odolné vůči artritidě.[44] Tyto výsledky naznačují, že PGLYRP2 podporuje artritidu a že PGLYRP1 působí proti prozánětlivému účinku PGLYRP2.[44] PGLYRP1-deficitní myši mají také poruchu rohovka hojení ran ve srovnání s myší divokého typu, což naznačuje, že PGLYRP1 podporuje hojení ran rohovky.[18]
PGLYRP1-deficitní myši jsou odolnější vůči experimentálně indukovaným myším než myši divokého typu alergický astma,[15][16] atopická dermatitida,[20] kontaktní dermatitida,[20] a psoriáza - jako zánět kůže.[19] Tyto výsledky naznačují, že myší PGLYRP1 podporuje zánět plic a kůže. Tyto prozánětlivé účinky jsou způsobeny zvýšeným počtem a aktivitou T pomocných 17 (Th17) buněk a sníženým počtem T regulačních (Treg) buněk[15][19][20] a v případě astmatu také zvýšený počet buněk T helper 2 (Th2) a snížený počet plasmacytoidní dendritické buňky.[15] Prozánětlivý účinek PGLYRP1 na astma závisí na střevním mikrobiomu regulovaném PGLYRP1, protože tato zvýšená rezistence na experimentálně vyvolané alergické astma by mohla být přenesena na divoký typ bez bakterií myší mikrobiomovou transplantací z PGLYRP1- nedostatečné myši.[43]
Cytotoxicita
Myš PGLYRP1 (Tag7) byla údajně cytotoxický pro nádorové buňky a fungovat jako a Faktor nekrózy nádorů-α (TNF-α) cytokin.[7] Následující experimenty odhalily, že PGLYRP1 (Tag7) sám o sobě nemá cytotoxickou aktivitu,[12][45] ale ten PGLYRP1 (Tag7) tvoří komplex s proteinem tepelného šoku 70 (Hsp70 ) a že pouze tyto komplexy jsou cytotoxické pro nádorové buňky,[45] zatímco PGLYRP1 (Tag7) sám o sobě působí jako antagonista cytotoxicity komplexů PGLYRP1-Hsp70.[46]
Interakce s hostitelskými proteiny a receptory
Lidský a myší PGLYRP1 (Tag7) váží protein tepelného šoku 70 (Hsp70 ) v roztoku a komplexy PGLYRP1-Hsp70 jsou také vylučovány cytotoxickými lymfocyty a tyto komplexy jsou cytotoxické pro nádorové buňky.[45][47] Tato cytotoxicita je antagonizována metastasinem (S100A4 )[48] a protein vázající tepelný šok HspBP1.[49] Komplexy PGLYRP1-Hsp70 se vážou na TNFR1 (receptor nekrotizující faktor 1, což je receptor smrti) a vyvolávají cytotoxický účinek prostřednictvím apoptóza a nekroptóza.[46] Tato cytotoxicita je spojena s permeabilizací lysozomy a mitochondrie.[50] Naproti tomu volný PGLYRP1 působí jako antagonista TNFR1 tím, že se váže na TNFR1 a inhibuje jeho aktivaci komplexy PGLYRP1-Hsp70.[46] Peptid z lidského PGLYRP1 (aminokyseliny 163-175) také inhibuje cytotoxické účinky komplexů TNF-a a PGLYRP1-Hsp70.[51]
Lidský PGLYRP1 v komplexu s peptidoglykanem nebo multimerizovaný se váže a stimuluje TREM-1 (spouštěcí receptor exprimovaný na myeloidních buňkách-1), receptor přítomný na neutrofilech, monocyty a makrofágy, které indukují produkci prozánětlivých cytokinů.[52]
Lékařský význam
Genetický PGLYRP1 varianty nebo změněná exprese PGLYRP1 jsou často spojeny s různými nemocemi. Pacienti s zánětlivé onemocnění střev (IBD), který zahrnuje Crohnova nemoc a ulcerózní kolitida, mají v systému výrazně častější varianty missense PGLYRP1 gen (a také v dalších třech PGLYRP geny) než zdravé kontroly.[53] Tyto výsledky naznačují, že PGLYRP1 chrání lidi před těmito zánětlivými chorobami a mutacemi v nich PGLYRP1 Gen patří mezi genetické faktory predisponující k těmto nemocem. PGLYRP1 varianty jsou také spojeny se zvýšeným fetální hemoglobin v srpkovitá nemoc.[54]
Několik onemocnění je spojeno se zvýšenou expresí PGLYRP1, včetně: ateroskleróza,[55][56] infarkt myokardu,[57] sepse,[58] zánětlivé tkáně u Crohnovy choroby a ulcerózní kolitidy,[59] plicní fibróza,[60] astma,[61] chronické onemocnění ledvin,[62] revmatoidní artritida,[63] zánět dásní,[64][65][66][67][68] artróza,[69] kardiovaskulární příhody a úmrtí v transplantace ledvin pacienti,[70] alopecie,[71] srdeční selhání,[72] cukrovka I. typu,[73] infekční komplikace v hemodialýza,[74] a trombóza,[75] v souladu s prozánětlivými účinky PGLYRP1. Nižší exprese PGLYRP1 byla nalezena v endometrióza.[76]
Viz také
- Peptidoglykanový rozpoznávací protein
- Peptidoglykanový rozpoznávací protein 2
- Peptidoglykanový rozpoznávací protein 3
- Peptidoglykanový rozpoznávací protein 4
- Peptidoglykan
- Vrozený imunitní systém
- Bakteriální buněčné stěny
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000008438 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000030413 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d E F G h i Kang D, Liu G, Lundström A, Gelius E, Steiner H (srpen 1998). „Protein rozpoznávající peptidoglykany s vrozenou imunitou konzervovanou před hmyzem lidem“. Sborník Národní akademie věd Spojených států amerických. 95 (17): 10078–82. Bibcode:1998PNAS ... 9510078K. doi:10.1073 / pnas.95.17.10078. PMC 21464. PMID 9707603.
- ^ "Entrez Gene: PGLYRP1 peptidoglykanový rozpoznávací protein 1".
- ^ A b C d Kiselev SL, Kustikova OS, Korobko EV, Prokhortchouk EB, Kabishev AA, Lukanidin EM, Georgiev GP (červenec 1998). "Molekulární klonování a charakterizace genu myší tag7 kódující nový cytokin". The Journal of Biological Chemistry. 273 (29): 18633–9. doi:10.1074 / jbc.273.29.18633. PMID 9660837. S2CID 11417742.
- ^ "Pglyrp1 peptidoglykanový rozpoznávací protein 1 [Mus musculus (domácí myš)] - gen - NCBI". www.ncbi.nlm.nih.gov. Citováno 2020-11-03.
- ^ A b C d E Liu C, Xu Z, Gupta D, Dziarski R (září 2001). "Peptidoglykanové rozpoznávací proteiny: nová rodina čtyř molekul pro rozpoznávání vzorů lidské vrozené imunity". The Journal of Biological Chemistry. 276 (37): 34686–94. doi:10,1074 / jbc.M105566200. PMID 11461926. S2CID 44619852.
- ^ A b C d E F Guan R, Wang Q, Sundberg EJ, Mariuzza RA (duben 2005). "Krystalová struktura lidského peptidoglykanového rozpoznávacího proteinu S (PGRP-S) v rozlišení 1,70 A". Journal of Molecular Biology. 347 (4): 683–91. doi:10.1016 / j.jmb.2005.01.070. PMID 15769462.
- ^ A b C d E F Tydell CC, Yount N, Tran D, Yuan J, Selsted ME (květen 2002). „Izolace, charakterizace a antimikrobiální vlastnosti proteinu vázajícího hovězí oligosacharidy. Mikrobicidní granulovaný protein z eosinofilů a neutrofilů“. The Journal of Biological Chemistry. 277 (22): 19658–64. doi:10,1074 / jbc.M200659200. PMID 11880375. S2CID 904536.
- ^ A b C d E Liu C, Gelius E, Liu G, Steiner H, Dziarski R (srpen 2000). „Savčí protein rozpoznávající peptidoglykany váže peptidoglykany s vysokou afinitou, je exprimován v neutrofilech a inhibuje růst bakterií“. The Journal of Biological Chemistry. 275 (32): 24490–9. doi:10,1074 / jbc.M001239200. PMID 10827080. S2CID 24226481.
- ^ A b C d Dziarski R, Platt KA, Gelius E, Steiner H, Gupta D (červenec 2003). „Defekt v zabíjení neutrofilů a zvýšená náchylnost k infekci nepatogenními grampozitivními bakteriemi u myší s deficitem peptidoglykanového rozpoznávacího proteinu-S (PGRP-S)“. Krev. 102 (2): 689–97. doi:10.1182 / krev-2002-12-3853. PMID 12649138.
- ^ A b C d E F Cho JH, Fraser IP, Fukase K, Kusumoto S, Fujimoto Y, Stahl GL, Ezekowitz RA (říjen 2005). „Lidský protein rozpoznávající peptidoglykany S je efektorem vrozené imunity zprostředkované neutrofily“. Krev. 106 (7): 2551–8. doi:10.1182 / krev-2005-02-0530. PMC 1895263. PMID 15956276.
- ^ A b C d E F Park SY, Jing X, Gupta D, Dziarski R (duben 2013). „Peptidoglykanový rozpoznávací protein 1 zvyšuje experimentální astma tím, že podporuje Th2 a Th17 a omezuje reakce regulačních T buněk a plazmacytoidních dendritických buněk“. Journal of Immunology. 190 (7): 3480–92. doi:10,4049 / jimmunol.1202675. PMC 3608703. PMID 23420883.
- ^ A b C d Yao X, Gao M, Dai C, Meyer KS, Chen J, Keeran KJ a kol. (Prosinec 2013). „Peptidoglykanový rozpoznávací protein 1 podporuje zánět dýchacích cest u myší vyvolaný roztoči“. American Journal of Respiratory Cell and Molecular Biology. 49 (6): 902–11. doi:10.1165 / rcmb.2013-0001OC. PMC 3931111. PMID 23808363.
- ^ A b Kappeler SR, Heuberger C, Farah Z, Puhan Z (srpen 2004). "Exprese proteinu rozpoznávajícího peptidoglykany, PGRP, v laktující mléčné žláze". Journal of Dairy Science. 87 (8): 2660–8. doi:10.3168 / jds.S0022-0302 (04) 73392-5. PMID 15328291.
- ^ A b C Ghosh A, Lee S, Dziarski R, Chakravarti S (září 2009). „Nový antimikrobiální protein rozpoznávající peptidoglykany v rohovce“. Investigativní oftalmologie a vizuální věda. 50 (9): 4185–91. doi:10,1167 / iovs.08-3040. PMC 3052780. PMID 19387073.
- ^ A b C Park SY, Gupta D, Hurwich R, Kim CH, Dziarski R (prosinec 2011). „Peptidoglykanový rozpoznávací protein Pglyrp2 chrání myši před záněty kůže podobné lupénce tím, že podporuje regulační T buňky a omezuje reakce Th17“. Journal of Immunology. 187 (11): 5813–23. doi:10,4049 / jimmunol. 1101068. PMC 3221838. PMID 22048773.
- ^ A b C d Park SY, Gupta D, Kim CH, Dziarski R (2011). „Diferenciální účinky proteinů rozpoznávajících peptidoglykany na experimentální atopickou a kontaktní dermatitidu zprostředkovanou buňkami Treg a Th17“. PLOS ONE. 6 (9): e24961. Bibcode:2011PLoSO ... 624961P. doi:10.1371 / journal.pone.0024961. PMC 3174980. PMID 21949809.
- ^ A b C Saha S, Jing X, Park SY, Wang S, Li X, Gupta D, Dziarski R (srpen 2010). „Peptidoglykanové rozpoznávací proteiny chrání myši před experimentální kolitidou podporou normální střevní flóry a prevencí indukce interferonu-gama“. Mobilní hostitel a mikrob. 8 (2): 147–62. doi:10.1016 / j.chom.2010.07.005. PMC 2998413. PMID 20709292.
- ^ Lo D, Tynan W, Dickerson J, Mendy J, Chang HW, Scharf M a kol. (Červenec 2003). „Exprese proteinu rozpoznávající peptidoglykany v myším Peyerově náplasti spojeném s folikulem naznačuje funkční specializaci“. Buněčná imunologie. 224 (1): 8–16. doi:10.1016 / s0008-8749 (03) 00155-2. PMID 14572796.
- ^ Wang J, Gusti V, Saraswati A, Lo DD (listopad 2011). „Konvergentní a divergentní vývoj mezi liniemi M buněk v epitelu myší sliznice“. Journal of Immunology. 187 (10): 5277–85. doi:10,4049 / jimmunol. 1102077. PMC 3208058. PMID 21984701.
- ^ Downs-Canner S, Berkey S, Delgoffe GM, Edwards RP, Curiel T, Odunsi K a kol. (Březen 2017). "reg buňky". Příroda komunikace. 8: 14649. doi:10.1038 / ncomms14649. PMC 5355894. PMID 28290453.
- ^ Arentsen T, Qian Y, Gkotzis S, Femenia T, Wang T, Udekwu K a kol. (Únor 2017). „Molekula Pglyrp2, která detekuje bakteriální peptidoglykany, moduluje vývoj a chování mozku“. Molekulární psychiatrie. 22 (2): 257–266. doi:10.1038 / mp.2016.182. PMC 5285465. PMID 27843150.
- ^ A b Rehman A, Taishi P, Fang J, Majde JA, Krueger JM (leden 2001). "Klonování krysího peptidoglykanového rozpoznávacího proteinu (PGRP) a jeho indukce v mozku deprivací spánku". Cytokin. 13 (1): 8–17. doi:10,1006 / cyto.2000.0800. PMID 11145837.
- ^ Lang MF, Schneider A, Krüger C, Schmid R, Dziarski R, Schwaninger M (leden 2008). „Peptidoglykanový rozpoznávací protein-S (PGRP-S) je nadregulován NF-kappaB“. Neurovědy Dopisy. 430 (2): 138–41. doi:10.1016 / j.neulet.2007.10.027. PMID 18035491. S2CID 54406942.
- ^ A b Tydell CC, Yuan J, Tran P, Selsted ME (leden 2006). "Bovinní peptidoglykanový rozpoznávací protein-S: antimikrobiální aktivita, lokalizace, sekrece a vazebné vlastnosti". Journal of Immunology. 176 (2): 1154–62. doi:10,4049 / jimmunol.176.2.1154. PMID 16394004. S2CID 11173657.
- ^ A b De Marzi MC, Todone M, Ganem MB, Wang Q, Mariuzza RA, Fernández MM, Malchiodi EL (červenec 2015). „Peptidoglykanové rozpoznávací komplexy protein-peptidoglykan zvyšují aktivaci monocytů / makrofágů a zvyšují zánětlivou odpověď“. Imunologie. 145 (3): 429–42. doi:10.1111 / imm.12460. PMC 4479541. PMID 25752767.
- ^ Wang ZM, Li X, Cocklin RR, Wang M, Wang M, Fukase K a kol. (Prosinec 2003). "Lidský peptidoglykanový rozpoznávací protein-L je N-acetylmuramoyl-L-alanin amidáza". The Journal of Biological Chemistry. 278 (49): 49044–52. doi:10,1074 / jbc.M307758200. PMID 14506276. S2CID 35373818.
- ^ A b C d Lu X, Wang M, Qi J, Wang H, Li X, Gupta D, Dziarski R (březen 2006). „Peptidoglykanové rozpoznávací proteiny jsou novou třídou lidských baktericidních proteinů“. The Journal of Biological Chemistry. 281 (9): 5895–907. doi:10,1074 / jbc.M511631200. PMID 16354652. S2CID 21943426.
- ^ A b Sharma P, Singh N, Sinha M, Sharma S, Perbandt M, Betzel C a kol. (Květen 2008). „Krystalová struktura proteinu rozpoznávajícího peptidoglykany při rozlišení 1,8 A odhaluje dvojí strategii boje proti infekci prostřednictvím dvou nezávislých funkčních homodimerů“. Journal of Molecular Biology. 378 (4): 923–32. doi:10.1016 / j.jmb.2008.03.018. PMID 18395744.
- ^ A b C d Wang M, Liu LH, Wang S, Li X, Lu X, Gupta D, Dziarski R (březen 2007). „Lidské proteiny rozpoznávající peptidoglykany vyžadují, aby zinek zabíjel grampozitivní i gramnegativní bakterie a jsou synergické s antibakteriálními peptidy“. Journal of Immunology. 178 (5): 3116–25. doi:10,4049 / jimmunol.178.5.3116. PMID 17312159. S2CID 22160694.
- ^ "Reactome | PGLYRP1 váže bakteriální peptidoglykan". reagovatome.org. Citováno 2020-11-03.
- ^ A b C d Kumar S, Roychowdhury A, Ember B, Wang Q, Guan R, Mariuzza RA, Boons GJ (listopad 2005). "Selektivní rozpoznávání syntetických lysinových a peptidoglykánových fragmentů typu kyseliny meso-diaminopimelické pomocí lidských peptidoglykanových rozpoznávacích proteinů I {alfa} a S". The Journal of Biological Chemistry. 280 (44): 37005–12. doi:10,1074 / jbc.M506385200. PMID 16129677. S2CID 44913130.
- ^ Sharma P, Dube D, Sinha M, Mishra B, Dey S, Mal G a kol. (Září 2011). „Multiligandová specificita místa vázajícího molekulární vzorec v patogenu v proteinu rozpoznávajícím peptidoglykan. The Journal of Biological Chemistry. 286 (36): 31723–30. doi:10.1074 / jbc.M111.264374. PMC 3173064. PMID 21784863.
- ^ A b Sharma P, Dube D, Singh A, Mishra B, Singh N, Sinha M a kol. (Květen 2011). „Strukturální základ rozpoznávání molekulárních vzorců asociovaných s patogeny a inhibice prozánětlivých cytokinů proteinem rozpoznávajícím velbloudí peptidoglykany“. The Journal of Biological Chemistry. 286 (18): 16208–17. doi:10,1074 / jbc.M111.228163. PMC 3091228. PMID 21454594.
- ^ A b C d E F G h Kashyap DR, Wang M, Liu LH, Boons GJ, Gupta D, Dziarski R (červen 2011). „Peptidoglykanové rozpoznávací proteiny ničí bakterie aktivací dvousložkových systémů snímajících proteiny“. Přírodní medicína. 17 (6): 676–83. doi:10,1038 / nm.2357. PMC 3176504. PMID 21602801.
- ^ Bobrovsky P, Manuvera V, Polina N, Podgorny O, Prusakov K, Govorun V, Lazarev V (červenec 2016). „Rekombinantní proteiny rozpoznávající lidský peptidoglykan odhalují antichlamydiální aktivitu“. Infekce a imunita. 84 (7): 2124–2130. doi:10.1128 / IAI.01495-15. PMC 4936355. PMID 27160295.
- ^ Wang J, Feng Y, Wang C, Srinivas S, Chen C, Liao H a kol. (Červenec 2017). „Patogenní kmeny Streptococcus používají novou únikovou strategii k inhibici bakteriostatického účinku zprostředkovaného savčím peptidoglykanovým rozpoznávacím proteinem“. Buněčná mikrobiologie. 19 (7): e12724. doi:10.1111 / cmi.12724. PMID 28092693. S2CID 3534029.
- ^ Osanai A, Sashinami H, Asano K, Li SJ, Hu DL, Nakane A (únor 2011). „Myší protein rozpoznávající peptidoglykany PGLYRP-1 hraje roli v přirozené imunitní odpovědi hostitele proti infekci Listeria monocytogenes“. Infekce a imunita. 79 (2): 858–66. doi:10.1128 / IAI.00466-10. PMC 3028829. PMID 21134971.
- ^ A b Dziarski R, Park SY, Kashyap DR, Dowd SE, Gupta D (2016). „Střevní mikroflóra regulovaná Pglyrp Prevotella falsenii, Parabacteroides distasonis a Bacteroides eggerthii Enhance a Alistipes finegoldii tlumí kolitidu u myší“. PLOS ONE. 11 (1): e0146162. Bibcode:2016PLoSO..1146162D. doi:10.1371 / journal.pone.0146162. PMC 4699708. PMID 26727498.
- ^ A b Banskar S, Detzner AA, Juarez-Rodriguez MD, Hozo I, Gupta D, Dziarski R (prosinec 2019). „Pglyrp1-regulovaný mikrobiom zvyšuje experimentální alergické astma“. Journal of Immunology. 203 (12): 3113–3125. doi:10,4049 / jimmunol.1900711. PMID 31704882. S2CID 207942798.
- ^ A b C Saha S, Qi J, Wang S, Wang M, Li X, Kim YG a kol. (Únor 2009). „PGLYRP-2 a Nod2 jsou vyžadovány pro peptidoglykanem vyvolanou artritidu a lokální zánět“. Mobilní hostitel a mikrob. 5 (2): 137–50. doi:10.1016 / j.chom.2008.12.010. PMC 2671207. PMID 19218085.
- ^ A b C Sashchenko LP, Dukhanina EA, Yashin DV, Shatalov YV, Romanova EA, Korobko EV a kol. (Leden 2004). „Proteinový tag7 rozpoznávající peptidoglykany tvoří cytotoxický komplex s proteinem 70 tepelného šoku v roztoku a v lymfocytech“. The Journal of Biological Chemistry. 279 (3): 2117–24. doi:10,1074 / jbc.M307513200. PMID 14585845. S2CID 23485070.
- ^ A b C Yashin DV, Ivanova OK, Soshnikova NV, Sheludchenkov AA, Romanova EA, Dukhanina EA a kol. (Srpen 2015). „Tag7 (PGLYRP1) v komplexu s Hsp70 indukuje alternativní cytotoxické procesy v nádorových buňkách prostřednictvím receptoru TNFR1“. The Journal of Biological Chemistry. 290 (35): 21724–31. doi:10,1074 / jbc.M115,639732. PMC 4571894. PMID 26183779.
- ^ Sashchenko LP, Dukhanina EA, Shatalov YV, Yashin DV, Lukyanova TI, Kabanova OD a kol. (Září 2007). „Cytotoxické T lymfocyty nesoucí proteinový tag7 rozpoznávající vzor mohou detekovat vyhýbavé, HLA-negativní, ale Hsp70-exponující nádorové buňky, čímž zajišťují zabíjení kontaktů zprostředkované FasL / Fas“. Krev. 110 (6): 1997–2004. doi:10.1182 / krev-2006-12-064444. PMID 17551095.
- ^ Dukhanina EA, Kabanova OD, Lukyanova TI, Shatalov YV, Yashin DV, Romanova EA a kol. (Srpen 2009). „Opačné role metastasinu (S100A4) ve dvou potenciálně tumoricidních mechanismech zahrnujících lidský lymfocytový protein Tag7 a Hsp70“. Sborník Národní akademie věd Spojených států amerických. 106 (33): 13963–7. Bibcode:2009PNAS..10613963D. doi:10.1073 / pnas.0900116106. PMC 2729003. PMID 19666596.
- ^ Yashin DV, Dukhanina EA, Kabanova OD, Romanova EA, Lukyanova TI, Tonevitskii AG a kol. (Březen 2011). „Protein vázající tepelný šok (HspBP1) chrání buňky před cytotoxickým účinkem komplexu Tag7-Hsp70“. The Journal of Biological Chemistry. 286 (12): 10258–64. doi:10.1074 / jbc.M110.163436. PMC 3060480. PMID 21247889.
- ^ Yashin DV, Romanova EA, Ivanova OK, Sashchenko LP (duben 2016). „Cytotoxický komplex Tag7-Hsp70 indukuje nekroptosu nádorových buněk permeabilizací lysozomů a mitochondrií.“ Biochimie. 123: 32–6. doi:10.1016 / j.biochi.2016.01.007. PMID 26796882.
- ^ Romanova EA, Sharapova TN, Telegin GB, Minakov AN, Chernov AS, Ivanova OK, et al. (Únor 2020). „12-merní peptid Tag7 (PGLYRP1) tvoří cytotoxický komplex s Hsp70 a inhibuje buněčnou smrt indukovanou TNF-alfa“. Buňky. 9 (2): 488. doi:10,3390 / buňky9020488. PMC 7072780. PMID 32093269.
- ^ Přečtěte si CB, Kuijper JL, Hjorth SA, Heipel MD, Tang X, Fleetwood AJ, et al. (Únor 2015). „Špička: identifikace neutrofilního PGLYRP1 jako ligandu pro TREM-1“. Journal of Immunology. 194 (4): 1417–21. doi:10,4049 / jimmunol. 1402303. PMC 4319313. PMID 25595774.
- ^ Zulfiqar F, Hozo I, Rangarajan S, Mariuzza RA, Dziarski R, Gupta D (2013). „Genetická asociace proteinových variant rozpoznávání peptidoglykanů se zánětlivým onemocněním střev“. PLOS ONE. 8 (6): e67393. Bibcode:2013PLoSO ... 867393Z. doi:10.1371 / journal.pone.0067393. PMC 3686734. PMID 23840689.
- ^ Nkya S, Mwita L, Mgaya J, Kumburu H, van Zwetselaar M, Menzel S a kol. (Červen 2020). „Identifikace genetických variant a cest souvisejících s extrémními hladinami fetálního hemoglobinu u srpkovité anémie v Tanzanii“. Lékařská genetika BMC. 21 (1): 125. doi:10.1186 / s12881-020-01059-1. PMC 7275552. PMID 32503527.
- ^ Rohatgi A, Ayers CR, Khera A, McGuire DK, Das SR, Matulevicius S a kol. (Duben 2009). „Asociace mezi peptidoglykanovým rozpoznávacím proteinem-1 a koronární a periferní aterosklerózou: pozorování ze studie Dallas Heart Study“. Ateroskleróza. 203 (2): 569–75. doi:10.1016 / j.atheroskleróza.2008.07.015. PMID 18774573.
- ^ Brownell NK, Khera A, de Lemos JA, Ayers CR, Rohatgi A (květen 2016). „Sdružení mezi proteinem 1 rozpoznávajícím peptidoglykany a výskytem aterosklerotických kardiovaskulárních chorob: Dallas Heart Study“. Journal of the American College of Cardiology. 67 (19): 2310–2312. doi:10.1016 / j.jacc.2016.02.063. PMID 27173041.
- ^ Park HJ, Noh JH, Eun JW, Koh YS, Seo SM, Park WS a kol. (Květen 2015). „Hodnocení a diagnostická relevance nových sérových biomarkerů pro včasné rozhodnutí o infarktu myokardu s elevací ST“. Cílový cíl. 6 (15): 12970–83. doi:10,18632 / oncotarget.4001. PMC 4536992. PMID 26025919.
- ^ Zhang J, Cheng Y, Duan M, Qi N, Liu J (květen 2017). „Odhalení rozdílně exprimovaných genů po regulaci transkripčních faktorů v sepse“. 3 Biotech. 7 (1): 46. doi:10.1007 / s13205-017-0713-x. PMC 5428098. PMID 28444588.
- ^ Brynjolfsson SF, Magnusson MK, Kong PL, Jensen T, Kuijper JL, Håkansson K a kol. (Srpen 2016). „Protilátka proti spouštěcímu receptoru exprimovanému na myeloidních buňkách 1 (TREM-1) tlumí prozánětlivou sekreci cytokinů buňkami Lamina Propria od pacientů s IBD“. Zánětlivá onemocnění střev. 22 (8): 1803–11. doi:10.1097 / MIB.0000000000000822. PMID 27243593. S2CID 3637291.
- ^ Molyneaux PL, Willis-Owen SA, Cox MJ, James P, Cowman S, Loebinger M a kol. (Červen 2017). „Interakce mezi hostitelem a mikroby při idiopatické plicní fibróze“. American Journal of Respiratory and Critical Care Medicine. 195 (12): 1640–1650. doi:10,1164 / rccm.201607-1408OC. PMC 5476909. PMID 28085486.
- ^ Kasaian MT, Lee J, Brennan A, Danto SI, Black KE, Fitz L, Dixon AE (červenec 2018). "Proteomická analýza séra a sputa analyzuje rozlišuje kontrolované a špatně kontrolované astmatiky". Klinická a experimentální alergie. 48 (7): 814–824. doi:10.1111 / cea.13151. PMID 29665127. S2CID 4938216.
- ^ Nylund KM, Ruokonen H, Sorsa T, Heikkinen AM, Meurman JH, Ortiz F a kol. (Leden 2018). "Asociace slinového spouštěcího receptoru exprimovaného na myeloidních buňkách / jeho ligandu rozpoznávajícího peptidoglykanový protein 1 osa s orálním zánětem u onemocnění ledvin". Časopis periodontologie. 89 (1): 117–129. doi:10.1902 / jop.2017.170218. PMID 28846062. S2CID 21830535.
- ^ Luo Q, Li X, Zhang L, Yao F, Deng Z, Qing C a kol. (Leden 2019). „Sérum PGLYRP ‑ 1 je vysoce diskriminační biomarker pro diagnostiku revmatoidní artritidy“. Zprávy o molekulární medicíně. 19 (1): 589–594. doi:10,3892 / mmr.2018.9632. PMID 30431075.
- ^ Silbereisen A, Hallak AK, Nascimento GG, Sorsa T, Belibasakis GN, Lopez R, Bostanci N (říjen 2019). „Regulace PGLYRP1 a TREM-1 během progrese a řešení zánětu dásní“. Klinický a translační výzkum JDR. 4 (4): 352–359. doi:10.1177/2380084419844937. PMID 31013451. S2CID 129941967.
- ^ Raivisto T, Heikkinen AM, Silbereisen A, Kovanen L, Ruokonen H, Tervahartiala T a kol. (Říjen 2020). "Regulace slinného peptidoglykanového rozpoznávacího proteinu 1 u dospívajících". Klinický a translační výzkum JDR. 5 (4): 332–341. doi:10.1177/2380084419894287. PMID 31860804.
- ^ Yucel ZP, Silbereisen A, Emingil G, Tokgoz Y, Kose T, Sorsa T a kol. (Říjen 2020). "Slinné biomarkery v kontextu zánětu dásní u dětí s cystickou fibrózou". Časopis periodontologie. 91 (10): 1339–1347. doi:10.1002 / JPER.19-0415. PMID 32100289.
- ^ Karsiyaka Hendek M, Kisa U, Olgun E (leden 2020). "Vliv kouření na gingivální crevikulární tekutinu rozpoznávající peptidoglykanový protein-1 po počáteční parodontální léčbě chronické parodontitidy". Orální nemoci. 26 (1): 166–172. doi:10.1111 / odi.13207. PMID 31587460.
- ^ Teixeira MK, Lira-Junior R, Lourenço EJ, Telles DM, Boström EA, Figueredo CM, Bostanci N (květen 2020). "Modulace osy TREM-1 / PGLYRP1 / MMP-8 u periimplantátových onemocnění". Klinická orální vyšetření. 24 (5): 1837–1844. doi:10.1007 / s00784-019-03047-z. PMID 31444693. S2CID 201283050.
- ^ Yang Z, Ni J, Kuang L, Gao Y, Tao S (září 2020). „Identifikace genů a cest souvisejících s subchondrální kostí u osteoartritidy pomocí bioinformatické analýzy“. Lék. 99 (37): e22142. doi:10.1097 / MD.0000000000022142. PMC 7489699. PMID 32925767.
- ^ Ortiz F, Nylund KM, Ruokonen H, Meurman JH, Furuholm J, Bostanci N, Sorsa T (srpen 2020). „Slinné biomarkery orálního zánětu jsou spojeny s kardiovaskulárními příhodami a úmrtím pacientů po transplantaci ledvin“. Řízení o transplantaci. doi:10.1016 / j.transproceed.2020.07.007. PMID 32768288.
- ^ Glickman JW, Dubin C, Renert-Yuval Y, Dahabreh D, Kimmel GW, Auyeung K a kol. (Květen 2020). „Průřezová studie krevních biomarkerů pacientů se středně těžkou až těžkou alopecia areata odhaluje systémovou imunitní a kardiovaskulární biomarkerovou dysregulaci.“ Journal of the American Academy of Dermatology. doi:10.1016 / j.jaad.2020.04.138. PMID 32376430.
- ^ Klimczak-Tomaniak D, Bouwens E, Schuurman AS, Akkerhuis KM, Constantinescu A, Brugts J a kol. (Červen 2020). „Časové vzorce markerů souvisejících s makrofágy a neutrofily jsou spojeny s klinickým výsledkem u pacientů se srdečním selháním“. Srdeční selhání ESC. 7 (3): 1190–1200. doi:10.1002 / ehf2.12678. PMC 7261550. PMID 32196993.
- ^ Yang S, Cao C, Xie Z, Zhou Z (březen 2020). „Analýza potenciálních genů náboje podílejících se na patogenezi čínských pacientů s diabetem 1. typu“. Annals of Translational Medicine. 8 (6): 295. doi:10.21037 / atm.2020.02.171. PMC 7186604. PMID 32355739.
- ^ Arenius I, Ruokonen H, Ortiz F, Furuholm J, Välimaa H, Bostanci N, et al. (Červenec 2020). "Vztah mezi orálními chorobami a infekčními komplikacemi u pacientů na dialýze". Orální nemoci. 26 (5): 1045–1052. doi:10.1111 / odi.13296. PMID 32026534.
- ^ Guo C, Li Z (prosinec 2019). „Bioinformatická analýza klíčových genů a cest souvisejících s trombózou u esenciální trombocytémie“. Monitor lékařské vědy. 25: 9262–9271. doi:10,12659 / MSM.918719. PMC 6911306. PMID 31801935.
- ^ Grande G, Vincenzoni F, Milardi D, Pompa G, Ricciardi D, Fruscella E a kol. (2017). "Cervikální hlenový proteom v endometrióze". Klinická proteomika. 14: 7. doi:10.1186 / s12014-017-9142-4. PMC 5290661. PMID 28174513.
Další čtení
- Dziarski R, Royet J, Gupta D (2016). „Peptidoglykanové rozpoznávací proteiny a lyzozym.“. V Ratcliffe MJ (ed.). Encyklopedie imunobiologie. 2. Elsevier Ltd. str. 389–403. doi:10.1016 / B978-0-12-374279-7.02022-1. ISBN 978-0123742797.
- Royet J, Gupta D, Dziarski R (listopad 2011). "Peptidoglykanové rozpoznávací proteiny: modulátory mikrobiomu a zánětu". Recenze přírody. Imunologie. 11 (12): 837–51. doi:10.1038 / nri3089. PMID 22076558. S2CID 5266193.
- Royet J, Dziarski R (duben 2007). "Peptidoglykanové rozpoznávací proteiny: pleiotropní senzory a efektory antimikrobiální obrany". Recenze přírody. Mikrobiologie. 5 (4): 264–77. doi:10.1038 / nrmicro1620. PMID 17363965. S2CID 39569790.
- Dziarski R, Gupta D (2006). „Peptidoglykanové rozpoznávací proteiny (PGRP)“. Genome Biology. 7 (8): 232. doi:10.1186 / gb-2006-7-8-232. PMC 1779587. PMID 16930467.
- Bastos PA, Wheeler R, Boneca IG (září 2020). "Příjem, rozpoznávání a reakce na peptidoglykan u savčího hostitele". Recenze mikrobiologie FEMS. doi:10.1093 / femsre / fuaa044. PMID 32897324.
- Wolf AJ, Underhill DM (duben 2018). "Rozpoznávání peptidoglykanů vrozeným imunitním systémem". Recenze přírody. Imunologie. 18 (4): 243–254. doi:10.1038 / nri.2017.136. PMID 29292393. S2CID 3894187.
- Laman JD, 't Hart BA, Power C, Dziarski R (červenec 2020). "Bakteriální peptidoglykan jako řidič chronického zánětu mozku". Trendy v molekulární medicíně. 26 (7): 670–682. doi:10.1016 / j.molmed.2019.11.006. PMID 32589935.
- Gonzalez-Santana A, Diaz Heijtz R (srpen 2020). "Bakteriální peptidoglykany z mikrobioty v neurovývoji a chování". Trendy v molekulární medicíně. 26 (8): 729–743. doi:10.1016 / j.molmed.2020.05.003. PMID 32507655.