Hořčík v biologii - Magnesium in biology
Hořčík je základním prvkem v biologických systémech. Hořčík vyskytuje se typicky jako Mg2+ ion. Je to základní minerál živina (tj. prvek) na celý život[1][2][3][4] a je přítomen ve všech buňka typ v každém organismu. Například, ATP (adenosintrifosfát), hlavní zdroj energie v buňkách, se musí vázat na iont hořčíku, aby byl biologicky aktivní. To, co se nazývá ATP, je často ve skutečnosti Mg-ATP.[5] Hořčík jako takový hraje roli ve stabilitě všech polyfosfát sloučeniny v buňkách, včetně sloučenin spojených se syntézou DNA a RNA.
Přes 300 enzymy vyžadují pro své katalytické působení přítomnost iontů hořčíku, včetně Všechno enzymy využívající nebo syntetizující ATP nebo ty, které používají jiné nukleotidy syntetizovat DNA a RNA.[Citace je zapotřebí ]
V rostlinách je hořčík nezbytný pro syntézu chlorofyl a fotosyntéza.
Funkce
Rovnováha hořčíku je zásadní pro pohodu všech organismů. Hořčík je relativně bohatý iont v zemské kůře a plášti a je vysoce biologicky dostupný v hydrosféra. Tato dostupnost v kombinaci s užitečnou a velmi neobvyklou chemií mohla vést k jejímu využití v evoluci jako iontu pro signalizaci, aktivaci enzymu a katalýza. Neobvyklá povaha iontového hořčíku však také vedla k velké výzvě při používání iontů v biologických systémech. Biologické membrány jsou nepropustné pro hořčík (a další ionty), takže transportní proteiny musí usnadňovat tok hořčíku do i z buněk a intracelulárních kompartmentů.
Chlorofyl v rostlinách přeměňuje vodu na kyslík jako O2. Hemoglobin u obratlovců přenáší kyslík jako O2 v krvi. Chlorofyl je velmi podobný hemoglobinu, kromě toho, že hořčík je ve středu molekuly chlorofylu a železo je ve středu molekuly hemoglobinu, s jinými variacemi.[6] Tento proces udržuje živé buňky na Zemi naživu a udržuje základní hladinu CO2 a O.2 v atmosféře.
Lidské zdraví
Nedostatečný příjem hořčíku často způsobuje svalovou hmotu křeče, a je spojován s kardiovaskulární onemocnění, cukrovka, vysoký krevní tlak, úzkost poruchy, migrény, osteoporóza, a mozkový infarkt.[7][8] Akutní nedostatek (viz hypomagnezémie ) je vzácný a je častější jako vedlejší účinek léku (jako je chronické užívání alkoholu nebo diuretik) než při nízkém příjmu potravy jako takové, ale může se vyskytnout u lidí krmených intravenózně po delší dobu.
Nejběžnějším příznakem nadměrného perorálního příjmu hořčíku je průjem. Doplňky založené na aminokyselina cheláty (jako glycinát, lyzinát atd.) jsou mnohem lépe tolerovány zažívací ústrojí a nemají vedlejší efekty použitých starších sloučenin, zatímco trvalé uvolňování doplňky stravy zabránit výskytu průjmu.[Citace je zapotřebí ] Vzhledem k tomu, že ledviny dospělých lidí účinně vylučují přebytečný hořčík, je orální otrava hořčíkem u dospělých normální funkce ledvin je velmi vzácný. Kojenci, kteří mají menší schopnost vylučovat přebytečný hořčík, i když jsou zdraví, by neměli dostávat doplňky hořčíku, s výjimkou péče lékaře.
Farmaceutické přípravky s hořčíkem se používají k léčbě stavů včetně nedostatek hořčíku a hypomagnezémie, stejně jako eklampsie.[9] Takové přípravky jsou obvykle ve formě Síran hořečnatý nebo chlorid, pokud je podán parenterálně. Hořčík je vstřebáván s přiměřenou účinností (30% až 40%) tělem z jakékoli rozpustné hořečnaté soli, jako je chlorid nebo citrát. Hořčík je podobně absorbován z síran hořečnatý, ačkoli síran v těchto solích zvyšuje jejich laxativní účinek při vyšších dávkách. Absorpce hořčíku z nerozpustných solí oxidů a hydroxidů (magnéziové mléko ) je nepravidelný a má horší účinnost, protože to závisí na neutralizaci a řešení soli kyselinou žaludku, což nemusí být (a obvykle není) úplné.
Orotát hořečnatý může být použit jako adjuvantní léčba u pacientů na optimální léčbě těžkých městnavé srdeční selhání, zvýšení míry přežití a zlepšení klinických příznaků a pacientů kvalita života.[10]
Nervové vedení
Hořčík může ovlivnit svalovou relaxaci přímým působením na buněčné membrány. Mg2+ ionty uzavírají určité typy vápníkové kanály, které chovají kladně nabité ionty vápníku do neurony. Při nadbytku hořčíku bude blokováno více kanálů a aktivita nervových buněk se sníží.[11][12]
Hypertenze
Při léčbě se používá intravenózní síran hořečnatý preeklampsie.[13] Pokud jde o hypertenzi související s těhotenstvím, metaanalýza 22 klinických studií s rozsahem dávek 120 až 973 mg / den a průměrnou dávkou 410 mg dospěla k závěru, že suplementace hořčíkem měla malý, ale statisticky významný účinek, snižující systolický krevní tlak o 3–4 mm Hg a diastolický krevní tlak o 2–3 mm Hg. Účinek byl větší, když byla dávka vyšší než 370 mg / den.[14]
Cukrovka a tolerance glukózy
Vyšší příjem hořčíku v potravinách odpovídá nižšímu výskytu cukrovky.[15] U lidí s diabetem nebo s vysokým rizikem cukrovky snižuje suplementace hořčíku glukózu nalačno.[16]
Dietní doporučení
Americký lékařský institut (IOM) aktualizoval odhadované průměrné požadavky (EARs) a Doporučené dietní příspěvky (RDA) pro hořčík v roce 1997. Pokud není dostatek informací pro stanovení EAR a RDA, použije se místo toho odhad označený jako Adekvátní příjem (AI). Současné EAR pro hořčík u žen ve věku od 31 let jsou 265 mg / den, respektive 350 mg / den. RDA jsou 320 a 420 mg / den. RDA jsou vyšší než EAR, aby bylo možné určit částky, které pokryjí lidi s nadprůměrnými požadavky. RDA pro těhotenství je 350 až 400 mg / den v závislosti na věku ženy. RDA pro laktaci se ze stejných důvodů pohybuje v rozmezí 310 až 360 mg / den. U dětí ve věku 1–13 let se RDA zvyšuje s věkem od 65 do 200 mg / den. Pokud jde o bezpečnost, nastavuje také IOM Přípustná horní úroveň příjmu (UL) pro vitamíny a minerály, pokud jsou dostatečné důkazy. V případě hořčíku je UL stanovena na 350 mg / den. UL je specifický pro hořčík konzumovaný jako doplněk stravy, důvodem je, že příliš mnoho spotřebovaného hořčíku najednou může způsobit průjem. UL se nevztahuje na hořčík pocházející z potravin. Souhrnně se EAR, RDA a UL označují jako Referenční dietní příjem.[17]
| Stáří | mužský | ženský | Těhotenství | Laktace |
|---|---|---|---|---|
| Narození do 6 měsíců | 30 mg * | 30 mg * | ||
| 7–12 měsíců | 75 mg * | 75 mg * | ||
| 1–3 roky | 80 mg | 80 mg | ||
| 4–8 let | 130 mg | 130 mg | ||
| 9–13 let | 240 mg | 240 mg | ||
| 14–18 let | 410 mg | 360 mg | 400 mg | 360 mg |
| 19–30 let | 400 mg | 310 mg | 350 mg | 310 mg |
| 31–50 let | 420 mg | 320 mg | 360 mg | 320 mg |
| 51+ let | 420 mg | 320 mg |
* = Adekvátní příjem
The Evropský úřad pro bezpečnost potravin (EFSA) označuje kolektivní soubor informací jako dietní referenční hodnoty, s referenčním příjmem populace (PRI) místo RDA a průměrným požadavkem místo EAR. AI a UL jsou definovány stejně jako ve Spojených státech. U žen ve věku 18 let a starších jsou umělá inteligence stanovena na 300, respektive 350 mg / den. AI pro těhotenství a kojení jsou také 300 mg / den. U dětí ve věku 1–17 let se AI zvyšuje s věkem od 170 do 250 mg / den. Tyto AI jsou nižší než americké RDA.[19] Evropský úřad pro bezpečnost potravin přezkoumal stejnou bezpečnostní otázku a stanovil jeho UL na 250 mg / den - nižší než hodnota v USA.[20] Hořčík UL je jedinečný v tom, že je nižší než u některých RDA. Vztahuje se pouze na příjem z farmakologického činidla nebo doplňku stravy a nezahrnuje příjem z jídla a vody.
Pro účely amerického označování potravin a doplňků stravy je množství v porci vyjádřeno jako procento denní hodnoty (% DV). Pro účely označování hořčíkem bylo 100% denní hodnoty 400 mg, ale ke dni 27. května 2016 byla revidována na 420 mg, aby byla uvedena do souladu s RDA.[21][22] Soulad s aktualizovanými předpisy o označování byl vyžadován do 1. ledna 2020 u výrobců s ročním prodejem potravin 10 milionů USD a více a do 1. ledna 2021 u výrobců s ročním prodejem potravin méně než 10 milionů USD.[23][24][25] Během prvních šesti měsíců následujících po datu souladu s 1. lednem 2020 plánuje FDA spolupracovat s výrobci na splnění nových požadavků na označení Nutrition Facts a během této doby se nebude soustředit na donucovací opatření týkající se těchto požadavků.[23] Tabulka starých a nových denních hodnot pro dospělé je k dispozici na Referenční denní příjem.
Potravinové zdroje

Zelená zelenina jako špenát poskytovat hořčík kvůli hojnosti chlorofyl molekuly, které obsahují iont. Ořechy (zvláště brazilské ořechy, kešu a mandle ), semena (např., dýňová semínka ), hořká čokoláda, pražený sójové boby, otruby, a nějaký celá zrna jsou také dobrým zdrojem hořčíku.[26]
Ačkoli mnoho potravin obsahuje hořčík, obvykle se vyskytuje v nízkých hladinách. Stejně jako u většiny živin je nepravděpodobné, že denní potřeby hořčíku uspokojí jedna porce jakéhokoli jednotlivého jídla. Jíst širokou škálu ovoce, zeleniny a obilovin pomůže zajistit dostatečný příjem hořčíku.[Citace je zapotřebí ]
Vzhledem k tomu, že se hořčík snadno rozpouští ve vodě, jsou rafinované potraviny, které se často zpracovávají nebo vaří ve vodě a obecně suší, špatným zdrojem živin. Například, celozrnný chléb má dvakrát tolik hořčíku než bílý chléb, protože klíčky a otruby bohaté na hořčík jsou odstraněny při zpracování bílé mouky. Tabulka potravinových zdrojů hořčíku naznačuje mnoho dietních zdrojů hořčíku.[Citace je zapotřebí ]
"Tvrdá voda může také poskytovat hořčík, ale "měkká voda obsahuje méně iontu. Průzkumy výživy nehodnotí příjem hořčíku z vody, což může vést k podcenění celkového příjmu hořčíku a jeho variability.
Příliš mnoho hořčíku může tělu ztěžovat vstřebávání vápník.[Citace je zapotřebí ] Nedostatek hořčíku může vést k hypomagnezémie jak je popsáno výše, s nepravidelným srdečním rytmem, vysokým krevním tlakem (známkou u lidí, ale ne u některých pokusných zvířat, jako jsou hlodavci), nespavostí a svalovými křečemi (fasciculace ). Jak však bylo poznamenáno, má se za to, že příznaky nedostatku hořčíku z čistého nedostatku stravy se vyskytují jen zřídka.
Následuje několik potravin a množství hořčíku v nich:[27]
- Dýně semena, žádné slupky (1/4 šálku) = 303 mg
- Chia semínka, (1/4 šálku) = 162 mg[28]
- Pohanka mouka (1/2 šálku) = 151 mg
- brazilské ořechy (1/4 šálku) = 125 mg
- Ovesné otruby, syrové (1/2 šálku) = 110 mg
- Kakaový prášek (1/4 šálku) = 107 mg
- Halibut (3 oz) = 103 mg
- Mandle (1/4 šálku) = 99 mg
- Kešu oříšky (1/4 šálku) = 89 mg
- Celozrnná mouka (1/2 šálku) = 83 mg
- Špenát, vařené (1/2 šálku) = 79 mg
- Švýcarský mangold, vařené (1/2 šálku) = 75 mg
- Čokoláda, 70% kakaa (1 oz) = 73 mg
- Tofu, pevný (1/2 šálku) = 73 mg
- Černé fazole, vařené (1/2 šálku) = 60 mg
- Quinoa, vařené (1/2 šálku) = 59 mg
- Burákové máslo (2 lžíce) = 50 mg
- Vlašské ořechy (1/4 šálku) = 46 mg
- Slunečnicová semínka, loupané (1/4 šálku) = 41 mg
- Cizrna vařené (1/2 šálku) = 39 mg
- Kapusta, vařené (1/2 šálku) = 37 mg
- Čočka, vařené (1/2 šálku) = 36 mg
- Ovesné vločky, vařené (1/2 šálku) = 32 mg
- Rybí omáčka (1 polévková lžíce) = 32 mg
- Mléko, bez tuku (1 šálek) = 27 mg
- Káva, espresso (1 oz) = 24 mg
- Celozrnný chléb (1 plátek) = 23 mg
Biologický rozsah, distribuce a regulace
v zvířata Bylo prokázáno, že různé typy buněk udržují různé koncentrace hořčíku.[29][30][31][32] Zdá se pravděpodobné, že totéž platí pro rostliny.[33][34] To naznačuje, že různé typy buněk mohou regulovat příliv a odtok hořčíku různými způsoby na základě jejich jedinečných metabolických potřeb. Intersticiální a systémové koncentrace volného hořčíku musí být jemně udržovány kombinovanými procesy pufrování (vazba iontů na proteiny a další molekuly) a tlumení (transport iontů do skladovacích nebo extracelulárních prostorů)[35]).
V rostlinách a v poslední době u zvířat byl hořčík uznáván jako důležitý signální iont, který aktivuje a zprostředkovává mnoho biochemických reakcí. Nejlepším příkladem toho je možná regulace uhlík fixace v chloroplasty v Calvinův cyklus.[36][37]
Hořčík je velmi důležitý pro buněčné funkce. Nedostatek živina způsobuje onemocnění postiženého organismu. V jednobuněčných organismech, jako je bakterie a droždí Nízká hladina hořčíku se projevuje výrazně sníženou rychlostí růstu. V transportu hořčíku knokaut kmeny bakterií, zdravé rychlosti jsou udržovány pouze při vystavení velmi vysokým vnějším koncentracím iontu.[38][39] V droždí mitochondriální nedostatek hořčíku také vede k nemocem.[40]
Rostliny s nedostatkem hořčíku vykazují stresové reakce. První pozorovatelné známky hladovění a nadměrné expozice hořčíku v rostlinách je pokles rychlosti fotosyntéza. To je způsobeno centrální polohou Mg2+ ion v chlorofyl molekula. Pozdějším účinkem nedostatku hořčíku na rostliny je výrazné snížení růstu a reprodukční životaschopnosti.[4] Hořčík může být také toxický pro rostliny, i když je to obvykle vidět pouze v sucho podmínky.[41][42]

U zvířat nedostatek hořčíku (hypomagnezémie ) je vidět, když je ekologická dostupnost hořčíku nízká. U přežvýkavců, kteří jsou obzvláště citliví na dostupnost hořčíku v pastvinách, je tento stav známý jako „travní tetanie“. Hypomagnezémie je identifikována ztrátou rovnováhy v důsledku svalové slabosti.[43] U lidí byla také identifikována řada geneticky přičitatelných poruch hypomagnezémie.[44][45][46][47]
Nadměrná expozice hořčíku může být pro jednotlivé buňky toxická, i když tyto účinky bylo obtížné experimentálně prokázat.[Citace je zapotřebí ] Hypermagnezémie, nadbytek hořčíku v krvi, je obvykle způsoben ztrátou ledviny funkce. Zdravá zvířata rychle vylučují přebytečný hořčík močí a stolicí.[48] Močový hořčík se nazývá magnesurie. Charakteristické koncentrace hořčíku v modelových organismech jsou: v E-coli 30 - 100 mM (vázaný), 0,01 - 1 mM (volný), v začínajících kvasnicích 50 mM, v savčích buňkách 10 mM (vázaný), 0,5 mM (volný) a v krevní plazmě 1 mM.[49]
Biologická chemie
Mg2+ je čtvrtý nejhojnější kov ion v buňkách (per krtci ) a nejhojnější volný dvojmocný kation - ve výsledku je hluboce a vnitřně vpleten do buněčného metabolismus. Mg2+-závislý enzymy objevují se prakticky v každé metabolické cestě: Specifická vazba Mg2+ na biologické membrány je často pozorováno, Mg2+ se také používá jako signální molekula a velká část biochemie nukleových kyselin vyžaduje Mg2+, včetně všech reakcí, které vyžadují uvolnění energie z ATP.[50][51][37] V nukleotidech je trojnásobná fosfátová část sloučeniny trvale stabilizována asociací s Mg2+ ve všech enzymatických procesech.
Chlorofyl
Ve fotosyntetických organismech se Mg2+ má další zásadní roli být koordinační ion v chlorofyl molekula. Tuto roli objevil Richard Willstätter, který obdržel Nobelovu cenu za chemii 1915 za čištění a strukturu vázání chlorofylu se šestým počtem uhlíku
Enzymy
Chemie Mg2+ iont, jak je aplikován na enzymy, využívá celou řadu neobvyklé reakční chemie tohoto iontu ke splnění řady funkcí.[50][52][53][54] Mg2+ interaguje se substráty, enzymy a příležitostně s oběma (Mg2+ mohou být součástí aktivního webu). Obecně platí, že Mg2+ interaguje se substráty prostřednictvím koordinace vnitřní sféry, stabilizace aniontů nebo reaktivních meziproduktů, včetně vazby na ATP a aktivace molekuly k nukleofilnímu útoku. Při interakci s enzymy a jinými proteiny Mg2+ se mohou vázat pomocí koordinace vnitřní nebo vnější koule, buď ke změně konformace enzymu, nebo k účasti na chemii katalytické reakce. V obou případech, protože Mg2+ je jen zřídka plně dehydratován během vazby ligandu, může to být molekula vody spojená s Mg2+ to je důležité spíše než samotný iont. The Lewisova kyselost Mg2+ (strK.A 11.4) se používá k umožnění jak hydrolýzy, tak kondenzačních reakcí (nejčastější jsou hydrolýza fosfátového esteru a přenos fosforylu), které by jinak vyžadovaly hodnoty pH výrazně odstraněné z fyziologických hodnot.
Podstatná role v biologické aktivitě ATP
ATP (adenosintrifosfát), hlavní zdroj energie v buňkách, musí být vázán na hořčíkový ion, aby byl biologicky aktivní. To, co se nazývá ATP, je často ve skutečnosti Mg-ATP.[5]
Nukleové kyseliny
Nukleové kyseliny mají důležitý rozsah interakcí s Mg2+. Vazba Mg2+ na DNA a RNA stabilizuje strukturu; to lze pozorovat při zvýšené teplotě tání (Tm) dvouvláknové DNA v přítomnosti Mg2+.[50] Navíc, ribozomy obsahují velké množství Mg2+ a poskytovaná stabilizace je nezbytná pro komplexaci tohoto riboproteinu.[55] Velké množství enzymů zapojených do biochemie nukleových kyselin váže Mg2+ pro aktivitu, použití iontu pro aktivaci i katalýzu. Nakonec autokatalýza mnoha ribozymy (enzymy obsahující pouze RNA) je Mg2+ závislé (např. kvasinkové mitochondriální skupiny II vlastní sestřihové introny[56]).
Hořčíkové ionty mohou být rozhodující při udržování poziční integrity těsně seskupených fosfátových skupin. Tyto shluky se objevují v mnoha a odlišných částech buněčné jádro a cytoplazma. Například hexahydrát Mg2+ ionty se vážou v hlubinách hlavní drážka a na vnějším ústí A-formy nukleové kyseliny duplexy.[57]
Buněčné membrány a stěny
Biologický buněčné membrány a buněčné stěny jsou polyaniontové povrchy. To má důležité důsledky pro transport iontů, zejména proto, že bylo prokázáno, že různé membrány přednostně váží různé ionty.[50] Oba Mg2+ a Ca2+ pravidelně stabilizujte membrány zesíťováním karboxylovaný a fosforylovaný hlavní skupiny lipidů. Avšak obalová membrána z E-coli Bylo také prokázáno, že váže Na+, K.+, Mn2+ a Fe3+. Transport iontů je závislý jak na koncentračním gradientu iontu, tak na elektrickém potenciálu (ΔΨ) přes membránu, který bude ovlivněn nábojem na povrchu membrány. Například specifická vazba Mg2+ do chloroplast obálka byla zapletena do ztráty fotosyntetické účinnosti blokováním K.+ absorpce a následné okyselení chloroplastového stromatu.[36]
Proteiny
The Mg2+ iont má tendenci se vázat jen slabě bílkoviny (K.A ≤ 105[50]) a to může buňka využít k přepnutí enzymatický aktivita se zapíná a vypíná změnami lokální koncentrace Mg2+. Ačkoli koncentrace volného cytoplazmatického Mg2+ je řádově 1 mmol / l, celkový Mg2+ obsah živočišných buněk je 30 mmol / l[58] a v rostlinách byl obsah listových endodermálních buněk měřen při hodnotách až 100 mmol / l (Stelzer et al., 1990), z nichž většina byla ukládána do vyrovnávacích pamětí. Cytoplazmatická koncentrace volného Mg2+ je ukládán do vyrovnávací paměti vazbou na chelátory (např. ATP), ale také, co je důležitější, skladováním Mg2+ v intracelulárních oddílech. Přeprava Mg2+ mezi intracelulárními kompartmenty může být hlavní součástí regulace aktivity enzymu. Interakce Mg2+ s transportem iontů přes biologické membrány je třeba také uvažovat.
Mangan
Pouze v biologických systémech mangan (Mn2+) je snadno schopný nahradit Mg2+, ale pouze za omezených okolností. Mn2+ je velmi podobný Mg2+ pokud jde o jeho chemické vlastnosti, včetně komplexace vnitřního a vnějšího pláště. Mn2+ účinně váže ATP a umožňuje hydrolýzu energetické molekuly většinou ATPáz. Mn2+ může také nahradit Mg2+ jako aktivační iont pro řadu Mg2+-závislé enzymy, i když část aktivity enzymů je obvykle ztracena.[50] Někdy se takové preference enzymového kovu liší mezi blízce příbuznými druhy: například reverzní transkriptáza enzym z lentiviry jako HIV, SIV a FIV je obvykle závislá na Mg2+, zatímco analogický enzym pro jiné retroviry preferuje Mn2+.
Důležitost vazby na léky
Článek[59] zkoumání strukturního základu interakcí mezi klinicky relevantními antibiotiky a 50S ribozomem se objevilo v Nature v říjnu 2001. Rentgenová krystalografie s vysokým rozlišením prokázala, že tato antibiotika se sdružují pouze s 23S rRNA ribozomální podjednotky a při interakci s proteinová část podjednotky. Článek zdůrazňuje, že výsledky ukazují „důležitost domnělého Mg2+ ionty pro vazbu některých drog “.
Měření hořčíku v biologických vzorcích
Radioaktivními izotopy
Použití prvků radioaktivního značení v testech absorpce iontů umožňuje výpočet km, Ki a Vmax a určuje počáteční změnu obsahu iontů v buňkách. 28Mg se rozpadá emisí vysoce energetické beta nebo gama částice, kterou lze měřit pomocí scintilačního čítače. Radioaktivní poločas však 28Mg, nejstabilnější z radioaktivních izotopů hořčíku, je pouze 21 hodin. To přísně omezuje experimenty zahrnující nuklid. Od roku 1990 také žádné zařízení běžně nevyrábí 28Mg a předpokládá se, že cena za mCi bude nyní přibližně 30 000 USD.[60] Chemická podstata Mg2+ je takový, že je úzce aproximován několika dalšími kationty.[61] Co2+, Mn2+ a Ni2+ byly úspěšně použity k napodobení vlastností Mg2+ v některých enzymových reakcích a radioaktivní formy těchto prvků byly úspěšně použity ve studiích transportu kationů. Obtížnost použití náhrady kovových iontů při studiu funkce enzymu spočívá v tom, že je velmi obtížné zjistit vztah mezi aktivitami enzymu s náhradním iontem ve srovnání s původním iontem.[61]
Podle fluorescenčních indikátorů
Řada chelátorů dvojmocných kationtů má různá fluorescenční spektra ve vázaných a nevázaných stavech.[62] Chelators pro Ca2+ jsou dobře zavedené, mají vysokou afinitu k kationtu a nízkou interferenci s jinými ionty. Mg2+ chelátory zaostávají a hlavní fluorescenční barvivo pro Mg2+ (mag-fura 2[63]) má ve skutečnosti vyšší afinitu k Ca2+.[64] To omezuje použití tohoto barviva na typy buněk, kde je klidová hladina Ca2+ je <1 μM a nemění se s experimentálními podmínkami, za kterých Mg2+ je třeba měřit. Nedávno, Otten et al. (2001) popsali práci na nové třídě sloučenin, které se mohou ukázat jako užitečnější a mají výrazně lepší vazebné afinity k Mg2+.[65] Použití fluorescenčních barviv je omezeno na měření volného Mg2+. Pokud je koncentrace iontů pufrována buňkou chelatací nebo odstraněním do subcelulárních oddílů, naměřená rychlost absorpce poskytne pouze minimální hodnoty km a Vmax.
Elektrofyziologií
Za prvé, iontově specifické mikroelektrody lze použít k měření vnitřní koncentrace volných iontů v buňkách a organelách. Hlavní výhody spočívají v tom, že lze odečítat údaje z buněk po relativně dlouhou dobu a že na rozdíl od barviv se do buněk přidává velmi malá kapacita iontového pufru.[66]
Za druhé, technika dvouelektrodové napěťové svorky umožňuje přímé měření iontového toku přes membránu článku.[67] Membrána se udržuje na elektrickém potenciálu a měří se reagující proud. Všechny ionty procházející membránou přispívají k měřenému proudu.
Za třetí, technika patch-clamp využívá izolované úseky přírodní nebo umělé membrány stejným způsobem jako svorka napětí, ale bez sekundárních účinků buněčného systému. Za ideálních podmínek lze kvantifikovat vodivost jednotlivých kanálů. Tato metodika poskytuje nejpřímější měření působení iontových kanálů.[67]
Absorpční spektroskopií
Plamen atomová absorpční spektroskopie (AAS) určuje celkový obsah hořčíku v biologickém vzorku.[62] Tato metoda je destruktivní; biologické vzorky musí být rozloženy na koncentrované kyseliny, aby nedošlo k ucpání jemného rozprašovače. Kromě toho je jediným omezením to, že vzorky musí být pro optimální přesnost v objemu přibližně 2 ml a v koncentračním rozmezí 0,1 - 0,4 µmol / l. Protože tato technika nemůže rozlišovat mezi Mg2+ již přítomný v buňce a absorbovaný během experimentu, lze kvantifikovat pouze nepřevzatý obsah.
Indukčně vázaná plazma (ICP) pomocí buď hmotnostní spektrometrie (MS) nebo atomová emisní spektroskopie Úpravy (AES) také umožňují stanovení celkového obsahu iontů v biologických vzorcích.[68] Tyto techniky jsou citlivější než plamen AAS a jsou schopné měřit množství více iontů současně. Jsou však také podstatně dražší.
Transport hořčíku
Chemické a biochemické vlastnosti Mg2+ představuje buněčný systém s výzvou při transportu iontu přes biologické membrány. Dogma iontového transportu uvádí, že transportér rozpozná iont a poté postupně odstraňuje hydratační vodu, přičemž většinu nebo veškerou vodu odstraní v selektivním póru, než uvolní iont na vzdálené straně membrány.[69] Díky vlastnostem Mg2+, velká změna objemu z hydratovaného na holý iont, vysoká energie hydratace a velmi nízká rychlost výměny ligandu uvnitř koordinační sféra, tyto kroky jsou pravděpodobně obtížnější než pro většinu ostatních iontů. K dnešnímu dni pouze protein ZntA z Paramecium bylo prokázáno, že je Mg2+ kanál.[70] Mechanismy Mg2+ transport zbývajícími proteiny se začíná odkrývat s první trojrozměrnou strukturou Mg2+ dopravní komplex řešený v roce 2004.[71]
The hydratační skořápka Mg2+ iont má velmi pevně vázaný vnitřní obal šesti molekul vody a relativně pevně vázaný druhý obal obsahující 12–14 molekul vody (Markham et al., 2002). Předpokládá se tedy, že uznání Mg2+ iont vyžaduje určitý mechanismus pro počáteční interakci s hydratačním obalem Mg2+, následované přímým rozpoznáním / vazbou iontu na protein.[60] Kvůli síle komplexace vnitřní koule mezi Mg2+ a jakýkoli ligand, několik současných interakcí s transportním proteinem na této úrovni může významně zpomalit iont v transportním póru. Je tedy možné, že se během transportu zadržuje velká část hydratační vody, což umožňuje slabší (ale stále specifickou) koordinaci vnější sféry.
I přes mechanickou obtížnost, Mg2+ musí být transportován přes membrány a velké množství Mg2+ byly popsány toky přes membrány z různých systémů.[72] Pouze malý výběr Mg2+ transportéry byly charakterizovány na molekulární úrovni.
Blokáda ligandového iontového kanálu
Hořčík ionty (Mg2+) v buněčná biologie jsou obvykle téměř ve všech smyslech opačných k Ca.2+ ionty, protože jsou bivalentní taky, ale mít větší elektronegativita a tak vyvíjejí větší tlak na molekuly vody a brání průchodu kanálem (i když samotný hořčík je menší). Mg2+ ionty blokují Ca2+ kanály jako (Kanály NMDA ) a bylo prokázáno, že ovlivňují vytváření kanálů mezery elektrické synapse.
Fyziologie rostlin hořčíku
Předchozí oddíly se podrobně zabývaly chemickými a biochemickými aspekty Mg2+ a jeho transport přes buněčné membrány. Tato část aplikuje tyto znalosti na aspekty fyziologie celých rostlin ve snaze ukázat, jak tyto procesy interagují s větším a složitějším prostředím mnohobuněčného organismu.
Nutriční požadavky a interakce
Mg2+ je nezbytný pro růst rostlin a je přítomen ve vyšších rostlinách v množství řádově 80 μmol g−1 suchá hmotnost.[4] Množství Mg2+ se liší v různých částech rostliny a jsou závislé na stavu výživy. V době hojnosti přebytek Mg2+ mohou být uloženy ve vaskulárních buňkách (Stelzer et al., 1990;[34] a v dobách hladu Mg2+ se v mnoha rostlinách redistribuuje ze starších na novější listy.[4][73]
Mg2+ je přijímán do rostlin kořeny. Interakce s jinými kationty v rhizosféra může mít významný vliv na absorpci iontů (Kurvits a Kirkby, 1980;[74] Struktura stěn kořenových buněk je vysoce propustná pro vodu a ionty, a proto může dojít k absorpci iontů do kořenových buněk kdekoli od kořenových chloupků po buňky umístěné téměř ve středu kořene (omezeno pouze Casparian pás ). Stěny a membrány rostlinných buněk nesou velké množství negativních nábojů a interakce kationů s těmito náboji je klíčem k příjmu kationů kořenovými buňkami, což umožňuje lokální koncentrační účinek.[75] Mg2+ váže se na tyto náboje relativně slabě a může být přemístěn jinými kationty, což znemožňuje absorpci a způsobí nedostatek v rostlině.
V jednotlivých rostlinných buňkách je Mg2+ požadavky jsou do značné míry stejné jako pro celý buněčný život; Mg2+ se používá ke stabilizaci membrán, je životně důležitý pro využití ATP, je významně zapojen do biochemie nukleových kyselin a je kofaktorem mnoha enzymů (včetně ribozomu). Také Mg2+ je koordinační iont v molekule chlorofylu. Jedná se o intracelulární rozčlenění Mg2+ v rostlinných buňkách, což vede k další složitosti. Čtyři oddíly v rostlinné buňce ohlásily interakce s Mg2+. Zpočátku Mg2+ vstoupí do buňky do cytoplazmy (dosud neidentifikovaným systémem), ale volný Mg2+ koncentrace v tomto kompartmentu jsou přísně regulovány na relativně nízkých úrovních (≈2 mmol / l), takže veškerý přebytek Mg2+ je buď rychle exportován nebo uložen ve druhém intracelulárním kompartmentu, vakuole.[76] Požadavek na Mg2+ v mitochondriích byla prokázána v kvasinkách[77] a zdá se vysoce pravděpodobné, že to samé bude platit pro rostliny. Chloroplasty také vyžadují významné množství vnitřního Mg2+a nízké koncentrace cytoplazmatického Mg2+.[78][79] Kromě toho se zdá pravděpodobné, že další subcelulární organely (např. Golgi, endoplazmatické retikulum atd.) Také vyžadují Mg2+.
Distribuce iontů hořčíku v rostlině
Jednou v cytoplazmatickém prostoru kořenových buněk Mg2+, spolu s dalšími kationty, je pravděpodobně transportován radiálně do stély a vaskulární tkáně.[80] Z buněk obklopujících xylem jsou ionty uvolňovány nebo čerpány do xylému a přenášeny rostlinou. V případě Mg2+, který je vysoce mobilní jak v xylému, tak v floému,[81] ionty budou transportovány na vrchol rostliny a zpět v nepřetržitém cyklu doplňování. Proto je absorpce a uvolňování z cévních buněk pravděpodobně klíčovou součástí celé rostliny Mg2+ homeostáza. Obrázek 1 ukazuje, jak málo procesů bylo spojeno s jejich molekulárními mechanismy (pouze vakuolární absorpce byla spojena s transportním proteinem, AtMHX).
Diagram ukazuje schéma rostliny a domnělých procesů Mg2+ transport u kořene a listu, kde Mg2+ je nakládán a vykládán z cévních tkání.[4] Mg2+ je absorbován do prostoru buněčné stěny kořenů (1) a interaguje s negativními náboji spojenými s buněčnými stěnami a membránami. Mg2+ mohou být absorbovány do buněk okamžitě (symplastická dráha) nebo mohou cestovat až k pásmu Casparian (4), než jsou absorbovány do buněk (apoplastická dráha; 2). Koncentrace Mg2+ v kořenových buňkách je pravděpodobně pufrován ukládáním do vakuol kořenových buněk (3). Všimněte si, že buňky v kořenovém hrotu neobsahují vakuoly. Poté, co byl v cytoplazmě kořenových buněk, Mg2+ cestuje směrem ke středu kořene o plasmodesmata, kde je naložen do xylému (5) pro přepravu do horních částí zařízení. Když se Mg2+ dosáhne listů, je vyložen z xylemu do buněk (6) a opět je pufrován ve vakuolách (7). Ať už na kole Mg2+ do floému dochází prostřednictvím obecných buněk v listu (8) nebo přímo z xylemu do floému prostřednictvím přenos buněk (9) není znám. Mg2+ se může vrátit ke kořenům ve floémové míze.
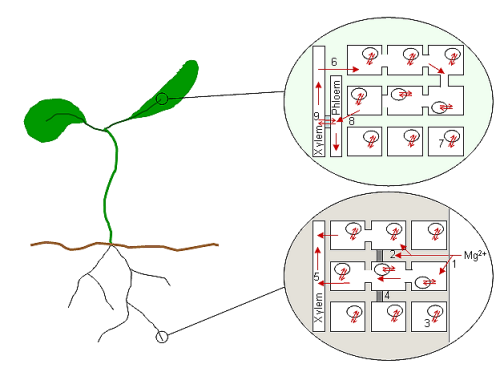
Když Mg2+ iont byl absorbován buňkou, která jej vyžaduje pro metabolické procesy, obecně se předpokládá, že iont v této buňce zůstane tak dlouho, dokud je buňka aktivní.[4] Ve vaskulárních buňkách tomu tak není vždy; v dobách hojnosti, Mg2+ je uložen ve vakuole, neúčastní se každodenních metabolických procesů buňky (Stelzer et al., 1990) a je vydán podle potřeby. U většiny buněk je však Mg uvolňováno stárnutím nebo zraněním2+ a mnoho dalších iontových složek, které je recyklují do zdravých částí rostliny. Navíc, když Mg2+ v prostředí je omezující, některé druhy jsou schopné mobilizovat Mg2+ ze starších tkání.[73] Tyto procesy zahrnují uvolňování Mg2+ ze svých vázaných a uložených stavů a transportu zpět do vaskulární tkáně, kde může být distribuována do zbytku rostliny. V dobách růstu a vývoje Mg2+ je také remobilizován v rostlině, jak se mění vztahy zdroje a jímky.[4]
Homeostáza Mg2+ uvnitř jednotlivých rostlinných buněk je udržován procesy probíhajícími na plazmatické membráně a na vakuové membráně (viz obrázek 2). Hlavní hnací silou pro translokaci iontů v rostlinných buňkách je ΔpH.[82] H+-ATPázy čerpadlo H+ ionty proti jejich koncentračnímu gradientu k udržení rozdílu pH, který lze použít pro transport dalších iontů a molekul. H+ ionty jsou čerpány z cytoplazmy do extracelulárního prostoru nebo do vakuoly. Vstup Mg2+ do buněk může nastat jednou ze dvou cest, kanály využívajícími ΔΨ (negativní uvnitř) přes tuto membránu nebo pomocí symport s H.+ ionty. K přepravě Mg2+ iont ve vakuole vyžaduje Mg2+/ H+ antiport transportér (například AtMHX). H+-ATPázy jsou závislé na Mg2+ (vázáno na ATP) pro aktivitu, takže Mg2+ je povinen udržovat svou vlastní homeostázu.
Je ukázáno schéma rostlinné buňky včetně čtyř hlavních oddílů, které jsou v současné době považovány za interakční s Mg2+. H+-ATPázy udržovat konstantní ΔpH přes plazmatickou membránu a vakuolovou membránu. Mg2+ je transportován do vakuoly pomocí energie ΔpH (v A. thaliana od AtMHX). Přeprava Mg2+ do buněk mohou používat buď negativní ΔΨ nebo ΔpH. Přeprava Mg2+ do mitochondrií pravděpodobně používá ΔΨ jako v mitochondriích kvasinek a je pravděpodobné, že chloroplasty vzít Mg2+ podobným systémem. Mechanismus a molekulární základ pro uvolňování Mg2+ from vacuoles and from the cell is not known. Likewise, the light-regulated Mg2+ concentration changes in chloroplasts are not fully understood, but do require the transport of H+ ions across the thylakoid membrána.

Magnesium, chloroplasts and photosynthesis
Mg2+ is the coordinating metal ion in the chlorophyll molecule, and in plants where the ion is in high supply about 6% of the total Mg2+ is bound to chlorophyll.[4][83][84] Thylakoid stacking is stabilised by Mg2+ and is important for the efficiency of photosynthesis, allowing phase transitions to occur.[85]
Mg2+ is probably taken up into chloroplasts to the greatest extent during the light-induced development from proplastid to chloroplast or etioplast to chloroplast. At these times, the synthesis of chlorophyll and the biogenesis of the thylakoid membrane stacks absolutely require the divalent cation.[86][87]
Whether Mg2+ is able to move into and out of chloroplasts after this initial developmental phase has been the subject of several conflicting reports. Deshaies et al. (1984) found that Mg2+ did move in and out of isolated chloroplasts from young pea plants,[88] but Gupta and Berkowitz (1989) were unable to reproduce the result using older spinach chloroplasts.[89] Deshaies et al. had stated in their paper that older pea chloroplasts showed less significant changes in Mg2+ content than those used to form their conclusions. The relative proportion of immature chloroplasts present in the preparations may explain these observations.
The metabolic state of the chloroplast changes considerably between night and day. During the day, the chloroplast is actively harvesting the energy of light and converting it into chemical energy. The activation of the metabolic pathways involved comes from the changes in the chemical nature of the stroma on the addition of light. H+ is pumped out of the stroma (into both the cytoplasm and the lumen) leading to an alkaline pH.[90][91] Mg2+ (along with K+) is released from the lumen into the stroma, in an electroneutralisation process to balance the flow of H+.[92][93][94][95] Finally, thiol groups on enzymes are reduced by a change in the redox state of the stroma.[96] Examples of enzymes activated in response to these changes are fructose 1,6-bisphosphatase, sedoheptulose bisphosphatase and ribulose-1,5-bisphosphate carboxylase.[4][53][96] During the dark period, if these enzymes were active a wasteful cycling of products and substrates would occur.
Two major classes of the enzymes that interact with Mg2+ in the stroma during the light phase can be identified.[53] Firstly, enzymes in the glycolytic pathway most often interact with two atoms of Mg2+. The first atom is as an allosteric modulator of the enzymes’ activity, while the second forms part of the active site and is directly involved in the catalytic reaction. The second class of enzymes includes those where the Mg2+ is complexed to nucleotide di- and tri-phosphates (ADP and ATP), and the chemical change involves phosphoryl transfer. Mg2+ may also serve in a structural maintenance role in these enzymes (e.g., enolase).
Magnesium stress
Plant stress responses can be observed in plants that are under- or over-supplied with Mg2+. The first observable signs of Mg2+ stress in plants for both starvation and toxicity is a depression of the rate of photosynthesis, it is presumed because of the strong relationships between Mg2+ and chloroplasts/chlorophyll. In pine trees, even before the visible appearance of yellowing and necrotic spots, the photosynthetic efficiency of the needles drops markedly.[73] In Mg2+ deficiency, reported secondary effects include carbohydrate immobility, loss of RNA transcription and loss of protein synthesis.[97] However, due to the mobility of Mg2+ within the plant, the deficiency phenotype may be present only in the older parts of the plant. For example, in Pinus radiata starved of Mg2+, one of the earliest identifying signs is the chloróza in the needles on the lower branches of the tree. This is because Mg2+ has been recovered from these tissues and moved to growing (green) needles higher in the tree.[73]
A Mg2+ deficit can be caused by the lack of the ion in the media (soil), but more commonly comes from inhibition of its uptake.[4] Mg2+ binds quite weakly to the negatively charged groups in the root cell walls, so that excesses of other cations such as K+, NH4+, Ca2+, and Mn2+ can all impede uptake.(Kurvits and Kirkby, 1980;[74] In acid soils Al3+ is a particularly strong inhibitor of Mg2+ uptake.[98][99] The inhibition by Al3+ and Mn2+ is more severe than can be explained by simple displacement, hence it is possible that these ions bind to the Mg2+ uptake system directly.[4] In bacteria and yeast, such binding by Mn2+ has already been observed. Stress responses in the plant develop as cellular processes halt due to a lack of Mg2+ (e.g. maintenance of ΔpH across the plasma and vacuole membranes). In Mg2+-starved plants under low light conditions, the percentage of Mg2+ bound to chlorophyll has been recorded at 50%.[100] Presumably, this imbalance has detrimental effects on other cellular processes.
Mg2+ toxicity stress is more difficult to develop. When Mg2+ is plentiful, in general the plants take up the ion and store it (Stelzer et al., 1990). However, if this is followed by drought then ionic concentrations within the cell can increase dramatically. High cytoplasmic Mg2+ concentrations block a K+ channel in the inner envelope membrane of the chloroplast, in turn inhibiting the removal of H+ ions from the chloroplast stroma. This leads to an acidification of the stroma that inactivates key enzymes in uhlíková fixace, which all leads to the production of oxygen volné radikály in the chloroplast that then cause oxidative damage.[101]
Viz také
- Iontové kanály
- Myersův koktejl
- Nedostatek hořčíku (lék)
- Magnesium deficiency (agriculture)
- Vápník v biologii
Poznámky
- ^ "Magnesium (In Biological Systems)". Van Nostrand's Scientific Encyclopedia. 2006. doi:10.1002/0471743984.vse4741. ISBN 978-0471743989. Chybějící nebo prázdný
| název =(Pomoc) - ^ Leroy, J. (1926). "Necessite du magnesium pour la croissance de la souris". Comptes Rendus des Séances de la Société de Biologie. 94: 431–433.
- ^ Lusk, J.E.; Williams, R.J.P .; Kennedy, E.P. (1968). "Magnesium and the growth of Escherichia coli". Journal of Biological Chemistry. 243 (10): 2618–2624. PMID 4968384.
- ^ A b C d E F G h i j k Marschner, H. (1995). Mineral Nutrition in Higher Plants. San Diego: Academic Press. ISBN 978-0-12-473542-2.
- ^ A b "Definition: magnesium from Online Medical Dictionary". 25 December 2007. Archived from originál dne 25. 12. 2007. Citováno 17. ledna 2018.
- ^ Granick S, Evolution of Heme and Chlorophyll in book, Bryson V, HJ Vogel, ed., Evolving Genes and Proteins. Academic Press, NY and London, 1965, pp. 67-88.
- ^ Romani, Andrea, M.P. (2013). "Chapter 3. Magnesium in Health and Disease". V Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Kovové ionty v biologických vědách. 13. Springer. str. 49–79. doi:10.1007/978-94-007-7500-8_3. ISBN 978-94-007-7499-5. PMID 24470089.
- ^ Larsson S. C.; Virtanen M. J.; Mars M.; et al. (Březen 2008). "Magnesium, calcium, potassium, and sodium intakes and risk of stroke in male smokers". Oblouk. Internovat. Med. 168 (5): 459–65. doi:10.1001/archinte.168.5.459. PMID 18332289.
- ^ Euser, A. G.; Cipolla, M. J. (2009). "Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review". Mrtvice. 40 (4): 1169–1175. doi:10.1161/STROKEAHA.108.527788. PMC 2663594. PMID 19211496.
- ^ Stepura OB, Martynow AI (February 2008). "Magnesium orotate in severe congestive heart failure (MACH)". Int. J. Cardiol. 131 (2): 293–5. doi:10.1016/j.ijcard.2007.11.022. PMID 18281113.
- ^ Slutsky, I.; Sadeghpour, S.; Li, B .; Liu, G. (2004). "Enhancement of Synaptic Plasticity through Chronically Reduced Ca2+ Flux during Uncorrelated Activity". Neuron. 44 (5): 835–49. doi:10.1016/j.neuron.2004.11.013. PMID 15572114.Celý text
- ^ Slutsky, I.; Abumaria, N.; Wu, L. J .; Huang, C.; Zhang, L .; Li, B .; Zhao, X.; Govindarajan, A.; Zhao, M. G.; Zhuo, M.; Tonegawa, S .; Liu, G. (2010). "Enhancement of Learning and Memory by Elevating Brain Magnesium". Neuron. 65 (2): 165–77. doi:10.1016/j.neuron.2009.12.026. PMID 20152124.Celý text
- ^ Duley L, Gülmezoglu AM, Henderson-Smart DJ, Chou D (2010). "Magnesium sulphate and other anticonvulsants for women with pre-eclampsia". Cochrane Database Syst Rev (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ^ Kass L, Weekes J, Carpenter L (2012). "Effect of magnesium supplementation on blood pressure: a meta-analysis". Eur J Clin Nutr. 66 (4): 411–8. doi:10.1038/ejcn.2012.4. PMID 22318649.
- ^ Fang X, Han H, Li M, Liang C, Fan Z, Aaseth J, He J, Montgomery S, Cao Y (2016). "Dose-Response Relationship between Dietary Magnesium Intake and Risk of Type 2 Diabetes Mellitus: A Systematic Review and Meta-Regression Analysis of Prospective Cohort Studies". Živiny. 8 (11): 739. doi:10.3390/nu8110739. PMC 5133122. PMID 27869762.
- ^ Veronese N, Watutantrige-Fernando S, Luchini C, Solmi M, Sartore G, Sergi G, Manzato E, Barbagallo M, Maggi S, Stubbs B (2016). "Effect of magnesium supplementation on glucose metabolism in people with or at risk of diabetes: a systematic review and meta-analysis of double-blind randomized controlled trials". Eur J Clin Nutr. 70 (12): 1354–1359. doi:10.1038/ejcn.2016.154. hdl:10447/297358. PMID 27530471. S2CID 24998868.
- ^ "Magnesium", pp.190-249 in "Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride". Press National Academy. 1997.
- ^ "Magnesium". Národní institut zdraví, Office of Dietary Supplements. Updated: September 26, 2018
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017.
- ^ Přípustná horní úroveň příjmu pro vitamíny a minerály (PDF), Evropský úřad pro bezpečnost potravin, 2006
- ^ „Federální registr 27. května 2016 Označování potravin: Revize štítků s údaji o výživě a doplňcích. FR strana 33982“ (PDF).
- ^ „Denní referenční hodnota databáze doplňků stravy (DSLD)“. Databáze doplňků stravy (DSLD). Citováno 16. května 2020.
- ^ A b „FDA poskytuje informace o dvojitých sloupcích na štítku Nutrition Facts“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 30. prosince 2019. Citováno 16. května 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ "Changes to the Nutrition Facts Label". NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 27. května 2016. Citováno 16. května 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Průmyslové zdroje o změnách štítku Nutriční fakta“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 21. prosince 2018. Citováno 16. května 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ "Top 10 Foods Highest in Magnesium + Printable One Page Sheet". HealthAliciousNess. Citováno 17. ledna 2018.
- ^ "SELF Nutrition Data - Food Facts, Information & Calorie Calculator". nutdata.self.com.
- ^ "Food Composition Databases Show Foods List12006". ndb.nal.usda.gov.
- ^ Valberg, L. S.; Holt, J.M.; Paulson, E .; Szivek, J. (1965). "Spectrochemical Analysis of Sodium, Potassium, Calcium, Magnesium, Copper, and Zinc in Normal Human Erythrocytes". Journal of Clinical Investigation. 44 (3): 379–389. doi:10.1172/JCI105151. PMC 292488. PMID 14271298.
- ^ Seiler, R. H.; Ramirez, O.; Brest, A. N.; Moyer, J. H. (1966). "Serum and erythrocytic magnesium levels in congestive heart failure: effect of hydrochlorothiazide". American Journal of Cardiology. 17 (6): 786–791. doi:10.1016/0002-9149(66)90372-9.
- ^ Walser, M. (1967). "Magnesium metabolism". Ergebnisse der Physiologie Biologischen Chemie und Experimentellen Pharmakologie. 59: 185–296. doi:10.1007/BF02269144. PMID 4865748. S2CID 43703938.
- ^ Iyengar, G.V.; Kollmer, W. E.; Bowen, H. J. M. (1978). The Elemental Composition of Human Tissues and Body Fluids. Weinheim, New York: Verlag Chemie. ISBN 978-0-89573-003-9.
- ^ Stelzer, R.; Lehmann, H .; Krammer, D.; Luttge, U. (1990). "X-Ray microprobe analysis of vacuoles of spruce needle mesophyll, endodermis and transfusion parenchyma cells at different seasons of the year". Botanica Acta. 103 (4): 415–423. doi:10.1111/j.1438-8677.1990.tb00183.x.
- ^ A b Shaul, O.; Hilgemann, D. W.; de-Almeida-Engler, J.; Van, M.M.; Inze, D.; Galili, G. (1999). "Cloning and characterization of a novel Mg(2+)/H(+) exchanger". EMBO Journal. 18 (14): 3973–3980. doi:10.1093/emboj/18.14.3973. PMC 1171473. PMID 10406802.
- ^ Thomas, R.C.; Coles, J. A.; Deitmer, J. W. (1991). "Homeostatic muffling". Příroda. 350 (6319): 564. Bibcode:1991Natur.350R.564T. doi:10.1038/350564b0. PMID 2017256. S2CID 4346618.
- ^ A b Berkowitz, G. A.; Wu, W. (1993). "Magnesium, potassium flux and photosynthesis". Výzkum hořčíku. 6 (3): 257–265. PMID 8292500.
- ^ A b Shaul, O. (2002). "Magnesium transport and function in plants: the tip of the iceberg". BioMetals. 15 (3): 309–323. doi:10.1023/A:1016091118585. PMID 12206396. S2CID 32535554.
- ^ Hmiel, S. P.; Snavely, M. D.; Florer, J. B.; Maguire, M. E.; Miller, C. G. (1989). "Magnesium transport in Salmonella typhimurium: genetic characterization and cloning of three magnesium transport loci". Journal of Bacteriology. 171 (9): 4742–4751. doi:10.1128/jb.171.9.4742-4751.1989. PMC 210275. PMID 2548998.
- ^ MacDiarmid, C.W.; Gardner, R. C. (1998). "Overexpression of the Saccharomyces cerevisiae magnesium transport system confers resistance to aluminum ion". J. Biol. Chem. 273 (3): 1727–1732. doi:10.1074/jbc.273.3.1727. PMID 9430719.
- ^ Wiesenberger, G.; Waldherr, M.; Schweyen, R. J. (1992). "The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo". J. Biol. Chem. 267 (10): 6963–6969. PMID 1551905.
- ^ Kaiser, W. M. (1987). "Effects of water deficit on photosynthetic capacity". Physiologia Plantarum. 71: 142–149. doi:10.1111/j.1399-3054.1987.tb04631.x.
- ^ Rao, I. M.; Sharp, R. E.; Boyer, J.S. (1987). "Leaf Phosphate Status, Photosynthesis, and Carbon Partitioning in Sugar Beet: III. Diurnal Changes in Carbon Partitioning and Carbon Export". Fyziologie rostlin. 92 (1): 29–36. doi:10.1104/pp.92.1.29. PMC 1062243. PMID 16667261.
- ^ Grunes, D. L.; Stout, P. R.; Brownwell, J.R. (1970). Grass tetany of ruminants. Advances in Agronomy. 22. pp. 332–374. doi:10.1016/S0065-2113(08)60272-2. ISBN 978-0-12-000722-6.
- ^ Paunier, L.; Radde, I. C.; Kooh, S.W.; Conen, P.E.; Fraser, D. (1968). "Primary hypomagnesemia with secondary hypocalcemia in an infant". Pediatrie. 41 (2): 385–402. PMID 5637791.
- ^ Weber S, Hoffmann K, Jeck N, Saar K, Boeswald M, Kuwertz-Broeking E, Meij II, Knoers NV, Cochat P, Suláková T, Bonzel KE, Soergel M, Manz F, Schaerer K, Seyberth HW, Reis A, Konrad M (2000). "Familial hypomagnesaemia with hypercalciuria and nephrocalcinosis maps to chromosome 3q27 and is associated with mutations in the PCLN-1 gene". European Journal of Human Genetics. 8 (6): 414–422. doi:10.1038/sj.ejhg.5200475. PMID 10878661.
- ^ Weber S, Schneider L, Peters M, Misselwitz J, Rönnefarth G, Böswald M, Bonzel KE, Seeman T, Suláková T, Kuwertz-Bröking E, Gregoric A, Palcoux JB, Tasic V, Manz F, Schärer K, Seyberth HW, Konrad M (2001). "Novel paracellin-1 mutations in 25 families with familial hypomagnesemia with hypercalciuria and nephrocalcinosis". Časopis Americké nefrologické společnosti. 12 (9): 1872–1881. PMID 11518780.
- ^ Chubanov V, Waldegger S, Mederos y Schnitzler M, Vitzthum H, Sassen MC, Seyberth HW, Konrad M, Gudermann T (2004). "Disruption of TRPM6/TRPM7 complex formation by a mutation in the TRPM6 gene causes hypomagnesemia with secondary hypocalcemia". Sborník Národní akademie věd Spojených států amerických. 101 (9): 2894–2899. Bibcode:2004PNAS..101.2894C. doi:10.1073/pnas.0305252101. PMC 365716. PMID 14976260.
- ^ Harrison’s Principles of Internal Medicine, Online Edition
- ^ Milo, Ron; Philips, Rob. „Buněčná biologie podle čísel: Jaké jsou koncentrace různých iontů v buňkách?“. book.bionumbers.org. Citováno 23. března 2017.
- ^ A b C d E F Cowan, J. A. (1995). J.A. Cowan (ed.). Introduction to the biological chemistry of magnesium. The Biological Chemistry of Magnesium. New York: VCH.
- ^ Romani, A. M. P.; Maguire, M. E. (2002). "Hormonal regulation of Mg2+ transport and homeostasis in eukaryotic cells". BioMetals. 15 (3): 271–283. doi:10.1023/A:1016082900838. PMID 12206393. S2CID 20835803.
- ^ Black, C. B.; Cowan, J.A. (1995). J.A. Cowan (ed.). "Magnesium-dependent enzymes in nucleic acid biochemistry". The Biological Chemistry of Magnesium. New York: VCH.
- ^ A b C Black, C.B.; Cowan, J. A. (1995). J.A. Cowan (ed.). "Magnesium-dependent enzymes in general metabolism". The Biological Chemistry of Magnesium. New York: VCH.
- ^ Cowan, J. A. (2002). "Structural and catalytic chemistry of magnesium-dependent enzymes". BioMetals. 15 (3): 225–235. doi:10.1023/A:1016022730880. PMID 12206389. S2CID 40446313.
- ^ Sperazza, J. M.; Spremulli, L. L. (1983). "Quantitation of cation binding to wheat germ ribosomes: influences on subunit association equilibria and ribosome activity". Výzkum nukleových kyselin. 11 (9): 2665–2679. doi:10.1093/nar/11.9.2665. PMC 325916. PMID 6856472.
- ^ Smith, R.L .; Thompson, L.J.; Maguire, M. E. (1995). "Cloning and characterization of MgtE, a putative new class of Mg2+ transporter from Bacillus firmus OF4". Journal of Bacteriology. 177 (5): 1233–1238. doi:10.1128/jb.177.5.1233-1238.1995. PMC 176728. PMID 7868596.
- ^ Robinson, Howard; Gao, Yi-Gui; Sanishvili, Ruslan; Joachimiak, Andrzej; Wang, Andrew H.-J. (15 April 2000). "Hexahydrated magnesium ions bind in the deep major groove and at the outer mouth of A-form nucleic acid duplexes". Výzkum nukleových kyselin. 28 (8): 1760–1766. doi:10.1093/nar/28.8.1760. PMC 102818. PMID 10734195.
- ^ Ebel, H .; Gunther, T. (1980). "Magnesium metabolism: a review". Journal of Clinical Chemistry and Clinical Biochemistry. 18 (5): 257–270. doi:10.1515/cclm.1980.18.5.257. PMID 7000968. S2CID 37427719.
- ^ Schlünzen, Frank; Zarivach, Raz; Harms, Jörg; Bashan, Anat; Tocilj, Ante; Albrecht, Renate; Yonath, Ada; Franceschi, François (2001). "Strukturální základ pro interakci antibiotik s centrem peptidyltransferázy v eubakteriích". Příroda. 413 (6858): 814–21. Bibcode:2001 Natur.413..814S. doi:10.1038/35101544. PMID 11677599. S2CID 205022511.
- ^ A b Maguire, M.E.; Cowan, J. A. (2002). "Chemie hořčíku a biochemie". BioMetals. 15 (3): 203–210. doi:10.1023/A:1016058229972. PMID 12206387. S2CID 31622669.
- ^ A b Tevelev, A.; Cowan, J. A. (1995). J.A. Cowan (ed.). Metal substitution as a probe of the biological chemistry of magnesium ion. The Biological Chemistry of Magnesium. New York: VCH.
- ^ A b Drakenberg, T. (1995). J. A. Cowan (ed.). Physical methods for studying the biological chemistry of magnesium. The Biological Chemistry of Magnesium. New York: VCH.
- ^ Raju, B .; Murphy, E.; Levy, L. A.; Hall, R. D.; London, R. E. (1989). "A fluorescent indicator for measuring cytosolic free magnesium". Am J Physiol Cell Physiol. 256 (3 Pt 1): C540–548. doi:10.1152/ajpcell.1989.256.3.C540. PMID 2923192.
- ^ Grubbs, R. D. (2002). "Intracellular magnesium and magnesium buffering". BioMetals. 15 (3): 251–259. doi:10.1023/A:1016026831789. PMID 12206391. S2CID 20873166.
- ^ Otten, P.A.; London, R.E.; Levy, L. A. (2001). "4-Oxo-4H-quinolizine-3-carboxylic acids as Mg2+ selective, fluorescent indicators". Biokonjugovaná chemie. 12 (2): 203–212. doi:10.1021/bc000087d. PMID 11312681.
- ^ Gunzel, D.; Schlue, W.-R. (2002). "Determination of [Mg2+]i - an update on the use of Mg2+-selective electrodes". BioMetals. 15 (3): 237–249. doi:10.1023/A:1016074714951. PMID 12206390. S2CID 27877817.
- ^ A b Hille, B. (1992). "2". Ionic channels of excitable membranes. Sunderland: Sinauer Associates Inc. ISBN 978-0-87893-322-8.
- ^ See Chapters 5 and 6 in Dean, J.R. (1997). Atomic Absorption and Plasma Spectroscopy. Chichester: John Wiley & Sons. ISBN 978-0-471-97255-6. for descriptions of the methodology as applied to analytical chemistry.
- ^ Hille, 1992. Chapter 11
- ^ Haynes, W. J.; Kung, C .; Saimi, Y .; Preston, R. R. (2002). "An exchanger-like protein underlies the large Mg2+ current in Paramecium". PNAS. 99 (24): 15717–15722. Bibcode:2002PNAS...9915717H. doi:10.1073/pnas.242603999. PMC 137782. PMID 12422021.
- ^ Warren, M. A.; Kucharski, L. M.; Veenstra, A.; Shi, L.; Grulich, P. F.; Maguire, M. E. (2004). "The CorA Mg2+ Transporter Is a Homotetramer". Journal of Bacteriology. 186 (14): 4605–4612. doi:10.1128/JB.186.14.4605-4612.2004. PMC 438605. PMID 15231793.
- ^ Gardner, R. C. (2003). "Genes for magnesium transport". Aktuální názor na biologii rostlin. 6 (3): 263–267. doi:10.1016/S1369-5266(03)00032-3. PMID 12753976.
- ^ A b C d Laing, W.; Greer, D.; Sun, O.; Beets, P.; Lowe, A.; Payn, T. (2000). "Physiological impacts of Mg deficiency in Pinus radiata: growth and photosynthesis". New Phytol. 146: 47–57. doi:10.1046/j.1469-8137.2000.00616.x.
- ^ A b Heenan, D.P.; Campbell, L.C. (1981). "Influence of potassium and manganese on growth and uptake of magnesium by soybeans (Glycine max (L.) Merr. cv Bragg". Rostlinná půda. 61 (3): 447–456. doi:10.1007/BF02182025. S2CID 12271923.
- ^ Hope, A. B.; Stevens, P. G. (1952). "Electrical potential differences in bean roots on their relation to salt uptake". Australian Journal of Scientific Research, Series B. 5: 335–343.
- ^ Section 8.5.2 in Marschner, 1995
- ^ Bui, D.M.; Gregan, J.; Jarosch, E.; Ragnini, A.; Schweyen, R. J. (1999). "The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane". Journal of Biological Chemistry. 274 (29): 20438–20443. doi:10.1074/jbc.274.29.20438. PMID 10400670.
- ^ Demmig, B.; Gimmler, H. (1979). "Effect of divalent cations on cation fluxes across the chloroplast envelope and on photosynthesis of intact chloroplasts". Zeitschrift für Naturforschung. 24C (3–4): 233–241. doi:10.1515/znc-1979-3-413. S2CID 42750442.
- ^ Huber, S.C.; Maury, W. J. (1980). "Effects of Magnesium on Intact Chloroplasts: I. EVIDENCE FOR ACTIVATION OF (SODIUM) POTASSIUM/PROTON EXCHANGE ACROSS THE CHLOROPLAST ENVELOPE". Fyziologie rostlin. 65 (2): 350–354. doi:10.1104/pp.65.2.350. PMC 440325. PMID 16661188.
- ^ Section 2.7 in Marschner, 1995
- ^ Section 3.3 in Marschner, 1995
- ^ Section 2.4 in Marschner, 1995
- ^ Scott, B. J.; Robson, A. D. (1990). "Distribution of magnesium in subterranean clover (Trifolium subterranean L.) in relation to supply". Australian Journal of Agricultural Research. 41 (3): 499–510. doi:10.1071/AR9900499.
- ^ Scott, B. J.; Robson, A. D. (1990b). "Changes in the content and form of magnesium in the first trifoliate leaf of subterranean clover under altered or constant root supply". Australian Journal of Agricultural Research. 41 (3): 511–519. doi:10.1071/AR9900511.
- ^ Fork, D.C. (1986). "The control by state transitions of the distribution of excitation energy in photosynthesis". Roční přehled fyziologie rostlin a molekulární biologie rostlin. 37: 335–361. doi:10.1146/annurev.arplant.37.1.335.
- ^ Gregory, R. P. F. (1989). Structure and function of the photosynthesising cell. Biochemistry of Photosynthesis. New York: John Wiley and Sons.
- ^ Lu YK, Chen YR, Yang CM, Ifuku K (1995). "Influence of Fe- and Mg-deficiency on the thylakoid membranes of a chlorophyll-deficient ch5 mutant of Arabidopsis thaliana". Botanický bulletin Academia Sinica. 36.
- ^ Deshaies, R. J.; Fish, L. E.; Jagendorf, A. T. (1984). "Permeability of Chloroplast Envelopes to Mg2+: Effects on Protein Synthesis". Fyziologie rostlin. 74 (4): 956–961. doi:10.1104/pp.74.4.956. PMC 1066800. PMID 16663541.
- ^ Gupta, A. S.; Berkowitz, G. A. (1989). "Development and Use of Chlorotetracycline Fluorescence as a Measurement Assay of Chloroplast Envelope-Bound Mg2+". Fyziologie rostlin. 89 (3): 753–761. doi:10.1104/pp.89.3.753. PMC 1055918. PMID 16666617.
- ^ Heldt, H.W.; Werdan, K.; Milovancev, M.; Geller, G. (1973). "Alkalization of the chloroplast stroma caused by light-dependent proton flux into the thylakoid space". Biochimica et Biophysica Acta (BBA) - bioenergetika. 314 (2): 224–241. doi:10.1016/0005-2728(73)90137-0. PMID 4747067.
- ^ Hind, G.; Nakatani, H. Y.; Izawa, S. (1974). "Light-Dependent Redistribution of Ions in Suspensions of Chloroplast Thylakoid Membranes". Sborník Národní akademie věd Spojených států amerických. 71 (4): 1484–1488. Bibcode:1974PNAS...71.1484H. doi:10.1073/pnas.71.4.1484. PMC 388254. PMID 4524652.
- ^ Bulychev, A. A.; Vredenberg, W. J. (1976). "Effect of ionophores A-23187 and nigericin on the light induced redistribution of magnesium potassium and hydrogen ions across the thylakoid membrane". Biochimica et Biophysica Acta. 449 (1): 48–58. doi:10.1016/0005-2728(76)90006-2. PMID 10009.
- ^ Krause, G. H. (1977). "Light-induced movement of magnesium ions in intact chloroplasts. Spectroscopic determination with Eriochrome Blue SE". Biochimica et Biophysica Acta (BBA) - bioenergetika. 460 (3): 500–510. doi:10.1016/0005-2728(77)90088-3. PMID 880298.
- ^ Portis, A. R. (1981). "Evidence of a Low Stromal Mg2+ Concentration in Intact Chloroplasts in the Dark: I. STUDIES WITH THE IONOPHORE A23187". Fyziologie rostlin. 67 (5): 985–989. doi:10.1104/pp.67.5.985. PMC 425814. PMID 16661806.
- ^ Ishijima, S.; Uchibori, A.; Takagi, H .; Maki, R.; Ohnishi, M. (2003). "Light-induced increase in free Mg2+ concentration in spinach chloroplasts: Measurement of free Mg2+ by using a fluorescent probe and intensity of stromal alkalinization". Archivy biochemie a biofyziky. 412 (1): 126–132. doi:10.1016/S0003-9861(03)00038-9. PMID 12646275.
- ^ A b Sharkey, T. D. (1998). A. Raghavendra (ed.). "Photosynthetic carbon reduction". Photosynthesis: A Comprehensive Treatise. Cambridge: Cambridge University Press: 111–122.
- ^ Section 8.5.6 of Marschner, 1995
- ^ Rengel, Z .; Robinson, D. L. (1989). "Competitive Al3+ Inhibition of Net Mg2+ Uptake by Intact Lolium multiflorum Roots : I. Kinetics". Fyziologie rostlin. 91 (4): 1407–1413. doi:10.1104/pp.91.4.1407. PMC 1062198. PMID 16667193.
- ^ Marschner, H. (1991). Y. Waisel; A. Eshel; U. Kafikfai (eds.). Root-induced changes in the availability of micronutrients in the rhizosphere. Kořeny rostlin: Skrytá polovina. New York: Marcel Dekker.
- ^ Dorenstouter, H.; Pieters, G.A.; Findenegg, G. R. (1985). "Distribution of magnesium between chloroplhyll and other photosynthetic functions in magnesium deficient 'sun' and 'shade' leaves of poplar". Journal of Plant Nutrition. 8 (12): 1088–1101. doi:10.1080/01904168509363409.
- ^ Wu, W.; Peters, J .; Berkowitz, G.A. (1991). "Surface Charge-Mediated Effects of Mg2+ on K+ Flux across the Chloroplast Envelope Are Associated with Regulation of Stromal pH and Photosynthesis". Fyziologie rostlin. 97 (2): 580–587. doi:10.1104/pp.97.2.580. PMC 1081046. PMID 16668438.
Reference
- Romani, Andrea M.P. (2013). "Chapter 4 Magnesium Homeostasis in Mammalian Cells". V Banci, Lucia (ed.). Metallomics and the Cell. Kovové ionty v biologických vědách. 12. Springer. doi:10.1007/978-94-007-5561-l_4 (neaktivní 2020-10-22). ISBN 978-94-007-5560-4.CS1 maint: DOI neaktivní od října 2020 (odkaz) elektronická kniha ISBN 978-94-007-5561-1 ISSN 1559-0836 elektronický-ISSN 1868-0402
- Findling, R. L.; Maxwell, K; Scotese-Wojtila, L; Huang, J; Yamashita, T; Wiznitzer, M (1997). "High-dose pyridoxine and magnesium administration in children with autistic disorder: an absence of salutary effects in a double-blind, placebo-controlled study". J Autism Dev Disord. 27 (4): 467–478. doi:10.1023/A:1025861522935. PMID 9261669. S2CID 39143708.
- Green, V.; Pituch, K.; Itchon, J.; Choi, A.; O'Reilly, M.; Sigafoos, J. (2006). "Internet Survey of Treatments Used by Parents of Children with Autism". Research in Developmental Disabilities. 27 (1): 70–84. doi:10.1016/j.ridd.2004.12.002. PMID 15919178.
- Lelord, G.; Muh, JP; Barthelemy, C; Martineau, J; Garreau, B; Callaway, E (1981). "Effects of pyridoxine and magnesium on autistic symptoms--initial observations". J Autism Dev Disord. 11 (2): 219–230. doi:10.1007/BF01531686. PMID 6765503. S2CID 7898722.
- Martineau, J.; et al. (1985). "Vitamin B6, magnesium, and combined B6-Mg: therapeutic effects in childhood autism." Biol". Psychiatrie. 20 (5): 467–478. doi:10.1016/0006-3223(85)90019-8. PMID 3886023. S2CID 631153.
- Tolbert, L.; Haigler, T; Waits, MM; Dennis, T (1993). "Brief report: lack of response in an autistic population to a low dose clinical trial of pyridoxine plus magnesium". J Autism Dev Disord. 23 (1): 193–199. doi:10.1007/BF01066428. PMID 8463199. S2CID 21450498.
- Mousain-Bosc M, Roche M, Polge A, Pradal-Prat D, Rapin J, Bali JP (Mar 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. I. Attention deficit hyperactivity disorders". Magnes. Res. 19 (1): 46–52. PMID 16846100.
- Mousain-Bosc M, Roche M, Polge A, Pradal-Prat D, Rapin J, Bali JP (Mar 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. II. Pervasive developmental disorder-autism". Magnes. Res. 19 (1): 53–62. PMID 16846101.
externí odkazy
Tento článek je Použití externí odkazy nemusí dodržovat zásady nebo pokyny Wikipedie. (Ledna 2018) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
- Magnesium Deficiency
- List of foods rich in Magnesium
- The Magnesium Website - Includes full text papers and textbook chapters by leading magnesium authorities Mildred Seelig, Jean Durlach, Burton M. Altura and Bella T. Altura. Links to over 300 articles discussing magnesium and magnesium deficiency.
- Referenční dietní příjem
- Healing Thresholds - description of research studies regarding supplementation with magnesium and other therapies for autism
