Složení lidského těla - Composition of the human body
Složení těla lze analyzovat různými způsoby. To lze provést z hlediska chemické prvky přítomné, nebo podle molekulárního typu, např. voda, protein, tuky (nebo lipidy ), hydroxylapatit (v kostech), sacharidy (jako glykogen a glukóza ) a DNA. Pokud jde o typ tkáně, tělo lze analyzovat na vodu, tuk, pojivová tkáň, sval Co se týče buněčného typu, tělo obsahuje stovky různých typů buněk, ale zejména těch největších číslo buněk obsažených v lidském těle (i když to není největší množství buněk) nejsou lidské buňky, ale bakterie sídlící v normálním lidském gastrointestinálním traktu.
Elementy
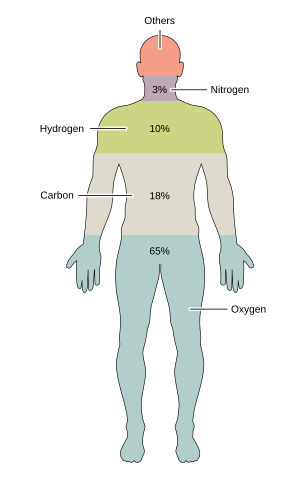 | Živel | Symbol | procentní hmotnost | procenta atomů |
| Kyslík | Ó | 65.0 | 24.0 | |
| Uhlík | C | 18.5 | 12.0 | |
| Vodík | H | 9.5 | 62.0 | |
| Dusík | N | 3.2 | 1.1 | |
| Vápník | Ca. | 1.5 | 0.22 | |
| Fosfor | P | 1.0 | 0.22 | |
| Draslík | K. | 0.4 | 0.03 | |
| Síra | S | 0.3 | 0.038 | |
| Sodík | Na | 0.2 | 0.037 | |
| Chlór | Cl | 0.2 | 0.024 | |
| Hořčík | Mg | 0.1 | 0.015 | |
| Všichni ostatní | < 0.1 | < 0.3 |

Téměř 99% hmotnosti lidského těla tvoří šest prvků: kyslík, uhlík, vodík, dusík, vápník, a fosfor. Pouze asi 0,85% se skládá z dalších pěti prvků: draslík, síra, sodík, chlór, a hořčík. Všech 11 je pro život nezbytných. Zbývající prvky jsou stopové prvky, z nichž je více než tucet považováno na základě dobrých důkazů za nezbytné pro život.[1] Veškerá hmotnost stopových prvků dohromady (méně než 10 gramů pro lidské tělo) se nepřičítá k tělesné hmotnosti hořčíku, nejméně obvyklé z 11 stopových prvků.
Další prvky
Ne všechny prvky, které se v lidském těle nacházejí ve stopových množstvích, hrají v životě roli. Některé z těchto prvků jsou považovány za obyčejné běžné kontaminanty bez funkce (příklady: cesium, titan), zatímco mnoho dalších je považováno za aktivní toxiny v závislosti na množství (kadmium, rtuť, olovo, radioaktiva). U lidí arsen je toxický a jeho hladiny v potravinách a doplňky stravy jsou pečlivě sledovány, aby se snížil nebo vyloučil jeho příjem[2]
Některé prvky (křemík, bór, nikl, vanad) pravděpodobně potřebují také savci, ale v mnohem menších dávkách. Brom je hojně používán některými (i když ne všemi) nižšími[je zapotřebí objasnění ] organismy a oportunisticky v eosinofily u lidí. Jedna studie ukázala, že k syntéze kolagenu IV u lidí je nezbytný brom.[3] Fluor je používán řadou rostlin k výrobě toxinů (viz tento prvek), ale u lidí funguje pouze jako lokální (lokální) tvrdidlo ve zubní sklovině, a nikoli v zásadní biologické roli.[4]
Seznam elementárního složení
Průměrná hmotnost 70 kg (150 lb) dospělého lidského těla obsahuje přibližně 7×1027 atomy a obsahuje alespoň zjistitelné stopy 60 chemické prvky.[5] Asi 29 z těchto prvků hraje aktivní pozitivní roli v životě a zdraví lidí.[6]
Relativní množství každého prvku se liší podle jednotlivce, zejména kvůli rozdílům v podílu tuku, svalů a kostí v jejich těle. Osoby s více tuky budou mít vyšší podíl uhlíku a nižší podíl většiny ostatních prvků (podíl vodíku bude přibližně stejný). Čísla v tabulce jsou průměry různých čísel uváděných různými odkazy.
Průměrný dospělý lidský organismus je ~ 53% vody.[7] To se podstatně liší podle věku, pohlaví a adipozity. U velkého vzorku dospělých všech věkových skupin a obou pohlaví bylo zjištěno, že hmotnostní podíl vody je 48 ± 6% u žen a 58 ± 8% vody u mužů.[8] Voda je ~ 11% vodíku Hmotnost ale ~ 67% vodíku atomové procento a tato čísla spolu s doplňkovými procentními čísly kyslíku ve vodě jsou největšími přispěvateli k celkovým údajům o celkové hmotnosti a atomovém složení. Vzhledem k obsahu vody obsahuje lidské tělo více kyslíku podle hmotnosti než kterýkoli jiný prvek, ale více vodíku podle atomové frakce než kterýkoli prvek.
Prvky uvedené níže jako „Esenciální u lidí“ jsou prvky uvedené v (USA) Úřad pro kontrolu potravin a léčiv jako základní živiny,[9] stejně jako šest dalších prvků: kyslík, uhlík, vodík a dusík (základní stavební kameny života na Zemi), síra (nezbytná pro všechny buňky) a kobalt (nezbytná složka vitaminu B12). Prvky uvedené jako „Možná“ nebo „Pravděpodobně“ zásadní jsou ty, které cituje Národní rada pro výzkum (USA) jako prospěšné pro lidské zdraví a možná nebo pravděpodobně zásadní.[10]
| Protonové číslo | Živel | Frakce hmotnosti[11][12][13][14][15][16] | Hmotnost (kg)[17] | Atomové procento | Nezbytné u lidí[18] | Negativní účinky přebytku | Skupina |
|---|---|---|---|---|---|---|---|
| 8 | Kyslík | 0.65 | 43 | 24 | Ano (např. Voda, akceptor elektronů)[19] | Reaktivní formy kyslíku | 16 |
| 6 | Uhlík | 0.18 | 16 | 12 | Ano[19] (organické sloučeniny) | 14 | |
| 1 | Vodík | 0.10 | 7 | 62 | Ano[19] (např. voda ) | 1 | |
| 7 | Dusík | 0.03 | 1.8 | 1.1 | Ano[19] (např. DNA a aminokyseliny ) | 15 | |
| 20 | Vápník | 0.014 | 1.0 | 0.22 | Ano[19][20][21] (např. Kalmodulin a Hydroxylapatit v kosti ) | 2 | |
| 15 | Fosfor | 0.011 | 0.78 | 0.22 | Ano[19][20][21] (např. DNA a fosforylace ) | Hyperfosfatémie | 15 |
| 19 | Draslík | 2.0×10−3 | 0.14 | 0.033 | Ano[19][20] (např. Na+/ K.+-ATPase ) | 1 | |
| 16 | Síra | 2.5×10−3 | 0.14 | 0.038 | Ano[19] (např. Cystein, Methionin, Biotin, Thiamin ) | 16 | |
| 11 | Sodík | 1.5×10−3 | 0.10 | 0.037 | Ano[20] (např. Na+/ K.+-ATPase ) | 1 | |
| 17 | Chlór | 1.5×10−3 | 0.095 | 0.024 | Ano[20][21] (např. Cl-transportující ATPáza ) | 17 | |
| 12 | Hořčík | 500×10−6 | 0.019 | 0.0070 | Ano[20][21] (např. vazba na ATP a další nukleotidy ) | 2 | |
| 26 | Žehlička * | 60×10−6 | 0.0042 | 0.00067 | Ano[20][21] (např. Hemoglobin, Cytochromy ) | 8 | |
| 9 | Fluor | 37×10−6 | 0.0026 | 0.0012 | Ano (AUS, NZ ),[22] Ne (USA, EU),[23][24] Možná (SZO )[25] | toxický ve vysokých množstvích | 17 |
| 30 | Zinek | 32×10−6 | 0.0023 | 0.00031 | Ano[20][21] (např. Proteiny se zinkovým prstem ) | 12 | |
| 14 | Křemík | 20×10−6 | 0.0010 | 0.0058 | Možná[10] | 14 | |
| 31 | Gallium | 4.9×10−6 | ? | 0.0007 | Ne | 13 | |
| 37 | Rubidium | 4.6×10−6 | 0.00068 | 0.000033 | Ne | 1 | |
| 38 | Stroncium | 4.6×10−6 | 0.00032 | 0.000033 | —— | 2 | |
| 35 | Bróm | 2.9×10−6 | 0.00026 | 0.000030 | —— | 17 | |
| 82 | Vést | 1.7×10−6 | 0.00012 | 0.0000045 | Ne | toxický | 14 |
| 29 | Měď | 1×10−6 | 0.000072 | 0.0000104 | Ano[20][21] (např. bílkoviny mědi ) | toxický ve vyšších množstvích | 11 |
| 13 | Hliník | 870×10−9 | 0.000060 | 0.000015 | Ne | 13 | |
| 48 | Kadmium | 720×10−9 | 0.000050 | 0.0000045 | Ne | toxický | 12 |
| 58 | Cer | 570×10−9 | 0.000040 | Ne | |||
| 56 | Baryum | 310×10−9 | 0.000022 | 0.0000012 | Ne | toxický ve vyšších množstvích | 2 |
| 50 | Cín | 240×10−9 | 0.000020 | 6.0×10−7 | Ne | 14 | |
| 53 | Jód | 160×10−9 | 0.000020 | 7.5×10−7 | Ano[20][21] (např. tyroxin, trijodtyronin ) | 17 | |
| 22 | Titan | 130×10−9 | 0.000020 | Ne | 4 | ||
| 5 | Bor | 690×10−9 | 0.000018 | 0.0000030 | Pravděpodobně[10][26] | 13 | |
| 34 | Selen | 190×10−9 | 0.000015 | 4.5×10−8 | Ano[20][21] | toxický ve vyšších množstvích | 16 |
| 28 | Nikl | 140×10−9 | 0.000015 | 0.0000015 | Pravděpodobně[10][26] | toxický ve vyšších množstvích | 10 |
| 24 | Chrom | 24×10−9 | 0.000014 | 8.9×10−8 | Ano[20][21] | 6 | |
| 25 | Mangan | 170×10−9 | 0.000012 | 0.0000015 | Ano[20][21] (např. Mn-SOD ) | 7 | |
| 33 | Arsen | 260×10−9 | 0.000007 | 8.9×10−8 | Ne[2] | toxický | 15 |
| 3 | Lithium | 31×10−9 | 0.000007 | 0.0000015 | Ano (vzájemně souvisí s funkcemi několika enzymy, hormony a vitamíny ) | toxický ve vyšších množstvích | 1 |
| 80 | Rtuť | 190×10−9 | 0.000006 | 8.9×10−8 | Ne | toxický | 12 |
| 55 | Cesium | 21×10−9 | 0.000006 | 1.0×10−7 | Ne | 1 | |
| 42 | Molybden | 130×10−9 | 0.000005 | 4.5×10−8 | Ano[20][21] (např oxotransferázy molybdenu, Xanthinoxidáza a Siřičitan oxidáza ) | 6 | |
| 32 | Germanium | 5×10−6 | Ne | 14 | |||
| 27 | Kobalt | 21×10−9 | 0.000003 | 3.0×10−7 | Ano (kobalamin, B12)[27][28] | 9 | |
| 51 | Antimon | 110×10−9 | 0.000002 | Ne | toxický | 15 | |
| 47 | stříbrný | 10×10−9 | 0.000002 | Ne | 11 | ||
| 41 | Niob | 1600×10−9 | 0.0000015 | Ne | 5 | ||
| 40 | Zirkonium | 6×10−6 | 0.000001 | 3.0×10−7 | Ne | 4 | |
| 57 | Lanthan | 1370×10−9 | 8×10−7 | Ne | |||
| 52 | Telur | 120×10−9 | 7×10−7 | Ne | 16 | ||
| 39 | Yttrium | 6×10−7 | Ne | 3 | |||
| 83 | Vizmut | 5×10−7 | Ne | 15 | |||
| 81 | Thalium | 5×10−7 | Ne | vysoce toxický | 13 | ||
| 49 | Indium | 4×10−7 | Ne | 13 | |||
| 79 | Zlato | 3×10−9 | 2×10−7 | 3.0×10−7 | Ne | případně nepotažené nanočástice genotoxický[29][30][31] | 11 |
| 21 | Scandium | 2×10−7 | Ne | 3 | |||
| 73 | Tantal | 2×10−7 | Ne | 5 | |||
| 23 | Vanadium | 260×10−9 | 1.1×10−7 | 1.2×10−8 | Možná[10] (doporučený osteo-metabolický (kostní) růstový faktor) | 5 | |
| 90 | Thorium | 1×10−7 | Ne | toxický, radioaktivní | |||
| 92 | Uran | 1×10−7 | 3.0×10−9 | Ne | toxický, radioaktivní | ||
| 62 | Samarium | 5.0×10−8 | Ne | ||||
| 74 | Wolfram | 2.0×10−8 | Ne | 6 | |||
| 4 | Berýlium | 3.6×10−8 | 4.5×10−8 | Ne | toxický ve vyšších množstvích | 2 | |
| 88 | Rádium | 3×10−14 | 1×10−17 | Ne | toxický, radioaktivní | 2 | |
| 71 | Lutetium | Možná | toxický ve vyšších množstvích | 4 |
* Železo = ~ 3 G u mužů, ~ 2,3 g u žen
Z 94 přirozeně se vyskytujících chemických prvků je 61 uvedeno v tabulce výše. Ze zbývajících 33 není známo, kolik se jich vyskytuje v lidském těle.
Většina prvků potřebných pro život je relativně běžné v zemské kůře. Hliník, třetí nejběžnější prvek v zemská kůra (po kyslík a křemík ), v živých buňkách neslouží žádné funkci, ale je toxický ve velkém množství, v závislosti na jeho fyzikálních a chemických formách a velikosti, trvání, frekvenci expozice a způsobu, jakým byl absorbován lidským tělem.[32] Transferriny může vázat hliník.[33]
Periodická tabulka
| H | On | |||||||||||||||||
| Li | Být | B | C | N | Ó | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K. | Ca. | Sc | Ti | PROTI | Cr | Mn | Fe | Spol | Ni | Cu | Zn | Ga | Ge | Tak jako | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Pozn | Mo | Tc | Ru | Rh | Pd | Ag | CD | v | Sn | Sb | Te | Já | Xe | |
| Čs | Ba | Los Angeles | * | Hf | Ta | Ž | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | Na | Rn |
| Fr. | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Odpoledne | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Čt | Pa | U | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | ||||
| Legenda: | ||
|---|---|---|
| ||
| ||
| ||
| ||
| ||
| ||
|
Molekuly
Složení lidského těla je vyjádřeno chemickými látkami:
- Voda
- Proteiny - včetně těch z vlasy, pojivová tkáň, atd.
- Tuky (nebo lipidy )
- Hydroxyapatit v kostech
- Sacharidy jako glykogen a glukóza
- DNA
- Rozpuštěný anorganický ionty jako sodík, draslík, chlorid, hydrogenuhličitan, fosfát
- Plyny jako kyslík, oxid uhličitý, oxid dusíku, vodík, kysličník uhelnatý, acetaldehyd, formaldehyd, methanthiol. Ty mohou být rozpuštěny nebo přítomny v plynech v plíce nebo střeva. Etan a pentan jsou produkovány volnými radikály kyslíku.[36]
- Mnoho dalších malých molekul, jako např aminokyseliny, mastné kyseliny, nukleové báze, nukleosidy, nukleotidy, vitamíny, kofaktory.
- Volné radikály jako superoxid, hydroxyl, a hydroperoxyl.
The složení lidského těla lze zobrazit na atomový a molekulární měřítko, jak je uvedeno v tomto článku.
Odhadovaný hrubý molekulární obsah typické lidské buňky o velikosti 20 mikrometrů je následující:[37]
| Molekula | Procento mše | Mol. Hmotnost (dalton) | Molekuly | Procento molekul |
|---|---|---|---|---|
| Voda | 65 | 18 | 1.74×1014 | 98.73 |
| jiný Anorganické látky | 1.5 | N / A | 1.31×1012 | 0.74 |
| Lipidy | 12 | N / A | 8.4×1011 | 0.475 |
| jiný Organické | 0.4 | N / A | 7.7×1010 | 0.044 |
| Protein | 20 | N / A | 1.9×1010 | 0.011 |
| RNA | 1.0 | N / A | 5×107 | 3×10−5 |
| DNA | 0.1 | 1×1011 | 46* | 3×10−11 |
Papírové kapesníky
Složení těla lze také vyjádřit pomocí různých druhů materiálů, například:
- Sval
- Tlustý
- Kost a zuby
- Nervová tkáň (Mozek a nervy )
- Hormony
- Pojivová tkáň
- Tělní tekutiny (krev, lymfy, Moč )
- Obsah zažívací trakt, počítaje v to střevní plyn
- Vzduch v plicích
- Epitel
Složení podle typu buňky
Existuje mnoho druhů bakterie a další mikroorganismy kteří žijí na zdravém lidském těle nebo uvnitř něj. Ve skutečnosti je 90% buněk v (nebo na) lidském těle počet mikrobů[38][39] (mnohem méně podle hmotnosti nebo objemu). Některé z těchto symbionty jsou nezbytné pro naše zdraví. Tito, kteří lidem nepomohou ani nepoškodí, se nazývají komenzální organismy.
Viz také
- Seznam orgánů lidského těla
- Hydrostatické vážení
- Dietní prvek
- Složení krve
- Seznam složek lidské krve
- Složení těla
- Hojnost prvků v zemské kůře
- Množství chemických prvků
Reference
- ^ M.A. Zoroddu; J. Aashet; G. Crisponi; S. Medici; M. Peana; V.M. Nurchi (červen 2019). „Základní kovy pro člověka: stručný přehled“. Journal of Anorganic Biochemistry. 195: 120–129. doi:10.1016 / j.jinorgbio.2019.03.013. PMID 30939379.
- ^ A b „Arsen v potravinách a doplňcích stravy“. US Food and Drug Administration. 22. května 2019. Citováno 20. srpna 2019.
- ^ McCall AS, Cummings CF, Bhave G, Vanacore R, Page-McCaw A, Hudson BG (2014). „Brom je základním stopovým prvkem pro montáž lešení kolagenu IV při vývoji a architektuře tkání“. Buňka. 157 (6): 1380–92. doi:10.1016 / j.cell.2014.05.009. PMC 4144415. PMID 24906154.
- ^ Nelson, Lehninger, Cox (2008). Lehningerovy principy biochemie (5. vydání). Macmillana.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Kolik atomů je v lidském těle?
- ^ "Ultratrace minerály". Autoři: Nielsen, Forrest H. USDA, ARS Zdroj: Moderní výživa ve zdraví a nemocech / redaktoři, Maurice E. Shils ... et al. Baltimore: Williams & Wilkins, c. 1999, s. 283-303. Datum vydání: 1999 URI: [1]
- ^ Použití WP: CALC pro průměr prostředků pro muže a ženy, protože obě skupiny jsou přibližně stejně velké
- ^ Viz tabulka 1. tady
- ^ „Pokyny pro průmysl: Průvodce označováním potravin 14. Příloha F“. US Food and Drug Administration. 1. ledna 2013. Archivovány od originál dne 4. dubna 2017.
- ^ A b C d E Institute of Medicine (29. září 2006). Referenční dietní příjem: Základní průvodce požadavky na živiny. Národní akademie Press. 313–19, 415–22. ISBN 978-0-309-15742-1. Citováno 21. června 2016.
- ^ Thomas J. Glover, společnost, Kapesní ref, 3. vyd. (Littleton: Sequoia, 2003), s. 324 (LCCN 2002-91021 ), v kterém
- ^ Turn uvádí Geigy Scientific Tables, Ciba-Geigy Limited, Basilej, Švýcarsko, 1984.
- ^ Chang, Raymond (2007). Chemistry, deváté vydání. McGraw-Hill. p. 52. ISBN 978-0-07-110595-8.
- ^ "Elementární složení lidského těla" Archivováno 2018-12-18 na Wayback Machine Ed Uthman, MD Citováno 17. června 2016
- ^ Frausto Da Silva, J. J. R; Williams, R. J. P (2001-08-16). Biologická chemie prvků: Anorganická chemie života. ISBN 9780198508489.
- ^ Zumdahl, Steven S. a Susan A. (2000). Chemistry, Páté vydání. Společnost Houghton Mifflin. p. 894. ISBN 978-0-395-98581-6.)
- ^ Emsley, John (25. srpna 2011). Nature's Building Blocks: A-Z Guide to the Elements. OUP Oxford. p. 83. ISBN 978-0-19-960563-7. Citováno 17. června 2016.
- ^ Neilsen, citováno
- ^ A b C d E F G h Salm, Sarah; Allen, Deborah; Nester, Eugene; Anderson, Denise (9. ledna 2015). Nesterova mikrobiologie: lidská perspektiva. p. 21. ISBN 978-0-07-773093-2. Citováno 19. června 2016.
- ^ A b C d E F G h i j k l m n Podvýbor pro desáté vydání Rady pro doporučené stravovací dávky, potraviny a výživu; Komise pro biologické vědy, Národní rada pro výzkum (1. února 1989). "9-10". Doporučené dietní příspěvky: 10. vydání. Národní akademie Press. ISBN 978-0-309-04633-6. Citováno 18. června 2016.
- ^ A b C d E F G h i j k l Kodex federálních předpisů, hlava 21: Potraviny a drogy, kapitola 1, podkapitola B, část 101, hlava A, § 101,9 (c) (8) (iv)
- ^ Australian National Health and Medical Research Council (NHMRC) and New Zealand Ministry of Health (MoH)
- ^ „Fluorid v pitné vodě: přehled problémů s fluorací a regulací“
- ^ „Vědecké stanovisko k referenčním hodnotám výživy pro fluorid“ (PDF). Deník EFSA. 11 (8): 3332. 2013. doi:10.2903 / j.efsa.2013.3332. ISSN 1831-4732.
- ^ WHO / SDE / WSH / 03.04 / 96 „Fluorid v pitné vodě“
- ^ A b Bezpečné horní hladiny pro vitamíny a minerály (2003), bór str. 164-71, nikl str. 225-31, EVM, Food Standards Agency, UK ISBN 1-904026-11-7
- ^ Yamada, Kazuhiro (2013). „Kobalt: jeho role ve zdraví a nemocech“. Vztahy mezi ionty základních kovů a lidskými chorobami. Kovové ionty v biologických vědách. 13. str. 295–320. doi:10.1007/978-94-007-7500-8_9. ISBN 978-94-007-7499-5. ISSN 1559-0836. PMID 24470095.
- ^ Banci, Lucia (18. dubna 2013). Metallomics and the Cell. Springer Science & Business Media. 333–368. ISBN 978-94-007-5561-1. Citováno 19. června 2016.
- ^ Fratoddi, Ilaria; Venditti, Iole; Cametti, Cesare; Russo, Maria Vittoria (2015). „Jak toxické jsou nanočástice zlata? Nejmodernější“. Nano výzkum. 8 (6): 1771–1799. doi:10.1007 / s12274-014-0697-3. hdl:11573/780610. ISSN 1998-0124. S2CID 84837060.
- ^ „Vědecké stanovisko k přehodnocení zlata (E 175) jako potravinářské přídatné látky“. Deník EFSA. 14 (1): 4362. 2016. doi:10.2903 / j.efsa.2016.4362. ISSN 1831-4732.
- ^ Hillyer, Julián F .; Albrecht, Ralph M. (2001). „Gastrointestinální persorpce a tkáňová distribuce různě velkých nanočástic koloidního zlata“. Journal of Pharmaceutical Sciences. 90 (12): 1927–1936. doi:10,1002 / jps.1143. ISSN 0022-3549. PMID 11745751.
- ^ Willhite, Calvin C .; Karyakina, Nataliya A .; Yokel, Robert A .; Yenugadhati, Nagarajkumar; Wisniewski, Thomas M .; Arnold, Ian M.F .; Momoli, Franco; Krewski, Daniel (18.09.2014). „Systematický přehled možných zdravotních rizik, která představují farmaceutické, pracovní a spotřebitelské expozice kovovému a nanorozsahovému hliníku, oxidům hlinitým, hydroxidu hlinitému a jeho rozpustným solím“. Kritické recenze v toxikologii. 44 (sup4): 1–80. doi:10.3109/10408444.2014.934439. ISSN 1040-8444. PMC 4997813. PMID 25233067.
- ^ Mizutani, K .; Mikami, B .; Aibara, S .; Hirose, M. (2005). "Struktura ovotransferrinu vázaného na hliník v rozlišení 2,15 Å". Acta Crystallographica oddíl D. 61 (12): 1636–42. doi:10.1107 / S090744490503266X. PMID 16301797.
- ^
- Ultratrace minerály. Autoři: Nielsen, Forrest H. USDA, ARS Zdroj: Moderní výživa ve zdraví a nemoci / redaktoři, Maurice E. Shils ... et al. Baltimore: Williams & Wilkins, c. 1999, str. 283-303. Datum vydání: 1999 URI: [2]
- ^ Daumann, Lena J. (25. dubna 2019). „Essential and Ubiquitous: The Emergence of Lanthanide Metallobiochemistry“. Angewandte Chemie International Edition. doi:10,1002 / anie.201904090. Citováno 15. června 2019.
- ^ Douglas Fox, "Rychlost života", Nový vědec, Č. 2419, 1. listopadu 2003.
- ^ Freitas Jr., Robert A. (1999). Nanomedicína. Landes Bioscience. Tabulky 3–1 a 3–2. ISBN 978-1-57059-680-3.
- ^ Glausiusz, Josie. „Vaše tělo je planeta“. Citováno 2007-09-16.
- ^ Wenner, Melinda. „Lidé přenášejí více bakteriálních buněk než lidské“. Citováno 2010-10-09.
