Siřičitan oxidáza - Sulfite oxidase
| sulfit oxidáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
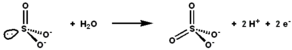 Sulfit oxidáza katalyzuje oxidačně-redukční reakci siřičitanu a vody za vzniku síranu. | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.8.3.1 | ||||||||
| Číslo CAS | 9029-38-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Siřičitan oxidáza (ES 1.8.3.1 ) je enzym v mitochondrie ze všech eukaryoty, s výjimkou kvasinek.[Citace je zapotřebí ] To oxiduje siřičitan na síran a prostřednictvím cytochrom c, převádí vyrobené elektrony do elektronový transportní řetězec, umožňující generování ATP v oxidační fosforylace.[5][6][7] Toto je poslední krok v metabolismu síra - obsahující sloučeniny a síran se vylučuje.
Sulfit oxidáza je metaloenzym, který využívá a molybdopterin kofaktor a a heme skupina (v případě zvířat). Je to jeden z cytochromy b5 a patří do nadrodiny enzymů oxotransferázy molybdenu to také zahrnuje DMSO reduktáza, xanthinoxidáza, a nitrit reduktáza.
U savců je hladina exprese siřičitan oxidázy vysoká v játrech, ledvinách a srdci a velmi nízká ve slezině, mozku, kosterním svalu a krvi.
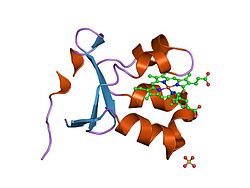
Struktura
Jako homodimer, sulfit oxidáza obsahuje dvě identické podjednotky s N-terminál doména a C-terminál doména. Tyto dvě domény jsou propojeny deseti aminokyseliny vytvoření smyčky. N-terminální doména má heme kofaktor se třemi sousedními antiparalelními beta listy a pět alfa helixy. C-terminální doména hostí molybdopterinový kofaktor, který je obklopen třinácti beta listy a třemi alfa helixy. The molybdopterin kofaktor má Mo (VI) centrum, které je navázáno na síru z cystein, en-dithiolát z pyranopterinu a dva terminální kyslíky. Právě v tomto centru molybdenu probíhá katalytická oxidace siřičitanu.
Aktivní stránka a mechanismus
 Navrhovaný mechanismus oxidace siřičitanu na síran sulfitoxidázou. |
Aktivní místo sulfitoxidázy obsahuje molybdopterin kofaktor a podporuje molybden v jeho nejvyšším oxidačním stavu, +6 (MoVI). V oxidovaném stavu enzymu je molybden koordinován cysteinthiolátem, kterým je dithiolen skupina molybdopterinu a dva koncové atomy kyslíku (oxos ). Po reakci se siřičitanem se jeden atom kyslíku přenese na siřičitan za vzniku síranu a centrum molybdenu se redukuje dvěma elektrony na MoIV. Voda pak vytěsňuje síran a odstranění dvou protonů (H+) a dva elektrony (např−) vrátí aktivní web do původního stavu. Klíčovým rysem tohoto enzymu pro přenos atomu kyslíku je to, že přenášený atom kyslíku pochází z vody, nikoli z dioxygen (Ó2).
Nedostatek
K metabolizaci aminokyselin obsahujících síru, cysteinu a methionin v potravinách. Nedostatek funkční sulfitoxidázy způsobuje onemocnění známé jako nedostatek sulfitoxidázy. Toto vzácné, ale smrtelné onemocnění způsobuje neurologické poruchy, mentální retardaci, fyzické deformity, degradaci mozku a smrt. Důvody pro nedostatek funkční sulfitoxidázy zahrnují a genetický vada, která vede k absenci a molybdopterin kofaktor a bodové mutace v enzymu.[8] Mutace G473D zhoršuje dimerizaci a katalýzu v lidské sulfit oxidáze.[9][10]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000139531 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000049858 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ D'Errico G, Di Salle A, La Cara F, Rossi M, Cannio R (leden 2006). „Identifikace a charakterizace nové bakteriální sulfitoxidázy bez domény vázající hem z Deinococcus radiodurans“. J. Bacteriol. 188 (2): 694–701. doi:10.1128 / JB.188.2.694-701.2006. PMC 1347283. PMID 16385059.
- ^ Tan WH, Eichler FS, Hoda S, Lee MS, Baris H, Hanley CA, Grant PE, Krishnamoorthy KS, Shih VE (září 2005). „Izolovaný nedostatek siřičitan oxidázy: kazuistika s novou mutací a přehled literatury“. Pediatrie. 116 (3): 757–66. doi:10.1542 / peds.2004-1897. PMID 16140720. S2CID 6506338.
- ^ Cohen HJ, Betcher-Lange S, Kessler DL, Rajagopalan KV (prosinec 1972). "Hepatic sulfite oxidase. Shodnost v mitochondriích protetických skupin a aktivity". J. Biol. Chem. 247 (23): 7759–66. PMID 4344230.
- ^ Karakas E, Kisker C (listopad 2005). "Strukturální analýza missense mutací způsobujících izolovaný nedostatek siřičitan oxidázy". Daltonské transakce (21): 3459–63. doi:10,1039 / b505789m. PMID 16234925.
- ^ Wilson HL, Wilkinson SR, Rajagopalan KV (únor 2006). „G473D mutace zhoršuje dimerizaci a katalýzu v lidské sulfit oxidáze“. Biochemie. 45 (7): 2149–60. doi:10.1021 / bi051609l. PMID 16475804.
- ^ Feng C, Tollin G, Enemark JH (květen 2007). "Siřičitany oxidující enzymy". Biochim. Biophys. Acta. 1774 (5): 527–39. doi:10.1016 / j.bbapap.2007.03.006. PMC 1993547. PMID 17459792.
Další čtení
- Kisker, C. „Sulfite oxidase“, Messerschimdt, A .; Huber, R .; Poulos, T .; Wieghardt, K .; eds. Příručka metaloproteinů, díl 2; John Wiley and Sons, Ltd: New York, 2002
- Feng C, Wilson HL, Hurley JK a kol. (2003). "Zásadní role konzervovaného argininu 160 při intramolekulárním přenosu elektronů v lidské sulfit oxidáze". Biochemie. 42 (42): 12235–42. doi:10.1021 / bi0350194. PMID 14567685.
- Lee HF, Mak BS, Chi CS a kol. (2002). "Nová mutace u novorozence izolovaného deficitu siřičitan oxidázy". Neuropediatrie. 33 (4): 174–9. doi:10.1055 / s-2002-34491. PMID 12368985.
- Steinberg KK, Relling MV, Gallagher ML a kol. (2007). „Genetické studie shluku případů akutní lymfoblastické leukémie v kraji Churchill v Nevadě“. Environ. Perspektiva zdraví. 115 (1): 158–64. doi:10,1289 / ehp.9025. PMC 1817665. PMID 17366837.
- Kimura K, Wakamatsu A, Suzuki Y a kol. (2006). „Diverzifikace transkripční modulace: rozsáhlá identifikace a charakterizace domnělých alternativních promotorů lidských genů“. Genome Res. 16 (1): 55–65. doi:10,1101 / gr. 4039406. PMC 1356129. PMID 16344560.
- Wilson HL, Wilkinson SR, Rajagopalan KV (2006). „G473D mutace zhoršuje dimerizaci a katalýzu v lidské sulfit oxidáze“. Biochemie. 45 (7): 2149–60. doi:10.1021 / bi051609l. PMID 16475804.
- Hoffmann C, Ben-Zeev B, Anikster Y a kol. (2007). „Zobrazování magnetickou rezonancí a spektroskopie magnetické rezonance při izolovaném deficitu sulfit oxidázy“. J. Child Neurol. 22 (10): 1214–21. doi:10.1177/0883073807306260. PMID 17940249. S2CID 24050167.
- Johnson JL, Coyne KE, Garrett RM a kol. (2002). „Izolovaný nedostatek sulfitoxidázy: identifikace 12 nových mutací SUOX u 10 pacientů“. Hučení. Mutat. 20 (1): 74. doi:10,1002 / humu.9038. PMID 12112661. S2CID 45465780.
- Woo WH, Yang H, Wong KP, Halliwell B (2003). "Exprese genu pro oxid siřičitanový v lidském mozku a v jiných lidských a potkaních tkáních". Biochem. Biophys. Res. Commun. 305 (3): 619–23. doi:10.1016 / S0006-291X (03) 00833-7. PMID 12763039.
- Feng C, Wilson HL, Tollin G a kol. (2005). „Patogenní lidské mutanty sulfitoxidázy G473D a A208D jsou defektní v intramolekulárním přenosu elektronů“. Biochemie. 44 (42): 13734–43. doi:10.1021 / bi050907f. PMID 16229463.
- Tan WH, Eichler FS, Hoda S a kol. (2005). „Izolovaný nedostatek sulfitoxidázy: kazuistika s novou mutací a přehled literatury“. Pediatrie. 116 (3): 757–66. doi:10.1542 / peds.2004-1897. PMID 16140720. S2CID 6506338.
- Astashkin AV, Johnson-Winters K, Klein EL a kol. (2008). „Strukturální studie centra molybdenu patogenního mutanta R160Q lidské sulfitoxidázy pulzní EPR spektroskopií a značením 17O a 33S“. J. Am. Chem. Soc. 130 (26): 8471–80. doi:10.1021 / ja801406f. PMC 2779766. PMID 18529001.
- Dronov R, Kurth DG, Möhwald H a kol. (2008). "Uspořádání po vrstvách interakcí mezi proteiny sulfit oxidázy a cytochromu c katalyzující oxidaci siřičitanu". J. Am. Chem. Soc. 130 (4): 1122–3. doi:10.1021 / ja0768690. PMID 18177044.
- Edwards MC, Johnson JL, Marriage B a kol. (1999). „Izolovaný nedostatek siřičitooxidázy: přehled dvou případů v jedné rodině“. Oftalmologie. 106 (10): 1957–61. doi:10.1016 / S0161-6420 (99) 90408-6. PMID 10519592.
- Gerhard DS, Wagner L, Feingold EA a kol. (2004). „Stav, kvalita a rozšíření projektu cDNA NIH v plné délce: Mammalian Gene Collection (MGC)“. Genome Res. 14 (10B): 2121–7. doi:10,1101 / gr. 2596504. PMC 528928. PMID 15489334.
- Rudolph MJ, Johnson JL, Rajagopalan KV, Kisker C (2003). "Struktura 1.2 A domény lidské sulfitoxidázy cytochromu b (5)". Acta Crystallogr. D. 59 (Pt 7): 1183–91. doi:10.1107 / S0907444903009934. PMID 12832761.
- Feng C, Wilson HL, Hurley JK a kol. (2003). "Role konzervovaného tyrosinu 343 při intramolekulárním přenosu elektronů v lidské sulfit oxidáze". J. Biol. Chem. 278 (5): 2913–20. doi:10,1074 / jbc.M210374200. PMID 12424234.
- Neumann M, Leimkühler S (2008). „Ionty těžkých kovů inhibují aktivitu molybdoenzymu vazbou na dithiolenovou část molybdopterinu v Escherichia coli“. FEBS J. 275 (22): 5678–89. doi:10.1111 / j.1742-4658.2008.06694.x. PMID 18959753. S2CID 45452761.
- Strausberg RL, Feingold EA, Grouse LH a kol. (2002). „Generování a počáteční analýza více než 15 000 lidských a myších cDNA sekvencí plné délky“. Proc. Natl. Acad. Sci. USA. 99 (26): 16899–903. doi:10.1073 / pnas.242603899. PMC 139241. PMID 12477932.
- Wilson HL, Rajagopalan KV (2004). „Úloha tyrosinu 343 při vazbě na substrát a katalýze lidskou sulfit oxidázou“. J. Biol. Chem. 279 (15): 15105–13. doi:10,1074 / jbc.M314288200. PMID 14729666.
- Hakonarson H, Qu HQ, Bradfield JP a kol. (2008). „Nový lokus citlivosti na diabetes 1. typu na Chr12q13 identifikovaný asociační studií v rámci celého genomu“. Cukrovka. 57 (4): 1143–6. doi:10.2337 / db07-1305. PMID 18198356.
externí odkazy
- Siřičitan + oxidáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Výzkumná činnost skupiny Sarkar
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro mitochondriální human Sulfite oxidase