Biologie deprese - Biology of depression
Vědecké studie zjistily, že různé oblasti mozku vykazují u lidí se změněnou aktivitou velká depresivní porucha To povzbudilo obhájce různých teorií, které se snaží identifikovat biochemický původ nemoci, na rozdíl od teorií, které zdůrazňují psychologické nebo situační příčiny. Faktory zahrnující tyto příčinné skupiny zahrnují nutriční nedostatky v hořčík, Vitamín D, a tryptofan se situačním původem, ale biologickým dopadem. Několik teorií týkajících se biologicky způsobená příčina deprese byly navrženy v průběhu let, včetně teorií točících se kolem monoaminové neurotransmitery, neuroplasticity, neurogeneze, zánět a cirkadiánní rytmus. Fyzické nemoci, včetně hypotyreóza a mitochondriální nemoc, může také vyvolat depresivní příznaky.[1][2]
Neuronové obvody na depresi se podílejí osoby podílející se na generování a regulaci emocí a také na odměně. Abnormality se běžně vyskytují v laterální prefrontální kůře, jejíž domnělá funkce se obecně považuje za regulaci emocí. Regiony zapojené do generování emocí a odměn, jako je amygdala, přední cingulární kůra (ACC), orbitofrontální kůra (OFC), a striatum jsou často také zapojeny. Tyto oblasti jsou inervovány monoaminergními jádry a předběžné důkazy naznačují potenciální roli abnormálních monoaminergní aktivita.[3][4]
Genetické faktory
Obtížnost genových studií
Historicky byly hlavním předmětem studia studie kandidátských genů. Protože však počet genů snižuje pravděpodobnost výběru správného kandidátského genu, Chyby typu I (falešně pozitivní) jsou velmi pravděpodobné. Studie na kandidátních genech často mají řadu nedostatků, včetně častých genotypových chyb a statisticky nedostatečného výkonu. Tyto účinky jsou umocněny obvyklým hodnocením genů bez ohledu na interakce gen-gen. Tato omezení se odrážejí ve skutečnosti, že žádný kandidátský gen nedosáhl významu pro celý genom.[5]
Genové kandidáty
5-HTTLPR
Studie z roku 2003 navrhuje, aby a interakce gen-prostředí (GxE) může vysvětlit, proč je životní stres prediktorem depresivních epizod u některých jedinců, ale u jiných ne, v závislosti na alelické variaci promotorové oblasti spojené se serotoninem a transportérem (5-HTTLPR ).[6] Od roku 2019 bylo provedeno šest metaanalýz interakce 5-HTTLPR GxE. Dvě metaanalýzy z roku 2009 uváděly nulová zjištění,[7][8] zatímco metaanalýza z roku 2011 s liberálnějšími kritérii pro zařazení uváděla významný vztah.[9] Metaanalýza z roku 2016 dospěla k závěru, že důkazy o interakci GxE byly v nejlepším případě slabé.[10] Metaanalýza z roku 2018 uváděla slabý, ale významný vztah, který byl omezen významnou heterogenitou.[11] Metaanalýza z roku 2019 uvádí vztah mezi násilným sebevražedným chováním (komplikace MDD) a genem.[12]
BDNF
BDNF předpokládalo se také, že polymorfismy mají genetický vliv, ale výsledky replikace byly smíšené a od roku 2005 byly pro metaanalýzu nedostatečné.[13] Studie také naznačují souvislost snížené produkce BDNF se sebevražedným chováním.[14] Zjištění ze studií interakcí gen-prostředí však naznačují, že současné modely deprese BDNF jsou příliš zjednodušující.[15] Studie z roku 2008 zjistila interakce (biologické epistáza ) ve signalizačních drahách BDNF a transportér serotoninu; BDNF Val66Met Bylo zjištěno, že alela, u které se předpokládá, že bude mít sníženou odezvu na serotonin, vykazuje ochranné účinky u jedinců s krátkou alelou 5-HTTLPR, o níž se předpokládá, že by ji předisponovala k depresivním epizodám po stresových událostech.[16] Signalizace zprostředkovaná BDNF zapojená do neuroplastických odpovědí na stres a antidepresiva je tedy ovlivněna dalšími genetickými a environmentálními modifikátory.[15]
SIRT1 a LHPP
Studie GWAS z roku 2015 na čínských ženách Han pozitivně identifikovala dvě varianty v blízkých intronických oblastech SIRT1 a LHPP s genomově významnou asociací.[17][18]
Polymorfismy transportéru norepinefrinu
Pokusy o nalezení korelace mezi polymorfismy transportéru norepinefrinu a depresí přinesly negativní výsledky.[19]
Jedna recenze identifikovala několik často studovaných kandidátských genů. Geny kódující 5-HTT a 5-HT2A receptor byly nekonzistentně spojeny s depresí a odpovědí na léčbu. Byly nalezeny smíšené výsledky pro neurotrofický faktor odvozený z mozku (BDNF) Polymorfismy Val66Met. Polymorfismy v tryptofan hydroxyláza Bylo zjištěno, že gen byl předběžně spojen se sebevražedným chováním.[20] Byla nalezena metaanalýza 182 geneticky kontrolovaných případů publikovaných v roce 2008 Apolipoprotein E verepsilon 2 má ochranný účinek a GNB3 825T, MTHFR 677T, SLC6A4 44bp inzerce nebo delece a SLC6A3 40 bpVNTR 9/10 genotyp k udělení rizika.[21]
Cirkadiánní rytmus

Spát
Deprese může souviset s abnormalitami v cirkadiánní rytmus,[22] nebo biologické hodiny. Například, spánek rychlého pohybu očí (REM) —Fáze, ve které snění dochází - u depresivních lidí může být rychlé a intenzivní. REM spánek závisí na sníženém serotonin úrovně v mozkový kmen,[23] a je narušen sloučeninami, jako jsou antidepresiva, která zvyšují serotonergní tón ve strukturách mozkových kmenů.[23] Celkově je serotonergní systém nejméně aktivní během spánku a nejaktivnější během bdělosti. Prodloužená bdělost kvůli nedostatek spánku[22] aktivuje serotonergní neurony, což vede k procesům podobným terapeutickému účinku antidepresiv, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI). Depresivní jedinci mohou po noci bez spánku vykazovat výrazný vzestup nálady. SSRI mohou pro svůj terapeutický účinek přímo záviset na zvýšení centrální serotonergní neurotransmise, stejného systému, který ovlivňuje cykly spánku a bdění.[23]
Světelná terapie
Výzkum účinků světelná terapie na sezónní afektivní porucha naznačuje, že světelná deprivace souvisí se sníženou aktivitou v serotonergním systému a s abnormalitami v spánkovém cyklu, zejména s nespavostí. Vystavení světlu se také zaměřuje na serotonergní systém, což poskytuje větší podporu důležité roli, kterou tento systém může hrát při depresi.[24] Nedostatek spánku a světelná terapie oba se zaměřují na stejný mozkový neurotransmiterový systém a oblasti mozku jako antidepresiva a nyní se klinicky používají k léčbě deprese.[25] Světelná terapie, deprivace spánku a posunutí doby spánku (léčba spánkovou fází) se v kombinaci rychle používají k přerušení hluboké deprese u lidí hospitalizovaných pro MDD.[24]
Zvýšená a zkrácená délka spánku se jeví jako rizikový faktor deprese.[26] Lidé s MDD někdy vykazují denní a sezónní variaci závažnosti příznaků, a to i v nesezóně deprese. Zlepšení denní nálady bylo spojeno s aktivitou dorzálních neuronových sítí. Bylo také pozorováno zvýšení průměrné teploty jádra. Jedna hypotéza navrhovala, že deprese byla výsledkem fázového posunu.[27]
Denní expozice světla koreluje se sníženou aktivitou transportéru serotoninu, což může být základem sezónnosti určité deprese.[28]
Monoaminy

Monoaminy jsou neurotransmitery které zahrnují serotonin, dopamin, norepinefrin, a epinefrin.[29]
Monoaminová hypotéza deprese
Mnoho antidepresivum léky akutně rostou synaptický hladiny monoaminového neurotransmiteru, serotoninu, ale mohou také zvýšit hladinu dvou dalších neurotransmiterů, norepinefrinu a dopaminu. Pozorování této účinnosti vedlo k monoaminová hypotéza deprese, který předpokládá, že deficit určitých neurotransmiterů je zodpovědný za depresi, a dokonce, že některé neurotransmitery jsou spojeny se specifickými příznaky. Normální hladiny serotoninu byly spojeny s regulací nálady a chování, spánkem a trávením; noradrenalinu do bojová nebo letová odezva; a dopamin k pohybu, potěšení a motivaci. Někteří také navrhli vztah mezi monoaminy a fenotypy, jako je serotonin ve spánku a sebevraždě, norepinefrin při dysforii, únavě, apatii, kognitivní dysfunkci a dopamin při ztrátě motivace a psychomotorických příznaků.[30] Hlavním omezením pro monoaminovou hypotézu deprese je terapeutická prodleva mezi zahájením antidepresivní léčby a vnímaným zlepšením symptomů. Jedním z vysvětlení tohoto terapeutického zpoždění je, že počáteční zvýšení synaptického serotoninu je pouze dočasné, protože spalování serotonergních neuronů v hřbetní raphe přizpůsobit se aktivitou 5-HT1A autoreceptory. Předpokládá se, že terapeutický účinek antidepresiv vychází z desenzitizace autoreceptorů po určitou dobu, což nakonec zvyšuje pálení serotonergních neuronů.[31]

Serotonin
Počáteční studie serotoninu v depresi zkoumaly periferní opatření, jako je metabolit serotoninu Kyselina 5-hydroxyindoloctová (5-HIAA) a vazba krevních destiček. Výsledky byly obecně nekonzistentní a nemusí se zobecňovat na centrální nervový systém. Nicméně důkazy z vazba na receptory studie a farmakologické výzvy poskytují určité důkazy o dysfunkci neurotransmise serotoninu v depresi.[32] Serotonin může nepřímo ovlivňovat náladu změnou předsudky emočního zpracování které jsou vidět na kognitivní / behaviorální i neurální úrovni.[33][32] Farmakologicky snižující syntézu serotoninu a farmakologicky zvyšující synaptický serotonin mohou produkovat a tlumit negativní afektivní předsudky. Tato zkreslení emočního zpracování mohou vysvětlit terapeutickou mezeru.[33]
Dopamin
Zatímco v dopaminergních systémech byly pozorovány různé abnormality, výsledky byly nekonzistentní. Lidé s MDD mají zvýšenou odpověď na odměnu dextroamfetamin ve srovnání s kontrolami a bylo navrženo, že to vyplývá z přecitlivělosti dopaminergních drah v důsledku přirozené hypoaktivity. Zatímco polymorfismy receptoru D4 a D3 byly zahrnuty do deprese, asociace nebyly důsledně replikovány. Podobná nekonzistence byla nalezena v posmrtných studiích, ale různí agonisté dopaminových receptorů vykazují slib při léčbě MDD.[34] Existují určité důkazy o tom, že je snížena nigrostriatální dráha aktivita u lidí s melancholickou depresí (psychomotorická retardace).[35] Další podporou role dopaminu v depresi je konzistentní nález snížení mozkomíšního moku a jugulárních metabolitů dopaminu,[36] stejně jako posmrtné nálezy pozměněných Dopaminový receptor D3 a transportér dopaminu výraz.[37] Studie v hlodavci podpořili potenciální mechanismus zahrnující stresem indukovanou dysfunkci dopaminergních systémů.[38]
Katecholaminy
Byla popsána řada důkazů svědčících o snížené adrenergní aktivitě při depresi. Nálezy zahrnují sníženou aktivitu tyrosinhydroxylázy, sníženou velikost locus coeruleus, zvýšenou alfa 2 adrenergní receptor hustota a snížena alfa 1 adrenergní receptor hustota.[36] Navíc vyřazení transportéru norepinefrinu u myších modelů zvyšuje jejich toleranci vůči stresu, což implikuje norepinefrin v depresi.[39]
Jednou ze metod používaných ke studiu role monoaminů je vyčerpání monoaminů. Vyčerpání tryptofan (prekurzor serotoninu), tyrosin a fenylalanin (prekurzory dopaminu) má za následek snížení nálady u osob s predispozicí k depresi, ale ne u osob, které tuto predispozici nemají. Na druhou stranu inhibice syntézy dopaminu a norepinefrinu s alfa-methyl-para-tyrosin nevede důsledně ke snížení nálady.[40]
Monoaminooxidáza
To naznačuje odnož monoaminové hypotézy monoaminooxidáza A (MAO-A), enzym, který metabolizuje monoaminy, může být u depresivních lidí příliš aktivní. To by zase způsobilo snížené hladiny monoaminů. Tato hypotéza získala podporu od a PET studie, která zjistila významně zvýšenou aktivitu MAO-A v mozku některých depresivních lidí.[41] V genetických studiích nebyly změny genů souvisejících s MAO-A důsledně spojeny s depresí.[42][43] Na rozdíl od předpokladů monoaminové hypotézy byla snížená, ale ne zvýšená aktivita MAO-A spojena s depresivními příznaky u dospívajících. Tato souvislost byla pozorována pouze u týrané mládeže, což naznačuje, že při rozvoji depresivních poruch jsou důležité jak biologické (MAO geny), tak psychologické (špatné zacházení) faktory.[44] Některé důkazy navíc naznačují, že pod depresi může mít vliv spíše narušení zpracování informací v neuronových sítích než změny v chemické rovnováze.[45]
Omezení
Od 90. let 20. století výzkum odhalil několik omezení monoaminové hypotézy a jeho nedostatečnost byla v psychiatrické komunitě kritizována.[46] Za prvé, dysfunkce serotoninového systému nemůže být jedinou příčinou deprese. Ne všichni pacienti léčeni antidepresiva vykazují zlepšení navzdory obvykle rychlému nárůstu synaptického serotoninu. Pokud dojde k významnému zlepšení nálady, často to není po dobu nejméně dvou až čtyř týdnů. Jedním z možných vysvětlení tohoto zpoždění je, že zvýšení aktivity neurotransmiteru je výsledkem desenzitizace auto receptorů, což může trvat týdny.[47] Intenzivní vyšetřování nedokázalo najít přesvědčivé důkazy o primární dysfunkci specifického monoaminového systému u lidí s MDD. Antidepresiva, která nepůsobí prostřednictvím monoaminového systému, jako je tianeptin a opipramol, jsou známy již dlouho. Rovněž došlo k nekonzistentním zjištěním ohledně hladin séra 5-HIAA, metabolit serotoninu.[48] Pokusy s farmakologickými látkami, které způsobují vyčerpání monoaminů, ukázaly, že toto vyčerpání nezpůsobuje u zdravých lidí depresi.[49][50] Dalším problémem je, že léky, které vyčerpávají monoaminy, mohou mít ve skutečnosti antidepresivní vlastnosti. Někteří dále tvrdili, že deprese může být poznamenána hyperserotonergním stavem.[51] Monoaminová hypotéza, která již byla omezena, byla při předložení široké veřejnosti dále zjednodušena.[52]
Vazba receptoru
Od roku 2012 je snaha určit rozdíly v expresi neurotransmiterových receptorů nebo pro funkci v mozku lidí s MDD pomocí pozitronová emisní tomografie (PET) vykázaly nekonzistentní výsledky. S využitím zobrazovací technologie PET a reagencií dostupných od roku 2012 se ukázalo, že D1 receptor může být nedostatečně exprimován ve striatu lidí s MDD. 5-HT1A literatura o vazbě na receptory je nekonzistentní; nakloní se však k obecnému snížení meziotemporální kůry. 5-HT2A vazba na receptory se zdá být neregulovaná u lidí s MDD. Výsledky studií o vazbě 5-HTT jsou variabilní, ale mají tendenci naznačovat vyšší hladiny u lidí s MDD. Výsledky s D2 / D3 receptor závazné studie jsou příliš nekonzistentní, aby bylo možné vyvodit závěry. Důkazy podporují zvýšenou aktivitu MAO u lidí s MDD a mohou být dokonce znakem zvláštnosti (nezměněno reakcí na léčbu). Vazba muskarinových receptorů se zdá být zvýšena při depresi a vzhledem k dynamice vazby ligandů naznačuje zvýšenou cholinergní aktivitu.[53]
Byly provedeny čtyři metaanalýzy vazby na receptory při depresi, dvě dále transportér serotoninu (5-HTT), jeden na 5-HT1Aa další na transportér dopaminu (DAT). Jedna metaanalýza na 5-HTT uvádí, že vazba byla snížena v střední mozek a amygdala, přičemž první koreluje s vyšším věkem a druhý koreluje se závažností deprese.[54] Další metaanalýza 5-HTT zahrnující jak posmrtné, tak in vivo studie vazby na receptory uvádějí, že zatímco in vivo studie zjistily snížený obsah 5-HTT ve striatu, amygdale a středním mozku, postmortální studie nezjistily žádné významné asociace.[55] 5-HT1A bylo zjištěno, že je redukováno v přední cingulární kůře, meziotemporálním laloku, insule a hipokampu, ale ne v amygdala nebo okcipitálním laloku. Nejčastěji používaný 5-HT1A ligandy nejsou vytěsňovány endogenním serotoninem, což naznačuje, že hustota nebo afinita receptoru je snížena.[56] Vazba transportéru dopaminu se při depresi nemění.[57]
Emoční zpracování a neurální obvody
Emocionální zkreslení
Lidé s MDD vykazují řadu předsudků emocionální zpracování, jako je tendence negativně hodnotit šťastné tváře a tendence přidělovat více prostředků pozornosti smutným výrazům.[58] Depresivní lidé mají také zhoršené rozpoznání veselých, naštvaných, znechucených, ustráchaných a překvapených, ale ne smutných tváří.[59] Funkční neuroimaging prokázal hyperaktivitu různých oblastí mozku v reakci na negativní emoční podněty a hypoaktivitu v reakci na pozitivní podněty. Jedna metaanalýza uváděla, že depresivní subjekty vykazovaly sníženou aktivitu vlevo dorsolaterální prefrontální kůra a zvýšená aktivita v amygdale v reakci na negativní podněty.[60] Další metaanalýza zaznamenala zvýšenou aktivitu hipokampu a thalamu v podskupině subjektů s depresí, kteří nebyli naivní, nebyli starší a neměli žádné komorbidity.[61] Terapeutické zpoždění antidepresiv bylo navrženo jako výsledek antidepresiv modifikujících emoční zpracování vedoucí ke změnám nálady. To je podporováno pozorováním jak akutním, tak subchronickým SSRI podání zvyšuje reakci na pozitivní tváře.[62] Zdá se, že antidepresivní léčba zvrací náladu shodnou s náladou limbický, prefrontální a fusiformní oblasti. Odezva dlPFC je vylepšena a odezva amygdaly je oslabena během zpracování negativních emocí, kdy se předpokládá, že odrážejí zvýšenou regulaci shora dolů. The fusiform gyrus a další oblasti vizuálního zpracování reagují silněji na pozitivní podněty antidepresivní léčbou, o které se předpokládá, že odráží zkreslení pozitivního zpracování.[63] Tyto účinky se nejeví jako jedinečné u serotonergních nebo noradrenergních antidepresiv, ale vyskytují se také v jiných formách léčby, jako je hluboká stimulace mozku.[64]
Neuronové obvody
Jedna metaanalýza funkčního neuroimagingu v depresi pozorovala vzorec abnormální nervové aktivity předpokládaný tak, aby odrážel předpojatost emočního zpracování. Ve srovnání s kontrolami lidé s MDD vykazovali hyperaktivitu obvodů v hlavní síť (SN), složený z pulvinarová jádra, ostrov a dorzální přední cingulární kůra (dACC), stejně jako snížená aktivita v regulačních obvodech složených ze striata a dlPFC.[65]

Pro vysvětlení časných biologických nálezů v depresi byl navržen neuroanatomický model zvaný limbicko-kortikální model. Model se pokouší spojit specifické příznaky deprese s neurologickými abnormalitami. Za základem přežvykování byla navržena zvýšená klidová aktivita amygdaly, protože bylo hlášeno, že stimulace amygdaly je spojena s rušivým vyvoláváním negativních vzpomínek. ACC bylo rozděleno na pregenual (pgACC) a subgenuální oblasti (sgACC), přičemž první je elektrofyziologicky spojena se strachem a druhá je metabolicky zapletena do smutku u zdravých subjektů. Hyperaktivita laterálních orbitofrontálních a ostrovních oblastí spolu s abnormalitami v laterálních prefrontálních oblastech byla navržena jako základ maladaptivních emocionálních reakcí, vzhledem k rolím regionů v odměňování.[67][68] Tento a další model nazývali „kortikální striatální model“, který se více zaměřoval na abnormality v kortiko-bazální ganglia-thalamo-kortikální smyčka, byly podpořeny nedávnou literaturou. Snížená striatální aktivita, zvýšená aktivita OFC a zvýšená aktivita sgACC byly všechna zjištění v souladu s navrhovanými modely. Bylo však hlášeno, že aktivita amygdaly je snížena, na rozdíl od limbicko-kortikálního modelu. Kromě toho byly léčeny modulovány pouze laterální prefrontální oblasti, což naznačuje, že prefrontální oblasti jsou stavové markery (tj. Závislé na náladě), zatímco subkortikální abnormality jsou rysové markery (tj. Odrážejí citlivost).[69]
Odměna
Zatímco závažnost deprese jako celek nesouvisí s otupělou nervovou odpovědí na odměnu, anhedonia přímo souvisí se sníženou aktivitou v systém odměn.[70] Studium odměny v depresi je omezeno heterogenitou v definici a konceptualizaci odměny a anhedonie. Anhedonie je obecně definována jako snížená schopnost cítit potěšení, ale dotazníky a klinická hodnocení zřídka rozlišují mezi motivačním „chcením“ a konzumním „laskáním“. Zatímco řada studií naznačuje, že depresivní subjekty hodnotí pozitivní podněty méně pozitivně a méně vzrušivě, řada studií nenalezne rozdíl. Dále reakce na přírodní odměny, jako je sacharóza se nezdá být oslabený. Všeobecné afektivní otupování může vysvětlovat „anhedonické“ příznaky deprese, protože metaanalýza pozitivních i negativních podnětů odhaluje snížené hodnocení intenzity.[71][72] Protože anhedonie je významným příznakem deprese, přímé srovnání deprese se zdravými subjekty odhaluje zvýšenou aktivaci subgenuální přední cingulární kůra (sgACC) a snížená aktivace ventrální striatum, a zejména nucleus accumbens (NAcc) v reakci na pozitivní podněty.[73] Ačkoli je nález snížené aktivity NAcc během paradigmat odměn poměrně konzistentní, NAcc je tvořen funkčně různorodým rozsahem neuronů a závislé na hladině kyslíku v krvi (BOLD) Signál v této oblasti může naznačovat řadu věcí, včetně snížené aferentní aktivity nebo sníženého inhibičního výkonu.[74] Tyto regiony jsou nicméně důležité při zpracování odměn a předpokládá se, že jejich základem je dysfunkce v depresi anhedonia. Zbytková anhedonie, která není dobře zacílena serotonergními antidepresivy, se předpokládá jako výsledek inhibice uvolňování dopaminu aktivací 5-HT2C receptory ve striatu.[73] Odpověď na odměnu v mediaci orbitofrontální kůra (OFC) je oslaben v depresi, zatímco boční OFC reakce je posílena k trestu. Boční OFC vykazuje trvalou reakci na absenci odměny nebo trestu a považuje se za nezbytnou pro modifikaci chování v reakci na měnící se nepředvídané události. Přecitlivělost v lOFC může vést k depresi tím, že vyvolá podobný účinek jako naučená bezmocnost u zvířat.[75]
Zvýšená odezva v sgACC je konzistentní nález ve studiích neuroimagingu s použitím řady paradigmat, včetně úkolů souvisejících s odměnami.[73][76][77] Léčba je také spojena s oslabenou aktivitou v sgACC,[78] a inhibice neuronů v homologu hlodavců sgACC, infralimbická kůra (IL), vyvolává antidepresivní účinek.[79] Předpokládá se, že hyperaktivita sgACC vede k depresi zeslabením somatické reakce na odměnu nebo pozitivní podněty.[80] Na rozdíl od studií o funkční zobrazování magnetickou rezonancí reakce v sgACC během úkolů, klidový metabolismus je snížen v sgACC. To je však zřejmé pouze při korekci výrazného snížení objemu sgACC spojeného s depresí; strukturální abnormality jsou patrné na buněčné úrovni, protože neuropatologické studie uvádějí snížené buněčné markery sgACC. Model deprese navržený na základě těchto zjištění Drevets et al. naznačuje, že snížená aktivita sgACC má za následek zvýšenou aktivitu sympatického nervového systému a otupenou zpětnou vazbu osy HPA.[81] Aktivita v sgACC nemusí být při depresi také příčinná, protože autoři jednoho přehledu, který zkoumal neuroimaging u depresivních subjektů během emoční regulace, předpokládali, že vzorec zvýšené aktivity sgACC odráží zvýšenou potřebu modulovat automatické emoční reakce v depresi. Rozsáhlejší sgACC a obecný prefrontální nábor během pozitivního emočního zpracování byl spojen s otupělou subkortikální odpovědí na pozitivní emoce a anhedonií subjektu. Toto bylo autory interpretováno tak, aby odráželo downregulaci pozitivních emocí nadměrným náborem prefrontální kůry.[82]
Neuroanatomy
Zatímco u lidí s depresivní poruchou je soustavně hlášena řada nálezů neuroimagingu, heterogenita depresivních populací představuje potíže při interpretaci těchto nálezů. Například průměrování napříč populacemi může skrýt určité nálezy související s podskupinami; zatímco u deprese je hlášena snížená aktivita dlPFC, podskupina se může projevit zvýšenou aktivitou dlPFC. Průměrování může také přinést statisticky významné nálezy, jako jsou snížené objemy hipokampu, které jsou skutečně přítomny v podskupině subjektů.[83] Kvůli těmto problémům a dalším, včetně podélné konzistence deprese, je většina neurálních modelů pravděpodobně nepoužitelná pro všechny deprese.[69]
Strukturální neuroimaging

Metaanalýzy prováděné pomocí počáteční mapování d hlásili snížení šedé hmoty v řadě frontálních oblastí. Jedna metaanalýza obecné deprese s časným nástupem hlásila snížení šedé hmoty na bilaterální úrovni přední cingulární kůra (ACC) a dorsomediální prefrontální kůra (dmPFC).[85] Jedna metaanalýza deprese první epizody pozorovala odlišné vzorce redukce šedé hmoty v léčbě bez léčby a kombinované populace; deprese bez léčby byla spojena se snížením pravice dorsolaterální prefrontální kůra, že jo amygdala a správně dolní temporální gyrus; analýza kombinace bez medikace a medikované deprese zjistila redukci na levé insule, pravé doplňkové motorické oblasti a pravém středním temporálním gyrusu.[86] Další přehled rozlišující populaci léčivých a bez léků, i když se neomezuje pouze na lidi s první epizodou MDD, zjistil snížení kombinované populace v bilaterálním horním, pravém středním a levém dolním čelním gyrusu spolu s bilaterálním parahippocampus. Zvýšení šedé hmoty talamu a ACC bylo hlášeno v populaci bez medikace a v medikované populaci.[87] Metaanalýza prováděná pomocí „odhadu pravděpodobnosti aktivace“ uvádí snížení paracingulátové kůry, dACC a amygdaly.[88]
Pomocí statistického parametrického mapování jedna metaanalýza replikovala předchozí nálezy redukované šedé hmoty v ACC, mediální prefrontální kůře, frontálním gyrus, hipokampu a thalamu; avšak snížení OFC a ventromediální prefrontální kůra byla také hlášena šedá hmota.[89]
Byly publikovány dvě studie o depresi z konsorcia ENIGMA, jedna o kortikální tloušťce a druhá o subkortikálním objemu. Snížená kortikální tloušťka byla hlášena v bilaterálních OFC, ACC, insulach, středních temporálních gyrich, fusiformních gyrich a zadních cingulárních korticích, zatímco deficity povrchových ploch byly zjištěny v mediálních okcipitálních, dolních parietálních, orbitofrontálních a precentrálních oblastech.[90] Subkortikální abnormality, včetně snížení objemů hipokampu a amygdaly, které byly zvláště výrazné u deprese s časným nástupem.[91]
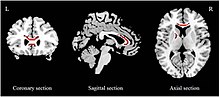
Na studiích bylo provedeno několik metaanalýz bílá hmota integrita pomocí frakční anizotropie (FA). V EU byla hlášena snížená FA corpus callosum (CC) v obou prvních epizodách léčba naivní,[93][94] a obecně velké depresivní populace.[92][95] Rozsah snížení CC se u jednotlivých studií liší. U lidí s MDD, kteří dříve neužívali antidepresiva, bylo hlášeno snížení pouze v těle CC[93] a to pouze v genu CC.[94] Na druhé straně bylo hlášeno, že obecné vzorky MDD mají snížení v těle CC,[94] tělo a genu CC,[92] a jen genu CC.[95] Snížení FA bylo rovněž hlášeno v EU přední končetina vnitřní kapsle (ALIC)[93][92] a superior podélný fasciculus.[93][94]
Funkční neuroimaging
Studie aktivity v klidovém stavu využívaly řadu indikátorů aktivity v klidovém stavu, včetně regionální homogenity (ReHO), amplitudy nízkofrekvenčních fluktuací (ALFF), frakční amplitudy nízkofrekvenčních fluktuací (fALFF), označení arteriální spiny (ASL) a pozitronová emisní tomografie opatření regionálního cerebrálního průtoku krve nebo metabolismu.
Studie využívající ALFF a fALFF uvádějí zvýšení aktivity ACC, přičemž první uvádějí primárně více ventrálních nálezů a druhé více hřbetních nálezů.[96] Konjunkční analýza studií ALFF a CBF se sbíhala na levé ostrově, přičemž dříve neléčení lidé měli zvýšenou aktivitu na ostrově. Zvýšené caudate Bylo rovněž hlášeno CBF[97] Metaanalýza kombinující více indikátorů klidové aktivity uvádí zvýšenou aktivitu předního cingulátu, striatu a thalamu a sníženou aktivitu levé insuly, post-centrální gyrus a fusiformní gyrus.[98] Metaanalýza odhadu aktivační pravděpodobnosti (ALE) studií klidového stavu PET / SPECT uvádí sníženou aktivitu v levé insule, pregenuální a dorzální přední cingulární kůře a zvýšenou aktivitu v thalamu, caudatu, předním hipokampu a amygdale.[99] Ve srovnání s metaanalýzou ALE studií PET / SPECT uvádí studie využívající analýzu s více jádry hustoty hyperaktivitu pouze v pulvinarová jádra thalamu.[65]
Mozkové oblasti
Výzkum mozků lidí s MDD obvykle ukazuje narušené vzorce interakce mezi více částmi mozku. Několik oblastí mozku je zapojeno do studií, které se snaží lépe porozumět biologii deprese:
Subgenuální cingulate
Studie to ukázaly Brodmann oblast 25, také známý jako subgenual cingulate, je metabolicky nadměrně aktivní v deprese rezistentní na léčbu. Tento region je extrémně bohatý na transportéry serotoninu a je považován za guvernéra rozsáhlé sítě zahrnující oblasti jako hypotalamus a mozkový kmen, který ovlivňuje změny chuti k jídlu a spánku; the amygdala a ostrov, které ovlivňují náladu a úzkost; the hipokampus, který hraje důležitou roli při formování paměti; a některé části frontální kůra zodpovědný za sebeúctu. Poruchy v této oblasti nebo menší než normální velikost této oblasti tedy přispívají k depresi. Hluboká stimulace mozku byl zaměřen na tuto oblast, aby snížil její aktivitu u lidí s depresí rezistentní na léčbu.[100]:576–578[101]
Prefrontální kůra
Jeden přehled uváděl hypoaktivitu v EU prefrontální kůra pacientů s depresí ve srovnání s kontrolami.[102] Prefrontální kůra se podílí na emočním zpracování a regulaci a dysfunkce tohoto procesu se může podílet na etiologii deprese. Jedna studie o léčbě antidepresivy zjistila zvýšení aktivity PFC v reakci na podávání antidepresiv.[103] Jedna metaanalýza publikovaná v roce 2012 zjistila, že oblasti prefrontální kůry byly hypoaktivní v reakci na negativní podněty u lidí s MDD.[65] Jedna studie naznačila, že oblasti prefrontální kůry jsou součástí sítě regionů, včetně hřbetních a pregenuálních cingulátů, bilaterálních středních frontálních gyrus, insula a superior temporálních gyrus, které se u lidí s MDD zdají být hypoaktivní. Autoři však varovali, že vylučovací kritéria, nedostatek konzistence a malé vzorky omezují výsledky.[99]
Amygdala
Amygdala, struktura podílející se na emočním zpracování, se zdá být hyperaktivní u pacientů s velkou depresivní poruchou.[101] Amygdala u nemedikovaných depresivních osob měla tendenci být menší než u těch, kteří byli léčeni, avšak souhrnné údaje nevykazují žádný rozdíl mezi depresivními a zdravými osobami.[104] Během úkolů emočního zpracování je pravá amygdala aktivnější než levá, ale během kognitivních úkolů nejsou žádné rozdíly a v klidu se zdá být pouze levá amygdala hyperaktivnější.[105] Jedna studie však nenalezla žádný rozdíl v aktivitě amygdaly během úkolů emocionálního zpracování.[106]
Hippocampus
Během deprese byla pozorována atrofie hipokampu, což odpovídá zvířecím modelům stresu a neurogeneze.[107][108]
Stres může způsobit depresi a příznaky podobné depresi prostřednictvím monoaminergních změn v několika klíčových oblastech mozku, stejně jako potlačení v hipokampální neurogenezi.[109] To vede ke změnám v oblastech mozku souvisejících s emocemi a poznáváním, stejně jako k dysfunkci osy HPA. Through the dysfunction, the effects of stress can be exacerbated including its effects on 5-HT. Furthermore, some of these effects are reversed by antidepressant action, which may act by increasing hippocampal neurogenesis. This leads to a restoration in HPA activity and stress reactivity, thus restoring the deleterious effects induced by stress on 5-HT.[110]
The osa hypotalamus-hypofýza-nadledviny je řetězec endokrinní structures that are activated during the body's response to stressors of various sorts. The HPA axis involves three structure, the hypothalamus which release CRH that stimulates the pituitary gland to release ACTH which stimulates the adrenal glands to release cortisol. Cortisol has a negative feedback effect on the pituitary gland and hypothalamus. In people with MDD the often shows increased activation in depressed people, but the mechanism behind this is not yet known.[111] Increased basal cortisol levels and abnormal response to dexamethasone challenges have been observed in people with MDD.[112] Early life stress has been hypothesized as a potential cause of HPA dysfunction.[113][114] HPA axis regulation may be examined through a dexamethasone suppression tests, which tests the feedback mechanisms. Non-suppression of dexamethasone is a common finding in depression, but is not consistent enough to be used as a diagnostic tool.[115] HPA axis changes by be responsible for some of the changes such as decreased bone mineral density and increased weight found in people with MDD. One drug, ketoconazole, currently under development has shown promise in treating MDD.[116]
Hippocampal Neurogenesis
Snížené hipokampální neurogenesis leads to a reduction in hippocampal volume. A genetically smaller hippocampus has been linked to a reduced ability to process psychologické trauma and external stress, and subsequent predisposition to psychological illness.[117] Depression without familial risk or childhood trauma has been linked to a normal hippocampal volume but localised dysfunction.[118]
Animal Models
A number of animal models exist for depression, but they are limited in that depression involves primarily subjective emotional changes. However, some of these changes are reflected in physiology and behavior, the latter of which is the target of many animal models. These models are generally assessed according to four facets of validity; the reflection of the core symptoms in the model; the predictive validity of the model; the validity of the model with regard to human characteristics of etiology;[119] and the biological plausibility.[120][121]
Different models for inducing depressive behaviors have been utilized; neuroanatomical manipulations such as olfactory bulbectomy or circuit specific manipulations with optogenetics; genetic models such as 5-HT1A knockout or selectively bred animals;[119] models involving environmental manipulation associated with depression in humans, including chronic mild stress, early life stress and learned helplessness.[122] The validity of these models in producing depressive behaviors may be assessed with a number of behavioral tests. Anhedonia and motivational deficits may, for example, be assessed via examining an animal's level of engagement with rewarding stimuli such as sucrose or intracranial self-stimulation. Anxious and irritable symptoms may be assessed with exploratory behavior in the presence of a stressful or novelty environment, such as the open field test, novelty suppressed feeding, or the elevated plus-maze. Fatigue, psychomotor poverty, and agitation may be assessed with locomotor activity, grooming activity, and open field tests.
Animal models possess a number of limitations due to the nature of depression. Some core symptoms of depression, such as rumination, low self-esteem, guilt, and depressed mood cannot be assessed in animals as they require subjective reporting.[121] From an evolutionary standpoint, the behavior correlates of defeats of loss are thought to be an adaptive response to prevent further loss. Therefore, attempts to model depression that seeks to induce defeat or despair may actually reflect adaption and not disease. Furthermore, while depression and anxiety are frequently comorbid, dissociation of the two in animal models is difficult to achieve.[119] Pharmacological assessment of validity is frequently disconnected from clinical pharmacotherapeutics in that most screening tests assess acute effects, while antidepressants normally take a few weeks to work in humans.[123]
Neurocircuits
Regions involved in reward are common targets of manipulation in animal models of depression, including the nucleus accumbens (NAc), ventral tegmental area (VTA), ventral pallidum (VP), lateral habenula (LHb) a mediální prefrontální kůra (mPFC). Tentative fMRI studies in humans demonstrate elevated LHb activity in depression.[124] The lateral habenula projects to the RMTg to drive inhibition of dopamine neurons in the VTA during omission of reward. In animal models of depression, elevated activity has been reported in LHb neurons that project to the ventrální tegmentální oblast (ostensibly reducing dopamine release). The LHb also projects to aversion reactive mPFC neurons, which may provide an indirect mechanism for producing depressive behaviors.[125] Learned helplessness induced potentiation of LHb synapses are reversed by antidepressant treatment, providing predictive validity.[124] A number of inputs to the LHb have been implicated in producing depressive behaviors. Silencing GABAergic projections from the NAc to the LHb reduces conditioned place preference induced in social aggression, and activation of these terminals induces CPP. Ventral pallidum firing is also elevated by stress induced depression, an effect that is pharmacologically valid, and silencing of these neurons alleviates behavioral correlates of depression.[124] Tentative in vivo evidence from people with MDD suggests abnormalities in dopamine signalling.[126] This led to early studies investigating VTA activity and manipulations in animal models of depression. Massive destruction of VTA neurons enhances depressive behaviors, while VTA neurons reduce firing in response to chronic stress. However, more recent specific manipulations of the VTA produce varying results, with the specific animal model, duration of VTA manipulation, method of VTA manipulation, and subregion of VTA manipulation all potentially leading to differential outcomes.[127] Stress and social defeat induced depressive symptoms, including anhedonia, are associated with potentiation of excitatory inputs to Dopamine D2 receptor-expressing medium spiny neurons (D2-MSNs) and depression of excitatory inputs to Dopamine D1 receptor-expressing medium spiny neurons (D1-MSNs). Optogenetic excitation of D1-MSNs alleviates depressive symptoms and is rewarding, while the same with D2-MSNs enhances depressive symptoms. Excitation of glutaminergic inputs from the ventral hippocampus reduces social interactions, and enhancing these projections produces susceptibility to stress-induced depression.[127] Manipulations of different regions of the mPFC can produce and attenuate depressive behaviors. For example, inhibiting mPFC neurons specifically in the intralimbic cortex attenuates depressive behaviors. The conflicting findings associated with mPFC stimulation, when compared to the relatively specific findings in the infralimbic cortex, suggest that the prelimbic cortex and infralimbic cortex may mediate opposing effects.[79] mPFC projections to the raphe nuclei are largely GABAergic and inhibit the firing of serotonergic neurons. Specific activation of these regions reduce immobility in the forced swim test but do not affect open field or forced swim behavior. Inhibition of the raphe shifts the behavioral phenotype of uncontrolled stress to a phenotype closer to that of controlled stress.[128]
Altered neuroplasticity
Recent studies have called attention to the role of altered neuroplasticity in depression. A review found a convergence of three phenomena:
- Chronic stress reduces synaptic and dendritic plasticity
- Depressed subjects show evidence of impaired neuroplasticity (e.g. shortening and reduced complexity of dendritic trees)
- Anti-depressant medications may enhance neuroplasticity at both a molecular and dendritic level.
The conclusion is that disrupted neuroplasticity is an underlying feature of depression, and is reversed by antidepressants.[129]
Blood levels of BDNF in people with MDD increase significantly with antidepressant treatment and correlate with decrease in symptoms.[130] Post mortem studies and rat models demonstrate decreased neuronal density in the prefrontal cortex thickness in people with MDD. Rat models demonstrate histological changes consistent with MRI findings in humans, however studies on neurogenesis in humans are limited. Antidepressants appear to reverse the changes in neurogenesis in both animal models and humans.[131]
Inflammation and oxidative stress
Various review have found that general inflammation may play a role in depression.[132][133] One meta analysis of cytokines in people with MDD found increased levels of pro-inflammatory IL-6 and TNF-a levels relative to controls.[134] The first theories came about when it was noticed that interferon therapy caused depression in a large number of people receiving it.[135] Meta analysis on cytokine levels in people with MDD have demonstrated increased levels of IL-1, IL-6, C-reaktivní protein, ale ne IL-10.[136][137] Increased numbers of T-Cells presenting activation markers, levels of neopterin, IFN gamma, sTNFR, and IL-2 receptors have been observed in depression.[138] Various sources of inflammation in depressive illness have been hypothesized and include trauma, sleep problems, diet, smoking and obesity.[139] Cytokines, by manipulating neurotransmitters, are involved in the generation of sickness behavior, which shares some overlap with the symptoms of depression. Neurotransmitters hypothesized to be affected include dopamine and serotonin, which are common targets for antidepressant drugs. Induction of indolamine-2,3 dioxygenease by cytokines has been proposed as a mechanism by which immune dysfunction causes depression.[140] One review found normalization of cytokine levels after successful treatment of depression.[141] A meta analysis published in 2014 found the use of anti-inflammatory drugs such as NSAIDs and investigational cytokine inhibitors reduced depressive symptoms.[142] Exercise can act as a stressor, decreasing the levels of IL-6 and TNF-a and increasing those of IL-10, an anti-inflammatory cytokine.[143]
Inflammation is also intimately linked with metabolic processes in humans. For example, low levels of Vitamin D have been associated with greater risk for depression.[144] The role of metabolic biomarkers in depression is an active research area. Recent work has explored the potential relationship between plasma sterols and depressive symptom severity.[145]
A marker of DNA oxidation, 8-oxo-2'-deoxyguanosin, has been found to be increased in both the plasma and urine of people with MDD. This along with the finding of increased F2-isoprostanes levels found in blood, urine and cerebrospinal fluid indicate increased damage to lipids and DNA in people with MDD. Studies with 8-Oxo-2' Deoxyguanosine varied by methods of measurement and type of depression, but F2-Isoprostane level was consistent across depression types. Authors suggested lifestyle factors, dysregulation of the HPA axis, immune system and autonomics nervous system as possible causes.[146] Another meta-analysis found similar results with regards to oxidative damage products as well as decreased oxidative capacity.[147] Oxidační poškození DNA may play a role in MDD.[148]
Mitochondrial Dysfunction:
Increased markers of oxidative stress relative to controls have been found in people with MDD.[149] These markers include high levels of RNS a ROS which have been shown to influence chronic inflammation, damaging the elektronový transportní řetězec and biochemical cascades in mitochondrie. This lowers the activity of enzymes in the respiratory chain resulting in mitochondrial dysfunction.[150] The brain is a highly energy-consuming and has little capacity to store glucose as glycogen and so depends greatly on mitochondria. Mitochondrial dysfunction has been linked to the dampened neuroplasticity observed in depressed brains.[151]
Large-scale brain network theory
Instead of studying one brain region, studying large scale brain networks is another approach to understanding psychiatric and neurological disorders,[152] supported by recent research that has shown that multiple brain regions are involved in these disorders. Understanding the disruptions in these networks may provide important insights into interventions for treating these disorders. Recent work suggests that at least three large-scale brain networks are important in psychopathology:[152]
Central executive network
The central executive network is made up of fronto-parietal regions, including dorsolateral prefrontal cortex and lateral posterior parietal cortex.[153][154] This network is involved in high level kognitivní funkce such as maintaining and using information in pracovní paměť, problem solving, and decision making.[152][155] Deficiencies in this network are common in most major psychiatric and neurological disorders, including depression.[156][157] Because this network is crucial for everyday life activities, those who are depressed can show impairment in basic activities like test taking and being decisive.[158]
Síť ve výchozím režimu
The výchozí režim sítě includes hubs in the prefrontal cortex and posterior cingulate, with other prominent regions of the network in the medial temporal lobe and angular gyrus.[152] The default mode network is usually active during mind-wandering and thinking about social situations. In contrast, during specific tasks probed in cognitive science (for example, simple attention tasks), the default network is often deactivated.[159][160] Research has shown that regions in the default mode network (including medial prefrontal cortex and posterior cingulate) show greater activity when depressed participants ruminate (that is, when they engage in repetitive self-focused thinking) than when typical, healthy participants ruminate.[161] People with MDD also show increased connectivity between the default mode network and the subgenual cingulate and the adjoining ventromedial prefrontal cortex in comparison to healthy individuals, individuals with dementia or with autism. Numerous studies suggest that the subgenual cingulate plays an important role in the dysfunction that characterizes major depression.[162] The increased activation in the default mode network during rumination and the atypical connectivity between core default mode regions and the subgenual cingulate may underlie the tendency for depressed individual to get "stuck" in the negative, self-focused thoughts that often characterize depression.[163] However, further research is needed to gain a precise understanding of how these network interactions map to specific symptoms of depression.
Salience network
The salience network is a cingulate-frontal operculum network that includes core nodes in the anterior cingulate and anterior insula.[153] A nápadnost network is a large-scale brain network involved in detecting and orienting the most pertinent of the external stimuli and internal events being presented.[152] Individuals who have a tendency to experience negative emotional states (scoring high on measures of neuroticismus ) show an increase in the right anterior insula during decision-making, even if the decision has already been made.[164] This atypically high activity in the right anterior insula is thought to contribute to the experience of negative and worrisome feelings.[165] In major depressive disorder, anxiety is often a part of the emotional state that characterizes depression.[166]
Viz také
Reference
- ^ Anglin, Rebecca E.; Tarnopolsky, Mark A.; Mazurek, Michael F.; Rosebush, Patricia I. (January 2012). "The Psychiatric Presentation of Mitochondrial Disorders in Adults". The Journal of Neuropsychiatry and Clinical Neurosciences. 24 (4): 394–409. doi:10.1176/appi.neuropsych.11110345. ISSN 0895-0172. PMID 23224446.
- ^ CARROLL, BERNARD J. (October 2004). "Psychoneuroendocrinology: The Scientific Basis of Clinical Practice. Edited by O. M. Wolkowitz and A. J. Rothschild. (Pp. 606; $73.95; ISBN 0-88048-857-3 pb.) American Psychiatric Publishing, Inc.: Arlington, Virginia, 2003". Psychologická medicína. 34 (7): 1359–1360. doi:10.1017/S0033291704213678. ISSN 0033-2917.
- ^ Kupfer DJ, Frank E, Phillips ML (17 March 2012). "Major depressive disorder: new clinical, neurobiological, and treatment perspectives". Lanceta. 379 (9820): 1045–55. doi:10.1016/S0140-6736(11)60602-8. PMC 3397431. PMID 22189047.
- ^ aan het Rot M, Mathew SJ, Charney DS (3 February 2009). "Neurobiological mechanisms in major depressive disorder". Canadian Medical Association Journal. 180 (3): 305–13. doi:10.1503/cmaj.080697. PMC 2630359. PMID 19188629.
- ^ Levinson, Douglas F.; Nichols, Walter E. (2018). "24. Genetics of Depression". In Charney, Dennis S.; Sklar, Pamela; Buxbaum, Joseph D.; Nestler, Eric J. (eds.). Charney & Nestlers Neurobiology of Mental Illness (5. vydání). New York: Oxford University Press. p. 310.
- ^ Nierenberg, AA (2009). "The long tale of the short arm of the promoter region for the gene that encodes the serotonin uptake protein". Spektra CNS. 14 (9): 462–3. doi:10.1017/s1092852900023506. PMID 19890228.
- ^ Risch, N; Herrell, R; Lehner, T; Liang, KY; Eaves, L; Hoh, J; Griem, A; Kovacs, M; Ott, J; Merikangas, KR (17 June 2009). „Interakce mezi genem pro transport serotoninu (5-HTTLPR), stresujícími životními událostmi a rizikem deprese: metaanalýza“. JAMA. 301 (23): 2462–71. doi:10.1001 / jama.2009.878. PMC 2938776. PMID 19531786.
- ^ Munafò, MR; Durrant, C; Lewis, G; Flint, J (1 February 2009). "Interakce prostředí Gene X na lokusu serotoninového transportéru". Biologická psychiatrie. 65 (3): 211–9. doi:10.1016 / j.biopsych.2008.06.009. PMID 18691701.
- ^ Karg, K; Burmeister, M; Shedden, K; Sen, S (May 2011). „Varianta promotoru transportéru serotoninu (5-HTTLPR), stresová a depresivní metaanalýza se znovu objevila: důkaz genetické umírněnosti“. Archiv obecné psychiatrie. 68 (5): 444–54. doi:10.1001 / archgenpsychiatry.2010.189. PMC 3740203. PMID 21199959.
- ^ Taylor, AE; Munafò, MR (31 May 2016). "Triangulating meta-analyses: the example of the serotonin transporter gene, stressful life events and major depression". BMC Psychology. 4 (1): 23. doi:10.1186/s40359-016-0129-0. PMC 4886450. PMID 27240561.
- ^ Bleys, D; Luyten, P; Soenens, B; Claes, S (15 January 2018). "Gene-environment interactions between stress and 5-HTTLPR in depression: A meta-analytic update" (PDF). Journal of afektivní poruchy. 226: 339–345. doi:10.1016/j.jad.2017.09.050. PMID 29031184.
- ^ Fanelli G, Serretti A (2019). "The influence of the serotonin transporter gene 5-HTTLPR polymorphism on suicidal behaviors: a meta-analysis". Prog Neuropsychopharmacol Biol Psychiatry. 88: 375–387. doi:10.1016/j.pnpbp.2018.08.007. PMID 30125622.CS1 maint: používá parametr autoři (odkaz)
- ^ Levinson, D. (2006). "The genetics of depression: a review". Biologická psychiatrie. 60 (2): 84–92. doi:10.1016/j.biopsych.2005.08.024. PMID 16300747.
- ^ Dwivedi Y (2009). "Brain-derived neurotrophic factor: role in depression and suicide". Neuropsychiatr Dis Treat. 5: 433–49. doi:10.2147/NDT.S5700. PMC 2732010. PMID 19721723.
- ^ A b Krishnan, V .; Nestler, E. (2008). "The molecular neurobiology of depression". Příroda. 455 (7215): 894–902. Bibcode:2008Natur.455..894K. doi:10.1038/nature07455. PMC 2721780. PMID 18923511.
- ^ Pezawas, L.; Meyer-Lindenberg, A.; Goldman, A. L.; Verchinski, B. A.; Chen, G .; Kolachana, B. S.; Egan, M. F.; Mattay, V. S.; Hariri, A. R.; Weinberger, D. R. (2008). "Evidence of biologic epistasis between BDNF and SLC6A4 and implications for depression". Molekulární psychiatrie. 13 (7): 709–716. doi:10.1038/mp.2008.32. PMID 18347599.
- ^ Converge Consortium; Bigdeli, Tim B.; Kretzschmar, Warren; Li, Yihan; Liang, Jieqin; Song, Li; Hu, Jingchu; Li, Qibin; Jin, Wei; Hu, Zhenfei; Wang, Guangbiao; Wang, Linmao; Qian, Puyi; Liu, Yuan; Jiang, Tao; Lu, Yao; Zhang, Xiuqing; Yin, Ye; Li, Yingrui; Xu, Xun; Gao, Jingfang; Reimers, Mark; Webb, Todd; Riley, Brien; Bacanu, Silviu; Peterson, Roseann E.; Chen, Yiping; Zhong, Hui; Liu, Zhengrong; et al. (2015). „Řídké sekvenování celého genomu identifikuje dva lokusy pro depresivní poruchu“. Příroda. 523 (7562): 588–91. Bibcode:2015Natur.523..588C. doi:10.1038 / příroda14659. PMC 4522619. PMID 26176920.
- ^ Smoller, Jordan W (2015). "The Genetics of Stress-Related Disorders: PTSD, Depression, and Anxiety Disorders". Neuropsychofarmakologie. 41 (1): 297–319. doi:10.1038/npp.2015.266. PMC 4677147. PMID 26321314.
- ^ Zhao, Xiaofeng; Huang, Yinglin; Ma, Hui; Jin, Qiu; Wang, Yuan; Zhu, Gang (15 August 2013). "Association between major depressive disorder and the norepinephrine transporter polymorphisms T-182C and G1287A: a meta-analysis". Journal of afektivní poruchy. 150 (1): 23–28. doi:10.1016/j.jad.2013.03.016. ISSN 1573-2517. PMID 23648227.
- ^ Lohoff, Falk W. (6 December 2016). "Overview of the Genetics of Major Depressive Disorder". Aktuální zprávy z psychiatrie. 12 (6): 539–546. doi:10.1007/s11920-010-0150-6. ISSN 1523-3812. PMC 3077049. PMID 20848240.
- ^ López-León, S.; Janssens, A. C. J. W.; González-Zuloeta Ladd, A. M.; Del-Favero, J.; Claes, S. J.; Oostra, B. A.; van Duijn, C. M. (1 August 2008). "Meta-analyses of genetic studies on major depressive disorder". Molekulární psychiatrie. 13 (8): 772–785. doi:10.1038/sj.mp.4002088. ISSN 1476-5578. PMID 17938638.
- ^ A b Carlson, Neil R. (2013). Fyziologie chování (11. vydání). Boston: Pearson. pp. 578–582. ISBN 978-0-205-23939-9. OCLC 769818904.
- ^ A b C Adrien J.. Neurobiological bases for the relation between sleep and depression. Recenze spánkové medicíny. 2003;6(5):341–51. doi:10.1053/smrv.2001.0200. PMID 12531125.
- ^ A b Terman M. Evolving applications of light therapy. Recenze spánkové medicíny. 2007;11(6):497–507. doi:10.1016/j.smrv.2007.06.003. PMID 17964200.
- ^ Benedetti F, Barbini B, Colombo C, Smeraldi E. Chronotherapeutics in a psychiatric ward. Recenze spánkové medicíny. 2007;11(6):509–22. doi:10.1016/j.smrv.2007.06.004. PMID 17689120.
- ^ Zhai, Long; Zhang, Hua; Zhang, Dongfeng (1 September 2015). "Sleep Duration and Depression Among Adults: A Meta-Analysis of Prospective Studies". Deprese a úzkost. 32 (9): 664–670. doi:10.1002/da.22386. ISSN 1520-6394. PMID 26047492.
- ^ Germain, Anne; Kupfer, David J. (6 December 2016). "Circadian rhythm disturbances in depression". Lidská psychofarmakologie. 23 (7): 571–585. doi:10.1002/hup.964. ISSN 0885-6222. PMC 2612129. PMID 18680211.
- ^ Savitz, Jonathan B.; Drevets, Wayne C. (1 April 2013). "Neuroreceptor imaging in depression". Neurobiologie nemocí. 52: 49–65. doi:10.1016/j.nbd.2012.06.001. ISSN 1095-953X. PMID 22691454.
- ^ Carlson, Neil R. (2005). Foundations of Physiological Psychology (6. vydání). Boston: Pearson A and B. p.108. ISBN 978-0-205-42723-9. OCLC 60880502.
- ^ Marchand; Valentina; Jensen. "Neurobiology of Mood disorders". Nemocniční lékař: 17–26.
- ^ Hjorth, S; Bengtsson, HJ; Kullberg, A; Carlzon, D; Peilot, H; Auerbach, SB (June 2000). "Serotonin autoreceptor function and antidepressant drug action". Journal of Psychopharmacology (Oxford, Anglie). 14 (2): 177–85. doi:10.1177/026988110001400208. PMID 10890313.
- ^ A b COWEN, P (September 2008). "Serotonin and depression: pathophysiological mechanism or marketing myth?". Trendy ve farmakologických vědách. 29 (9): 433–436. doi:10.1016/j.tips.2008.05.004. PMID 18585794.
- ^ A b Harmer, CJ (November 2008). "Serotonin and emotional processing: does it help explain antidepressant drug action?". Neurofarmakologie. 55 (6): 1023–8. doi:10.1016/j.neuropharm.2008.06.036. PMID 18634807.
- ^ Dunlop, Boadie W.; Nemeroff, Charles B. (1 April 2007). "The Role of Dopamine in the Pathophysiology of Depression". Archiv obecné psychiatrie. 64 (3): 327–37. doi:10.1001/archpsyc.64.3.327. ISSN 0003-990X. PMID 17339521.
- ^ Willner, Paul (1 December 1983). "Dopamine and depression: A review of recent evidence. I. Empirical studies". Recenze výzkumu mozku. 6 (3): 211–224. doi:10.1016/0165-0173(83)90005-X. PMID 6140979.
- ^ A b HASLER, GREGOR (4 December 2016). "Pathophysiology of Depression: Do We Have Any Solid Evidence of Interest to Clinicians?". Světová psychiatrie. 9 (3): 155–161. doi:10.1002/j.2051-5545.2010.tb00298.x. ISSN 1723-8617. PMC 2950973. PMID 20975857.
- ^ Kunugi, Hiroshi; Hori, Hiroaki; Ogawa, Shintaro (1 October 2015). "Biochemical markers subtyping major depressive disorder". Psychiatrie a klinické neurovědy. 69 (10): 597–608. doi:10.1111/pcn.12299. ISSN 1440-1819. PMID 25825158.
- ^ Lammel, S.; Tye, K. M.; Warden, M. R. (1 January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Geny, mozek a chování. 13 (1): 38–51. doi:10.1111/gbb.12049. ISSN 1601-183X. PMID 23682971.
- ^ Delgado PL, Moreno FA (2000). "Role of norepinephrine in depression". J Clin Psychiatry. 61 Suppl 1: 5–12. PMID 10703757.
- ^ Ruhe, HG; Mason, NS; Schene, AH (2007). "Mood is indirectly related to serotonin, norepinephrine and dopamine levels in humans: a meta-analysis of monoamine depletion studies". Molekulární psychiatrie. 12 (4): 331–359. doi:10.1038/sj.mp.4001949. PMID 17389902.
- ^ Meyer JH, Ginovart N, Boovariwala A, et al. (Listopad 2006). "Elevated monoamine oxidase a levels in the brain: An explanation for the monoamine imbalance of major depression". Archiv obecné psychiatrie. 63 (11): 1209–16. doi:10.1001 / archpsyc.63.11.1209. PMID 17088501.
- ^ Huang SY, Lin MT, Lin WW, Huang CC, Shy MJ, Lu RB (19 December 2007). „Sdružení polymorfismů monoaminooxidázy A (MAOA) a klinické podskupiny hlavních depresivních poruch v čínské populaci Han“. World Journal of Biological Psychiatry. 10 (4 Pt 2): 544–51. doi:10.1080/15622970701816506. PMID 19224413.
- ^ Yu YW, Tsai SJ, Hong CJ, Chen TJ, Chen MC, Yang CW (září 2005). „Asociační studie monoaminooxidázy a polymorfismu promotoru genů s velkou depresivní poruchou a antidepresivní odpovědí“. Neuropsychofarmakologie. 30 (9): 1719–23. doi:10.1038 / sj.npp.1300785. PMID 15956990.
- ^ Cicchetti D, Rogosch FA, Sturge-Apple ML (2007). "Interactions of child maltreatment and serotonin transporter and monoamine oxidase A polymorphisms: depressive symptomatology among adolescents from low socioeconomic status backgrounds". Dev. Psychopathol. 19 (4): 1161–80. doi:10.1017/S0954579407000600. PMID 17931441.
- ^ Castrén, E (2005). "Is mood chemistry?". Recenze přírody Neurovědy. 6 (3): 241–46. doi:10.1038/nrn1629. PMID 15738959.
- ^ Hirschfeld RM (2000). "History and evolution of the monoamine hypothesis of depression". Journal of Clinical Psychiatry. 61 Suppl 6: 4–6. PMID 10775017.
- ^ Davis, Kenneth L.; et al., eds. (2002). Neuropsychopharmacology : the fifth generation of progress : an official publication of the American College of Neuropsychopharmacology (5. vydání). Philadelphia, Pa .: Lippincott Williams & Wilkins. pp. 1139–1163. ISBN 9780781728379.
- ^ Jacobsen, Jacob P. R.; Medvedev, Ivan O.; Caron, Marc G. (5 September 2012). "The 5-HT deficiency theory of depression: perspectives from a naturalistic 5-HT deficiency model, the tryptophan hydroxylase 2Arg439His knockin mouse". Filozofické transakce Královské společnosti B: Biologické vědy. 367 (1601): 2444–2459. doi:10.1098/rstb.2012.0109. ISSN 0962-8436. PMC 3405680. PMID 22826344.
- ^ Delgado PL, Moreno FA (2000). "Role of norepinephrine in depression". J Clin Psychiatry. 61 Suppl 1: 5–12. PMID 10703757.
- ^ Delgado PL (2000). "Depression: the case for a monoamine deficiency". Journal of Clinical Psychiatry. 61 Suppl 6: 7–11. PMID 10775018.
- ^ Andrews, Paul W.; Bharwani, Aadil; Lee, Kyuwon R.; Fox, Molly; Thomson, J. Anderson (1 April 2015). "Is serotonin an upper or a downer? The evolution of the serotonergic system and its role in depression and the antidepressant response". Neurovědy a biobehaviorální recenze. 51: 164–188. doi:10.1016/j.neubiorev.2015.01.018. ISSN 1873-7528. PMID 25625874.
- ^ Lacasse, Jeffrey R.; Leo, Jonathan (8 November 2005). "Serotonin and Depression: A Disconnect between the Advertisements and the Scientific Literature". PLOS Medicine. 2 (12): e392. doi:10.1371/journal.pmed.0020392. PMC 1277931. PMID 16268734.

- ^ Savitz, Jonathan; Drevets, Wayne (2013). "Neuroreceptor imaging in depression". Neurobiologie nemocí. 52: 49–65. doi:10.1016/j.nbd.2012.06.001. PMID 22691454.
- ^ Gryglewski, G; Lanzenberger, R; Kranz, GS; Cumming, P (July 2014). "Meta-analysis of molecular imaging of serotonin transporters in major depression". Journal of Cerebral Blood Flow and Metabolism. 34 (7): 1096–103. doi:10.1038/jcbfm.2014.82. PMC 4083395. PMID 24802331.
- ^ Kambeitz, JP; Howes, OD (1 November 2015). "The serotonin transporter in depression: Meta-analysis of in vivo and post mortem findings and implications for understanding and treating depression". Journal of afektivní poruchy. 186: 358–66. doi:10.1016/j.jad.2015.07.034. PMID 26281039.
- ^ Wang, L; Zhou, C; Zhu, D; Wang, X; Fang, L; Zhong, J; Mao, Q; Sun, L; Gong, X; Xia, J; Lian, B; Xie, P (13 September 2016). "Serotonin-1A receptor alterations in depression: a meta-analysis of molecular imaging studies". Psychiatrie BMC. 16 (1): 319. doi:10.1186/s12888-016-1025-0. PMC 5022168. PMID 27623971.
- ^ Li, Z; Ahoj; Tang, J; Zong, X; Hu, M; Chen, X (15 March 2015). "Molecular imaging of striatal dopamine transporters in major depression—a meta-analysis". Journal of afektivní poruchy. 174: 137–43. doi:10.1016/j.jad.2014.11.045. PMID 25497470.
- ^ Bourke, Cecilia; Douglas, Katie; Porter, Richard (1 August 2010). "Processing of facial emotion expression in major depression: a review". The Australian and New Zealand Journal of Psychiatry. 44 (8): 681–696. doi:10.3109/00048674.2010.496359. ISSN 1440-1614. PMID 20636189.
- ^ Dalili, M. N.; Penton-Voak, I. S.; Harmer, C. J.; Munafò, M. R. (7 December 2016). "Meta-analysis of emotion recognition deficits in major depressive disorder". Psychologická medicína. 45 (6): 1135–1144. doi:10.1017/S0033291714002591. ISSN 0033-2917. PMC 4712476. PMID 25395075.
- ^ Groenewold, Nynke A.; Opmeer, Esther M.; de Jonge, Peter; Aleman, André; Costafreda, Sergi G. (1 February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Neurovědy a biobehaviorální recenze. 37 (2): 152–163. doi:10.1016/j.neubiorev.2012.11.015. ISSN 1873-7528. PMID 23206667.
- ^ Müller, VI; Cieslik, EC; Serbanescu, I; Laird, AR; Fox, PT; Eickhoff, SB (1 January 2017). "Altered Brain Activity in Unipolar Depression Revisited: Meta-analyses of Neuroimaging Studies". JAMA psychiatrie. 74 (1): 47–55. doi:10.1001/jamapsychiatry.2016.2783. PMC 5293141. PMID 27829086.
- ^ Harmer, C. J.; Goodwin, G. M.; Cowen, P. J. (31 July 2009). "Why do antidepressants take so long to work? A cognitive neuropsychological model of antidepressant drug action". British Journal of Psychiatry. 195 (2): 102–108. doi:10.1192/bjp.bp.108.051193. PMID 19648538.
- ^ Delaveau, P; Jabourian, M; Lemogne, C; Guionnet, S; Bergouignan, L; Fossati, P (April 2011). "Brain effects of antidepressants in major depression: a meta-analysis of emotional processing studies". Journal of afektivní poruchy. 130 (1–2): 66–74. doi:10.1016/j.jad.2010.09.032. PMID 21030092.
- ^ Pringle, A; Harmer, CJ (December 2015). "The effects of drugs on human models of emotional processing: an account of antidepressant drug treatment". Dialogy v klinické neurovědě. 17 (4): 477–87. PMC 4734885. PMID 26869848.
- ^ A b C Hamilton, J. Paul; Etkin, Amit; Furman, Daniella J.; Lemus, Maria G.; Johnson, Rebecca F.; Gotlib, Ian H. (1 July 2012). "Functional neuroimaging of major depressive disorder: a meta-analysis and new integration of base line activation and neural response data". American Journal of Psychiatry. 169 (7): 693–703. doi:10.1176/appi.ajp.2012.11071105. ISSN 1535-7228. PMID 22535198.
- ^ Drevets, WC; Cena, JL; Furey, ML (September 2008). "Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression". Struktura a funkce mozku. 213 (1–2): 93–118. doi:10.1007/s00429-008-0189-x. PMC 2522333. PMID 18704495.
- ^ Drevets, WC (April 2001). "Neuroimaging and neuropathological studies of depression: implications for the cognitive-emotional features of mood disorders". Aktuální názor v neurobiologii. 11 (2): 240–9. doi:10.1016/S0959-4388(00)00203-8. PMID 11301246.
- ^ Mayberg, Helen (1 August 1997). "Limbic-cortical dysregulation: a proposed model of depression". The Journal of Neuropsychiatry and Clinical Neurosciences. 9 (3): 471–481. doi:10.1176/jnp.9.3.471. ISSN 0895-0172. PMID 9276848.
- ^ A b Graham, Julia; Salimi-Khorshidi, Gholamreza; Hagan, Cindy; Walsh, Nicholas; Goodyer, Ian; Lennox, Belinda; Suckling, John (1 November 2013). "Meta-analytic evidence for neuroimaging models of depression: State or trait?". Journal of afektivní poruchy. 151 (2): 423–431. doi:10.1016/j.jad.2013.07.002. PMID 23890584.
- ^ Anticevic, A; Schleifer, C; Youngsun, TC (December 2015). "Emotional and cognitive dysregulation in schizophrenia and depression: understanding common and distinct behavioral and neural mechanisms". Dialogy v klinické neurovědě. 17 (4): 421–34. PMC 4734880. PMID 26869843.
- ^ Rømer Thomsen, K; Whybrow, PC; Kringelbach, ML (2015). "Reconceptualizing anhedonia: novel perspectives on balancing the pleasure networks in the human brain". Hranice v behaviorální neurovědě. 9: 49. doi:10.3389/fnbeh.2015.00049. PMC 4356228. PMID 25814941.
- ^ Treadway, MT; Zald, DH (January 2011). "Reconsidering anhedonia in depression: lessons from translational neuroscience". Neurovědy a biobehaviorální recenze. 35 (3): 537–55. doi:10.1016/j.neubiorev.2010.06.006. PMC 3005986. PMID 20603146.
- ^ A b C Sternat T, Katzman MA (1 January 2016). "Neurobiology of hedonic tone: the relationship between treatment-resistant depression, attention-deficit hyperactivity disorder, and substance abuse". Neuropsychiatrická nemoc a léčba. 12: 2149–64. doi:10.2147/NDT.S111818. PMC 5003599. PMID 27601909.
- ^ Russo, SJ; Nestler, EJ (September 2013). "The brain reward circuitry in mood disorders". Recenze přírody. Neurovědy. 14 (9): 609–25. doi:10.1038/nrn3381. PMC 3867253. PMID 23942470.
- ^ Rolls, ET (September 2016). "A non-reward attractor theory of depression" (PDF). Neurovědy a biobehaviorální recenze. 68: 47–58. doi:10.1016/j.neubiorev.2016.05.007. PMID 27181908.
- ^ Miller, CH; Hamilton, JP; Sacchet, MD; Gotlib, IH (October 2015). "Meta-analysis of Functional Neuroimaging of Major Depressive Disorder in Youth". JAMA psychiatrie. 72 (10): 1045–53. doi:10.1001/jamapsychiatry.2015.1376. PMID 26332700.
- ^ Graham, J; Salimi-Khorshidi, G; Hagan, C; Walsh, N; Goodyer, I; Lennox, B; Suckling, J (November 2013). "Meta-analytic evidence for neuroimaging models of depression: state or trait?". Journal of afektivní poruchy. 151 (2): 423–31. doi:10.1016/j.jad.2013.07.002. PMID 23890584.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". Spektra CNS. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
- ^ A b Lammel, S; Tye, KM; Warden, MR (January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Geny, mozek a chování. 13 (1): 38–51. doi:10.1111/gbb.12049. PMID 23682971.
- ^ Groenewold, NA; Opmeer, EM; de Jonge, P; Aleman, A; Costafreda, SG (February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Neurovědy a biobehaviorální recenze. 37 (2): 152–63. doi:10.1016/j.neubiorev.2012.11.015. PMID 23206667.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". Spektra CNS. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
Together, these data suggest the hypothesis that dysfunction of the sgACC results in understimulation of parasympathetic tone in mood disorders.
- ^ Rive, MM; van Rooijen, G; Veltman, DJ; Phillips, ML; Schene, AH; Ruhé, HG (December 2013). "Neural correlates of dysfunctional emotion regulation in major depressive disorder. A systematic review of neuroimaging studies". Neurovědy a biobehaviorální recenze. 37 (10 Pt 2): 2529–53. doi:10.1016/j.neubiorev.2013.07.018. PMID 23928089.
- ^ Dunlop, BW; Mayberg, HS (December 2014). "Neuroimaging-based biomarkers for treatment selection in major depressive disorder". Dialogy v klinické neurovědě. 16 (4): 479–90. PMC 4336918. PMID 25733953.
- ^ Wise, T; Radua, J; Via, E; Cardoner, N; Abe, O; Adams, TM; Amico, F; Cheng, Y; Cole, JH; de Azevedo Marques Périco, C; Dickstein, DP; Farrow, TFD; Frodl, T; Wagner, G; Gotlib, IH; Gruber, O; Ham, BJ; Job, DE; Kempton, MJ; Kim, MJ; Koolschijn, PCMP; Malhi, GS; Mataix-Cols, D; McIntosh, AM; Nugent, AC; O'Brien, JT; Pezzoli, S; Phillips, ML; Sachdev, PS; Salvadore, G; Selvaraj, S; Stanfield, AC; Thomas, AJ; van Tol, MJ; van der Wee, NJA; Veltman, DJ; Young, AH; Fu, CH; Cleare, AJ; Arnone, D (October 2017). "Common and distinct patterns of grey-matter volume alteration in major depression and bipolar disorder: evidence from voxel-based meta-analysis". Molekulární psychiatrie. 22 (10): 1455–1463. doi:10.1038/mp.2016.72. PMC 5622121. PMID 27217146.
- ^ Bora, E; Fornito, A; Pantelis, C; Yücel, M (April 2012). "Gray matter abnormalities in Major Depressive Disorder: a meta-analysis of voxel based morphometry studies". Journal of afektivní poruchy. 138 (1–2): 9–18. doi:10.1016/j.jad.2011.03.049. PMID 21511342.
- ^ Zhang, H; Li, L; Wu, M; Chen, Z; Hu, X; Chen, Y; Zhu, H; Jia, Z; Gong, Q (January 2016). "Brain gray matter alterations in first episodes of depression: A meta-analysis of whole-brain studies". Neurovědy a biobehaviorální recenze. 60: 43–50. doi:10.1016/j.neubiorev.2015.10.011. PMID 26592799.
- ^ Zhao, YJ; Du, MY; Huang, XQ; Lui, S; Chen, ZQ; Liu, J; Luo, Y; Wang, XL; Kemp, GJ; Gong, QY (October 2014). "Brain grey matter abnormalities in medication-free patients with major depressive disorder: a meta-analysis". Psychologická medicína. 44 (14): 2927–37. doi:10.1017/S0033291714000518. PMID 25065859.
- ^ Sacher, J; Neumann, J; Fünfstück, T; Soliman, A; Villringer, A; Schroeter, ML (October 2012). "Mapping the depressed brain: a meta-analysis of structural and functional alterations in major depressive disorder". Journal of afektivní poruchy. 140 (2): 142–8. doi:10.1016/j.jad.2011.08.001. PMID 21890211.
- ^ Arnone, D; Job, D; Selvaraj, S; Abe, O; Amico, F; Cheng, Y; Colloby, SJ; O'Brien, JT; Frodl, T; Gotlib, IH; Ham, BJ; Kim, MJ; Koolschijn, PC; Périco, CA; Salvadore, G; Thomas, AJ; Van Tol, MJ; van der Wee, NJ; Veltman, DJ; Wagner, G; McIntosh, AM (April 2016). "Computational meta-analysis of statistical parametric maps in major depression". Mapování lidského mozku. 37 (4): 1393–404. doi:10.1002/hbm.23108. PMC 6867585. PMID 26854015.
- ^ Schmaal, L; Hibar, DP; Sämann, PG; Hall, GB; Baune, BT; Jahanshad, N; Cheung, JW; van Erp, TGM; Bos, D; Ikram, MA; Vernooij, MW; Niessen, WJ; Tiemeier, H; Hofman, A; Wittfeld, K; Grabe, HJ; Janowitz, D; Bülow, R; Selonke, M; Völzke, H; Grotegerd, D; Dannlowski, U; Arolt, V; Opel, N; Heindel, W; Kugel, H; Hoehn, D; Czisch, M; Couvy-Duchesne, B; Rentería, ME; Strike, LT; Wright, MJ; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Goya-Maldonado, R; Gruber, O; Krämer, B; Hatton, SN; Lagopoulos, J; Hickie, IB; Frodl, T; Carballedo, A; Frey, EM; van Velzen, LS; Penninx, BWJH; van Tol, MJ; van der Wee, NJ; Davey, CG; Harrison, BJ; Mwangi, B; Cao, B; Soares, JC; Veer, IM; Walter, H; Schoepf, D; Zurowski, B; Konrad, C; Schramm, E; Normann, C; Schnell, K; Sacchet, MD; Gotlib, IH; MacQueen, GM; Godlewska, BR; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Hall, J; Sussmann, JE; Li, M; Walter, M; Aftanas, L; Brack, I; Bokhan, NA; Thompson, PM; Veltman, DJ (June 2017). "Cortical abnormalities in adults and adolescents with major depression based on brain scans from 20 cohorts worldwide in the ENIGMA Major Depressive Disorder Working Group". Molekulární psychiatrie. 22 (6): 900–909. doi:10.1038/mp.2016.60. PMC 5444023. PMID 27137745.
- ^ Schmaal, L; Veltman, DJ; van Erp, TG; Sämann, PG; Frodl, T; Jahanshad, N; Loehrer, E; Tiemeier, H; Hofman, A; Niessen, WJ; Vernooij, MW; Ikram, MA; Wittfeld, K; Grabe, HJ; Block, A; Hegenscheid, K; Völzke, H; Hoehn, D; Czisch, M; Lagopoulos, J; Hatton, SN; Hickie, IB; Goya-Maldonado, R; Krämer, B; Gruber, O; Couvy-Duchesne, B; Rentería, ME; Strike, LT; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Wright, MJ; Hall, GB; MacQueen, GM; Frey, EM; Carballedo, A; van Velzen, LS; van Tol, MJ; van der Wee, NJ; Veer, IM; Walter, H; Schnell, K; Schramm, E; Normann, C; Schoepf, D; Konrad, C; Zurowski, B; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Sussmann, JE; Godlewska, BR; Cowen, PJ; Fischer, FH; Rose, M; Penninx, BW; Thompson, PM; Hibar, DP (červen 2016). „Subkortikální změny mozku u závažné depresivní poruchy: zjištění pracovní skupiny ENIGMA pro velkou depresivní poruchu“. Molekulární psychiatrie. 21 (6): 806–12. doi:10.1038 / mp.2015.69. PMC 4879183. PMID 26122586.
- ^ A b C d Chen, G; Hu, X; Li, L; Huang, X; Lui, S; Kuang, W; Ai, H; Bi, F; Gu, Z; Gong, Q (24. února 2016). „Deorganizace architektury bílé hmoty u velké depresivní poruchy: metaanalýza difuzního tenzorového zobrazování s prostorovou statistikou založenou na traktu“. Vědecké zprávy. 6: 21825. Bibcode:2016NatSR ... 621825C. doi:10.1038 / srep21825. PMC 4764827. PMID 26906716.
- ^ A b C d Chen, G; Guo, Y; Zhu, H; Kuang, W; Bi, F; Ai, H; Gu, Z; Huang, X; Lui, S; Gong, Q (2. června 2017). „Vnitřní narušení mikroarchitektury bílé hmoty v první epizodě depresivní poruchy, která dosud nebyla léčena: metaanalýza difúzního tenzorového zobrazování založená na voxelech“. Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 76: 179–187. doi:10.1016 / j.pnpbp.2017.03.011. PMID 28336497.
- ^ A b C d Jiang, J; Zhao, YJ; Hu, XY; Du, MY; Chen, ZQ; Wu, M; Li, KM; Zhu, HY; Kumar, P; Gong, QY (květen 2017). „Mikrostrukturální abnormality mozku u pacientů bez deprese s těžkou depresivní poruchou: systematický přehled a metaanalýza difuzního tenzorového zobrazování“. Journal of Psychiatry & Neuroscience. 42 (3): 150–163. doi:10.1503 / jpn.150341. PMC 5403660. PMID 27780031.
- ^ A b Wise, T; Radua, J; Nortje, G; Cleare, AJ; Young, AH; Arnone, D (15. února 2016). „Meta-analytické důkazy o strukturní diskonektivitě u velké deprese a bipolární poruchy na bázi voxelu“. Biologická psychiatrie. 79 (4): 293–302. doi:10.1016 / j.biopsych.2015.03.004. PMID 25891219.
- ^ Zhou, M; Hu, X; Lu, L; Zhang, L; Chen, L; Gong, Q; Huang, X (3. dubna 2017). „Vnitřní mozková aktivita v klidovém stavu u dospělých s depresivní poruchou: metaanalýza“. Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 75: 157–164. doi:10.1016 / j.pnpbp.2017.02.001. PMID 28174129.
- ^ Li, W; Chen, Z; Wu, M; Zhu, H; Gu, L; Zhao, Y; Kuang, W; Bi, F; Kemp, GJ; Gong, Q (1. března 2017). „Charakterizace průtoku krve mozkem a amplituda nízkofrekvenčních fluktuací u depresivní poruchy: multimodální metaanalýza“. Journal of afektivní poruchy. 210: 303–311. doi:10.1016 / j.jad.2016.12.032. PMID 28068619.
- ^ Kühn, S; Gallinat, J (březen 2013). „Aktivita mozku v klidovém stavu u schizofrenie a velké deprese: kvantitativní metaanalýza“. Bulletin schizofrenie. 39 (2): 358–65. doi:10.1093 / schbul / sbr151. PMC 3576173. PMID 22080493.
- ^ A b Fitzgerald, PB; Laird, AR; Maller, J; Daskalakis, ZJ (červen 2008). „Metaanalytická studie změn v aktivaci mozku při depresi“. Mapování lidského mozku. 29 (6): 683–95. doi:10,1002 / hbm.20426. PMC 2873772. PMID 17598168.
- ^ Carlson, Neil R. (2012). Physiology of Behavior Books a La Carte Edition (11. vydání). Boston: Pearson College Div. ISBN 978-0-205-23981-8.
- ^ A b Miller, Chris H .; Hamilton, J. Paul; Sacchet, Matthew D .; Gotlib, Ian H. (1. října 2015). „Metaanalýza funkčního neuroimagingu depresivní poruchy u mládeže“. JAMA psychiatrie. 72 (10): 1045–1053. doi:10.1001 / jamapsychiatry.2015.1376. ISSN 2168-6238. PMID 26332700.
- ^ Wessa, Michèle; Lois, Giannis (30. listopadu 2016). „Mozkové funkční účinky psychofarmakologické léčby závažné deprese: zaměření na nervový obvod afektivního zpracování“. Současná neurofarmakologie. 13 (4): 466–479. doi:10.2174 / 1570159X13666150416224801. ISSN 1570-159X. PMC 4790403. PMID 26412066.
- ^ Outhred, Tim; Hawkshead, Brittany E .; Sázka, Tor D .; Das, Pritha; Malhi, Gin S .; Kemp, Andrew H. (1. září 2013). „Akutní nervové účinky selektivních inhibitorů zpětného vychytávání serotoninu versus inhibitory zpětného vychytávání noradrenalinu na zpracování emocí: důsledky pro rozdílnou účinnost léčby“ (PDF). Neurovědy a biobehaviorální recenze. 37 (8): 1786–1800. doi:10.1016 / j.neubiorev.2013.07.010. ISSN 1873-7528. PMID 23886514.
- ^ Hamilton, J. Paul; Siemer, Matthias; Gotlib, Ian H. (8. září 2009). „Objem Amygdaly u depresivní poruchy: metaanalýza studií magnetické rezonance“. Molekulární psychiatrie. 13 (11): 993–1000. doi:10.1038 / mp.2008.57. ISSN 1359-4184. PMC 2739676. PMID 18504424.
- ^ Palmer, Susan M .; Crewther, Sheila G .; Carey, Leeanne M. (14. ledna 2015). „Metaanalýza změn v mozkové aktivitě při klinické depresi“. Frontiers in Human Neuroscience. 8: 1045. doi:10.3389 / fnhum.2014.01045. ISSN 1662-5161. PMC 4294131. PMID 25642179.
- ^ Fitzgerald, Paul B .; Laird, Angela R .; Maller, Jerome; Daskalakis, Zafiris J. (5. prosince 2016). „Meta-analytická studie změn v aktivaci mozku při depresi“. Mapování lidského mozku. 29 (6): 683–695. doi:10,1002 / hbm.20426. ISSN 1065-9471. PMC 2873772. PMID 17598168.
- ^ Cole, James; Costafreda, Sergi G .; McGuffin, Peter; Fu, Cynthia H. Y. (1. listopadu 2011). „Hipokampální atrofie při depresi první epizody: metaanalýza studií magnetické rezonance“. Journal of afektivní poruchy. 134 (1–3): 483–487. doi:10.1016 / j.jad.2011.05.057. ISSN 1573-2517. PMID 21745692.
- ^ Videbech, Poul; Ravnkilde, Barbara (1. listopadu 2004). „Objem hipokampu a deprese: metaanalýza studií MRI“. American Journal of Psychiatry. 161 (11): 1957–1966. doi:10.1176 / appi.ajp.161.11.1957. ISSN 0002-953X. PMID 15514393.
- ^ Mahar, já; Bambico, FR; Mechawar, N; Nobrega, JN (leden 2014). "Stres, serotonin a hipokampální neurogeneze ve vztahu k depresi a antidepresivním účinkům". Neurovědy a biobehaviorální recenze. 38: 173–92. doi:10.1016 / j.neubiorev.2013.11.009. PMID 24300695.
- ^ Willner, P; Scheel-Krüger, J; Belzung, C (prosinec 2013). „Neurobiologie deprese a antidepresiva“. Neurovědy a biobehaviorální recenze. 37 (10 Pt 1): 2331–71. doi:10.1016 / j.neubiorev.2012.12.007. PMID 23261405.
- ^ Pariante CM, Lightman SL (září 2008). „Osa HPA v těžké depresi: klasické teorie a nový vývoj“. Trendy Neurosci. 31 (9): 464–468. doi:10.1016 / j.tins.2008.06.006. PMID 18675469.
- ^ Belvederi Murri, Martino; Pariante, Carmine; Mondelli, Valeria; Masotti, Mattia; Atti, Anna Rita; Mellacqua, Zefiro; Antonioli, Marco; Ghio, Lucio; Menchetti, Marco; Zanetidou, Stamatula; Innamorati, Marco; Amore, Mario (1. března 2014). „Osa HPA a stárnutí v depresi: systematický přehled a metaanalýza“. Psychoneuroendokrinologie. 41: 46–62. doi:10.1016 / j.psyneuen.2013.12.004. ISSN 1873-3360. PMID 24495607.
- ^ Juruena, Mario F. (1. září 2014). „Stres v raném věku a osa HPA spouští opakující se depresi v dospělosti“. Epilepsie a chování. 38: 148–159. doi:10.1016 / j.yebeh.2013.10.020. ISSN 1525-5069. PMID 24269030.
- ^ Heim, Christine; Newport, D. Jeffrey; Mletzko, Tanja; Miller, Andrew H .; Nemeroff, Charles B. (1. srpna 2008). „Souvislost mezi dětským traumatem a depresí: poznatky ze studií osy HPA u lidí“. Psychoneuroendokrinologie. 33 (6): 693–710. doi:10.1016 / j.psyneuen.2008.03.008. ISSN 0306-4530. PMID 18602762.
- ^ Arana, G. W .; Baldessarini, R. J .; Ornsteen, M. (1. prosince 1985). „Test potlačení dexamethasonu pro diagnostiku a prognózu na psychiatrii. Komentář a recenze“. Archiv obecné psychiatrie. 42 (12): 1193–1204. doi:10.1001 / archpsyc.1985.01790350067012. ISSN 0003-990X. PMID 3000317.
- ^ Varghese, Femina P .; Brown, E. Sherwood (1. ledna 2001). „Osa hypotalamus-hypofýza-nadledvina u depresivní poruchy: krátký základ pro lékaře primární péče“. Společník primární péče pro Journal of Clinical Psychiatry. 3 (4): 151–155. doi:10,4088 / ks. V03n0401. ISSN 1523-5998. PMC 181180. PMID 15014598.
- ^ Gilbertson, M. W .; Shenton, M. E.; Ciszewski, A .; Kasai, K .; Lasko, N. B .; Orr, S. P .; Pitman, R. K. (2002). „Menší objem hipokampu předpovídá patologickou zranitelnost vůči psychickému traumatu“. Přírodní neurovědy. 5 (11): 1242–7. doi:10.1038 / nn958. PMC 2819093. PMID 12379862.
- ^ Vythilingam, Meena; Vermetten, Eric; Anderson, George M .; Luckenbaugh, David; Anderson, Eric R .; Snow, Joseph; Staib, Lawrence H .; Charney, Dennis S .; Bremner, J. Douglas (15. července 2004). "Objem hipokampu, paměť a stav kortizolu u depresivní poruchy: účinky léčby". Biologická psychiatrie. 56 (2): 101–112. doi:10.1016 / j.biopsych.2004.04.002. ISSN 0006-3223. PMID 15231442.
- ^ A b C Krishnan, V; Nestler, EJ (2011). Živočišné modely deprese: molekulární perspektivy. Aktuální témata v behaviorálních neurovědách. 7. s. 121–47. doi:10.1007/7854_2010_108. ISBN 978-3-642-19702-4. PMC 3270071. PMID 21225412.
- ^ Belzung, C; Lemoine, M (7. listopadu 2011). „Kritéria platnosti pro zvířecí modely psychiatrických poruch: zaměření na úzkostné poruchy a deprese“. Biologie nálady a úzkostných poruch. 1 (1): 9. doi:10.1186/2045-5380-1-9. PMC 3384226. PMID 22738250.
- ^ A b Alcantara, Lyonna F .; Chvála, Eric M .; Bolanos-Guzman, Carlos A. (2018). „26. Zvířecí modely poruch nálady“. V Charney, Dennis; Sklar, Pamela; Nestler, Eric; Buxbaum, Joseph (eds.). Charney & Nestler's Neurobiology of Mental Illness (5. vydání). New York: Oxford University Press. 329–333.
- ^ Yan, HC; Cao, X; Das, M; Zhu, XH; Gao, TM (srpen 2010). „Behaviorální zvířecí modely deprese“. Bulletin neurovědy. 26 (4): 327–37. doi:10.1007 / s12264-010-0323-7. PMC 5552573. PMID 20651815.
- ^ Czéh, B; Fuchs, E; Wiborg, O; Simon, M (4. ledna 2016). "Zvířecí modely těžké deprese a jejich klinické důsledky". Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 64: 293–310. doi:10.1016 / j.pnpbp.2015.04.004. PMID 25891248.
- ^ A b C Yang, Y; Wang, H; Hu, J; Hu, H (únor 2018). „Laterální habenula v patofyziologii deprese“. Aktuální názor v neurobiologii. 48: 90–96. doi:10.1016 / j.conb.2017.10.024. PMID 29175713.
- ^ Proulx, CD; Hikosaka, O; Malinow, R (září 2014). „Zpracování odměn postranním habenulem v normálním a depresivním chování“. Přírodní neurovědy. 17 (9): 1146–52. doi:10.1038 / nn.3779. PMC 4305435. PMID 25157511.
- ^ Belujon, P; Grace, AA (1. prosince 2017). „Dysregulace dopaminového systému u depresivních poruch“. International Journal of Neuropsychopharmacology. 20 (12): 1036–1046. doi:10.1093 / ijnp / pyx056. PMC 5716179. PMID 29106542.
- ^ A b Knowland, D; Lim, BK (5. ledna 2018). „Okruhové rámce depresivního chování: Role obvodů odměn a další“. Farmakologická biochemie a chování. 174: 42–52. doi:10.1016 / j.pbb.2017.12.010. PMC 6340396. PMID 29309799.
- ^ Heller, AS (2016). „Kortikálně-subkortikální interakce při depresi: od zvířecích modelů k lidské psychopatologii“. Frontiers in Systems Neuroscience. 10: 20. doi:10.3389 / fnsys.2016.00020. PMC 4780432. PMID 27013988.
- ^ Christopher Pittenger; Ronald S Duman (2008). „Stres, deprese a neuroplasticita: konvergence mechanismů“. Neuropsychofarmakologie. 33 (1): 88–109. doi:10.1038 / sj.npp.1301574. PMID 17851537.
- ^ Brunoni, André Russowsky; Lopes, Mariana; Fregni, Felipe (1. prosince 2008). „Systematický přehled a metaanalýza klinických studií o depresích a hladinách BDNF: důsledky pro roli neuroplasticity v depresi“. International Journal of Neuropsychopharmacology. 11 (8): 1169–1180. doi:10.1017 / S1461145708009309. ISSN 1461-1457. PMID 18752720.
- ^ Serafini, Gianluca (22. června 2012). „Neuroplasticita a velká deprese, role moderních antidepresiv“. World Journal of Psychiatry. 2 (3): 49–57. doi:10,5498 / wjp.v2.i3.49. ISSN 2220-3206. PMC 3782176. PMID 24175168.
- ^ Krishnadas, Rajeev; Cavanagh, Jonathan (1. května 2012). „Deprese: zánětlivé onemocnění?“. Časopis neurologie, neurochirurgie a psychiatrie. 83 (5): 495–502. doi:10.1136 / jnnp-2011-301779. ISSN 1468-330x. PMID 22423117.
- ^ Patel, Amisha (1. září 2013). „Recenze: role zánětu při depresi“. Psychiatria Danubina. 25 Suppl 2: S216–223. ISSN 0353-5053. PMID 23995180.
- ^ Dowlati, Jekta; Herrmann, Nathan; Swardfager, Walter; Liu, Helena; Předstírat, Lauren; Reim, Elyse K .; Lanctôt, Krista L. (1. března 2010). „Metaanalýza cytokinů při závažné depresi“. Biologická psychiatrie. 67 (5): 446–457. doi:10.1016 / j.biopsych.2009.09.033. ISSN 1873-2402. PMID 20015486.
- ^ Dantzer, Robert; O’Connor, Jason C .; Freund, Gregory G .; Johnson, Rodney W .; Kelley, Keith W. (3. prosince 2016). „Od zánětu k nemoci a depresi: když si imunitní systém podrobí mozek“. Recenze přírody Neurovědy. 9 (1): 46–56. doi:10.1038 / nrn2297. ISSN 1471-003X. PMC 2919277. PMID 18073775.
- ^ Hiles, Sarah A .; Baker, Amanda L .; de Malmanche, Theo; Attia, John (1. října 2012). „Metaanalýza rozdílů v IL-6 a IL-10 mezi lidmi s depresí a bez ní: zkoumání příčin heterogenity“. Mozek, chování a imunita. 26 (7): 1180–1188. doi:10.1016 / j.bbi.2012.06.001. ISSN 1090-2139. PMID 22687336.
- ^ Howren, M. Bryant; Lamkin, Donald M .; Suls, Jerry (1. února 2009). „Asociace deprese s C-reaktivním proteinem, IL-1 a IL-6: metaanalýza“. Psychosomatická medicína. 71 (2): 171–186. doi:10.1097 / PSY.0b013e3181907c1b. ISSN 1534-7796. PMID 19188531.
- ^ Maes, Michael (29. dubna 2011). „Deprese je zánětlivé onemocnění, ale klíčovou složkou deprese je buněčně zprostředkovaná imunitní aktivace.“ Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 35 (3): 664–675. doi:10.1016 / j.pnpbp.2010.06.014. ISSN 1878-4216. PMID 20599581.
- ^ Berk, Michael; Williams, Lana J; Jacka, Felice N; O’Neil, Adrienne; Pasco, Julie A; Moylan, Steven; Allen, Nicholas B; Stuart, Amanda L; Hayley, Amie C; Byrne, Michelle L; Maes, Michael (12. září 2013). „Takže deprese je zánětlivé onemocnění, ale odkud pochází zánět?“. BMC Medicine. 11: 200. doi:10.1186/1741-7015-11-200. ISSN 1741-7015. PMC 3846682. PMID 24228900.
- ^ Leonard, Brian; Maes, Michael (1. února 2012). „Mechanické vysvětlení, jak buněčně zprostředkované imunitní aktivace, zánětlivé a oxidační a nitrosativní stresové cesty a jejich pokračování a doprovodné látky hrají roli v patofyziologii unipolární deprese“. Neurovědy a biobehaviorální recenze. 36 (2): 764–785. doi:10.1016 / j.neubiorev.2011.12.005. ISSN 1873-7528. PMID 22197082.
- ^ Raedler, Thomas J. (1. listopadu 2011). "Zánětlivé mechanismy u depresivní poruchy". Aktuální názor na psychiatrii. 24 (6): 519–525. doi:10.1097 / YCO.0b013e32834b9db6. ISSN 1473-6578. PMID 21897249.
- ^ Köhler, Ole; Benros, Michael E .; Nordentoft, Merete; Farkouh, Michael E .; Iyengar, Rupa L .; Mors, Ole; Krogh, Jesper (1. prosince 2014). „Účinek protizánětlivé léčby na depresi, depresivní příznaky a nežádoucí účinky: systematický přehled a metaanalýza randomizovaných klinických studií“. JAMA psychiatrie. 71 (12): 1381–1391. doi:10.1001 / jamapsychiatry.2014.1611. ISSN 2168-6238. PMID 25322082.
- ^ Medina, Johnna L .; Jacquart, Jolene; Smits, Jasper A. J. (2015). „Optimalizace cvičebního předpisu pro depresi: hledání biomarkerů odpovědi“. Současný názor v psychologii. 4: 43–47. doi:10.1016 / j.copsyc.2015.02.003. ISSN 2352-250X. PMC 4545504. PMID 26309904.
- ^ Parker GB, Brotchie H, Graham RK (leden 2017). "Vitamin D a deprese". J Ovlivnit disord. 208: 56–61. doi:10.1016 / j.jad.2016.08.082. PMID 27750060.
- ^ Cenik B, Cenik C, Snyder MP, Brown ES (2017). „Plazmatické steroly a závažnost depresivních příznaků v populační kohortě“. PLOS One. 12 (9): e0184382. Bibcode:2017PLoSO..1284382C. doi:10.1371 / journal.pone.0184382. PMC 5590924. PMID 28886149.
- ^ Black, Catherine N .; Bot, Mariska; Scheffer, Peter G .; Cuijpers, Pim; Penninx, Brenda W. J. H. (1. ledna 2015). „Je deprese spojena se zvýšeným oxidačním stresem? Systematický přehled a metaanalýza.“ Psychoneuroendokrinologie. 51: 164–175. doi:10.1016 / j.psyneuen.2014.09.025. ISSN 1873-3360. PMID 25462890.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; On, Tingting; Lai, Shunkai; Jia, Yanbin (1. ledna 2015). „Metaanalýza markerů oxidačního stresu v depresi“. PLOS One. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371 / journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ Raza MU, Tufan T, Wang Y, Hill C, Zhu MY (srpen 2016). „Poškození DNA u závažných psychiatrických onemocnění“. Neurotox Res. 30 (2): 251–67. doi:10.1007 / s12640-016-9621-9. PMC 4947450. PMID 27126805.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; On, Tingting; Lai, Shunkai; Jia, Yanbin (7. října 2015). „Metaanalýza markerů oxidačního stresu v depresi“. PLOS One. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371 / journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ M, Morris G a Berk (2015). „Mnoho cest k mitochondriální dysfunkci u neuroimunitních a neuropsychiatrických poruch“. BMC Medicine. 13: 68. doi:10.1186 / s12916-015-0310-r. PMC 4382850. PMID 25889215.
- ^ Allen, Josh; Romay-Tallon, Raquel; Brymer, Kyle J .; Caruncho, Hector J .; Kalynchuk, Lisa E. (6. června 2018). „Mitochondrie a nálada: Mitochondriální dysfunkce jako klíčový hráč v projevu deprese“. Frontiers in Neuroscience. 12: 386. doi:10.3389 / fnins.2018.00386. ISSN 1662-453X. PMC 5997778. PMID 29928190.
- ^ A b C d E Menon, Vinod (říjen 2011). „Rozsáhlé mozkové sítě a psychopatologie: sjednocující trojitý síťový model“. Trendy v kognitivních vědách. 15 (10): 483–506. doi:10.1016 / j.tics.2011.08.003. PMID 21908230.
- ^ A b Seeley, W.W; et al. (Únor 2007). „Disociální sítě vnitřního připojení pro zpracování význačnosti a výkonnou kontrolu“. The Journal of Neuroscience. 27 (9): 2349–56. doi:10.1523 / JNEUROSCI.5587-06.2007. PMC 2680293. PMID 17329432.
- ^ Habas, C; et al. (1. července 2009). „Výrazné mozečkové příspěvky k sítím vnitřní konektivity“. The Journal of Neuroscience. 29 (26): 8586–94. doi:10.1523 / JNEUROSCI.1868-09.2009. PMC 2742620. PMID 19571149.
- ^ Petrides, M (2005). „Laterální prefrontální kůra: architektura a funkční organizace“. Filozofické transakce královské společnosti B. 360 (1456): 781–795. doi:10.1098 / rstb.2005.1631. PMC 1569489. PMID 15937012.
- ^ Woodward, N.D .; et al. (2011). „Funkční sítě v klidovém stavu jsou u schizofrenie odlišně ovlivněny“. Výzkum schizofrenie. 130 (1–3): 86–93. doi:10.1016 / j.schres.2011.03.010. PMC 3139756. PMID 21458238.
- ^ Menon, Vinod; et al. (2001). "Funkční neuroanatomie sluchové pracovní paměti u schizofrenie: vztah k pozitivním a negativním příznakům". NeuroImage. 13 (3): 433–446. doi:10,1006 / nimg.2000.0699. PMID 11170809.
- ^ Levin, R.L .; et al. (2007). "Kognitivní deficity v depresi a funkční specifičnost regionální mozkové činnosti". Kognitivní terapie a výzkum. 31 (2): 211–233. doi:10.1007 / s10608-007-9128-z.
- ^ Qin, P; Northoff, G (2011). "Jak souvisí naše já s regiony střední čáry a sítí výchozího režimu?". NeuroImage. 57 (3): 1221–1233. doi:10.1016 / j.neuroimage.2011.05.028. PMID 21609772.
- ^ Raichle, M.E .; et al. (2001). „Výchozí režim funkce mozku“. Sborník Národní akademie věd Spojených států amerických. 98 (2): 676–682. Bibcode:2001PNAS ... 98..676R. doi:10.1073 / pnas.98.2.676. PMC 14647. PMID 11209064.
- ^ Cooney, R.E .; et al. (2010). „Neurální koreláty přežvykování při depresi“. Kognitivní, afektivní a behaviorální neurovědy. 10 (4): 470–478. doi:10.3758 / kabina.10.4.470. PMC 4476645. PMID 21098808.
- ^ Broyd, S.J .; et al. (2009). "Výchozí režim dysfunkce mozku u duševních poruch: systematický přehled". Neurovědy a biobehaviorální recenze. 33 (3): 279–296. doi:10.1016 / j.neubiorev.2008.09.002. PMID 18824195.
- ^ Hamani, C; et al. (15. února 2011). "Subcallosal cingulate gyrus v kontextu velké deprese". Biologická psychiatrie. 69 (4): 301–8. doi:10.1016 / j.biopsych.2010.09.034. PMID 21145043.
- ^ Feinstein, J.S .; et al. (Září 2006). „Reaktivita přední izolace během určitých rozhodnutí je spojena s neuroticismem“. Sociální kognitivní a afektivní neurovědy. 1 (2): 136–142. doi:10.1093 / sken / nsl016. PMC 2555442. PMID 18985124.
- ^ Paulus, M.P .; Stein, M.B. (2006). "Ostrovní pohled na úzkost". Biologická psychiatrie. 60 (4): 383–387. doi:10.1016 / j.biopsych.2006.03.042. PMID 16780813.
- ^ Antony, M.M. (2009). Oxford Handbook of Anxiety and Related Disorders. Oxford University Press.
Další čtení
- Szafran, K; Faron-Górecka, A; Kolasa, M; Kuśmider, M; Solich, J; Zurawek, D; Dziedzicka-Wasylewska, M (2013). „Potenciální role heterodimerizace receptoru spřaženého s G proteinem (GPCR) u neuropsychiatrických poruch: důraz na depresi“ (PDF). Pharmacol Rep. 65 (6): 1498–505. doi:10.1016 / s1734-1140 (13) 71510-x. PMID 24552997.
- Naumenko, VS; Popova, NK; Lacivita, E; Leopoldo, M; Ponimaskin, EG (červenec 2014). „Souhra mezi serotoninovými 5-HT1A a 5-HT7 receptory u depresivních poruch“. CNS Neurosci Ther. 20 (7): 582–90. doi:10.1111 / cns.12247. PMC 6493079. PMID 24935787.
