Indikátor PH - PH indicator
tento článek potřebuje další citace pro ověření. (Květen 2012) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
A indikátor pH je halochromní chemická sloučenina přidáno v malém množství do a řešení takže pH (kyselost nebo zásaditost ) řešení lze určit vizuálně. Proto je indikátor pH a chemikálie detektor pro hydronium ionty (H3Ó+) nebo vodíkové ionty (H+) v Arrheniový model. Normálně indikátor způsobí barva roztoku se mění v závislosti na pH. Indikátory mohou také ukazovat změnu v jiných fyzikálních vlastnostech; například čichové ukazatele ukazují změnu v jejich zápach. Hodnota pH neutrálního roztoku je 7,0 při 25 ° C (standardní laboratorní podmínky ). Roztoky s hodnotou pH pod 7,0 jsou považovány za kyselé a roztoky s hodnotou pH nad 7,0 jsou zásadité (zásadité). Protože nejvíce přirozeně se vyskytující organické sloučeniny jsou slabé protolyty, karboxylové kyseliny a aminy „Indikátory pH nacházejí mnoho aplikací v biologii a analytické chemii. Indikátory pH navíc tvoří jeden ze tří hlavních typů indikátorových sloučenin používaných v chemické analýze. Pro kvantitativní analýzu kovových kationtů se používá komplexometrické ukazatele je výhodné,[1][2] zatímco třetí složená třída, redoxní ukazatele, se používají jako základ analýzy při titracích zahrnujících redoxní reakci.
Teorie
Indikátory pH samy o sobě jsou často slabé kyseliny nebo slabé zásady. Obecné reakční schéma indikátoru pH lze formulovat jako:
- HInd + H
2Ó ⇌ H
3Ó+
+ Ind−
Zde HInd znamená kyselou formu a Ind− pro konjugovanou základnu indikátoru. Jejich poměr určuje barvu roztoku a spojuje barvu s hodnotou pH. Ukazatele pH, které jsou slabými protolyty, Henderson-Hasselbalchova rovnice pro ně lze napsat jako:
- pH = strK.A + log10 [Ind−
] / [Zadní]
Rovnice odvozená z konstanta kyselosti, uvádí, že když se pH rovná pK.A hodnoty indikátoru jsou oba druhy přítomny v poměru 1: 1. Pokud je pH nad pK.A Koncentrace konjugované báze je vyšší než koncentrace kyseliny a dominuje barva spojená s konjugovanou bází. Pokud je pH nižší než pK.A hodnota, konverzace je pravdivá.
Obvykle není změna barvy okamžitá u pK.A hodnota, ale existuje pH, kde je přítomna směs barev. Toto rozmezí pH se mezi indikátory liší, ale zpravidla spadá mezi pK.A hodnota plus mínus jedna. To předpokládá, že řešení si zachovají svoji barvu, dokud přetrvává alespoň 10% ostatních druhů. Například pokud je koncentrace konjugované báze 10krát větší než koncentrace kyseliny, jejich poměr je 10: 1 a následně je pH pK.A + 1. Naopak, pokud dojde k 10násobnému přebytku kyseliny vzhledem k zásadě, poměr je 1:10 a pH je pK.A − 1.
Pro optimální přesnost by měl být barevný rozdíl mezi těmito dvěma druhy co nejjasnější a čím užší je rozsah pH barvy, tím lépe. V některých ukazatelích, jako např fenolftalein, jeden z druhů je bezbarvý, zatímco v jiných ukazatelích, jako např methylová červeň, oba druhy udělují barvu. Zatímco indikátory pH fungují efektivně v určeném rozmezí pH, jsou obvykle zničeny na extrémních koncích stupnice pH kvůli nežádoucím vedlejším reakcím.
aplikace

Ukazatele pH se často používají v titrace v analytická chemie a biologie k určení rozsahu a chemická reakce. Kvůli subjektivní výběr (stanovení) barvy, pH indikátory jsou citlivé na nepřesné hodnoty. Pro aplikace vyžadující přesné měření pH, a pH metr se často používá. Někdy se používá směs různých indikátorů k dosažení několika plynulých barevných změn v širokém rozsahu hodnot pH. Tyto obchodní ukazatele (např. univerzální indikátor a Hydrion papíry ) se používají, když je nutná pouze hrubá znalost pH.
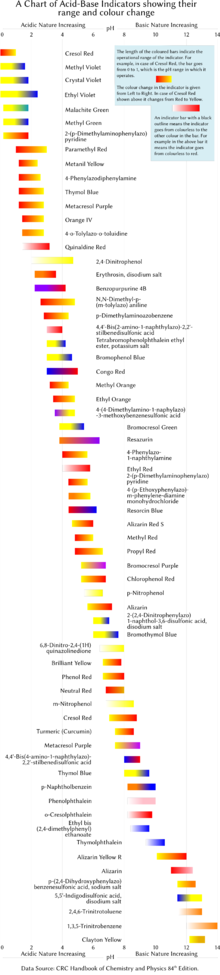
Níže je uvedeno několik běžných laboratorních indikátorů pH. Indikátory obvykle vykazují střední barvy při hodnotách pH uvnitř uvedeného přechodového rozsahu. Například fenolová červeň vykazuje oranžovou barvu mezi pH 6,8 a pH 8,4. Rozsah přechodu se může mírně posunout v závislosti na koncentraci indikátoru v roztoku a na teplotě, při které se používá. Obrázek vpravo ukazuje indikátory s jejich provozním rozsahem a změnami barev.
| Indikátor | Barva s nízkým pH | Přechod nízký konec | Přechod high-end | Barva s vysokým pH |
|---|---|---|---|---|
| Hořec fialový (Methylová fialová 10B ) | žlutá | 0.0 | 2.0 | modrofialová |
| Malachitová zeleň (první přechod) | žlutá | 0.0 | 2.0 | zelená |
| Malachitová zeleň (druhý přechod) | zelená | 11.6 | 14.0 | bezbarvý |
| Thymolová modrá (první přechod) | Červené | 1.2 | 2.8 | žlutá |
| Thymolová modrá (druhý přechod) | žlutá | 8.0 | 9.6 | modrý |
| Methylová žlutá | Červené | 2.9 | 4.0 | žlutá |
| Bromofenolová modrá | žlutá | 3.0 | 4.6 | modrý |
| Kongská červená | modrofialová | 3.0 | 5.0 | Červené |
| Methylová oranžová | Červené | 3.1 | 4.4 | žlutá |
| Mletá oranžová (první přechod) | Červené | 0.0 | 3.2 | fialově šedá |
| Mletá oranžová (druhý přechod) | fialově šedá | 3.2 | 4.2 | zelená |
| Bromokrezolová zelená | žlutá | 3.8 | 5.4 | modrý |
| Methylová červená | Červené | 4.4 | 6.2 | žlutá |
| Methylová fialová | nachový | 4.8 | 5.4 | zelená |
| Azolitmin (lakmus) | Červené | 4.5 | 8.3 | modrý |
| Bromkrezolová fialová | žlutá | 5.2 | 6.8 | nachový |
| Bromotymolová modrá (první přechod) | purpurová | <0 | 6.0 | žlutá |
| Bromotymolová modrá (druhý přechod) | žlutá | 6.0 | 7.6 | modrý |
| Fenolová červená | žlutá | 6.4 | 8.0 | Červené |
| Neutrální červená | Červené | 6.8 | 8.0 | žlutá |
| Naftoftalein | světle červená | 7.3 | 8.7 | zeleno-modrá |
| Krezolová červená | žlutá | 7.2 | 8.8 | červenofialová |
| Kresolftalein | bezbarvý | 8.2 | 9.8 | nachový |
| Fenolftalein (první přechod) | oranžová červená | <0 | 8.3 | bezbarvý |
| Fenolftalein (druhý přechod) | bezbarvý | 8.3 | 10.0 | fialovo-růžová |
| Fenolftalein (třetí přechod) | fialovo-růžová | 12.0 | 13.0 | bezbarvý |
| Thymolphthalein (první přechod) | Červené | <0 | 9.3 | bezbarvý |
| Thymolphthalein (druhý přechod) | bezbarvý | 9.3 | 10.5 | modrý |
| Alizarinová žlutá R. | žlutá | 10.2 | 12.0 | Červené |
| Indigový karmín | modrý | 11.4 | 13.0 | žlutá |
Univerzální indikátor
| Rozsah pH | Popis | Barva |
|---|---|---|
| < 3 | Silná kyselina | Červené |
| 3–6 | Slabá kyselina | Žlutá |
| 7 | Neutrální | Zelený |
| 8–11 | Slabá základna | Modrý |
| > 11 | Silná základna | fialový |
Přesné měření pH

Indikátor lze použít k získání docela přesných měření pH kvantitativním měřením absorbance při dvou nebo více vlnových délkách. Princip lze ilustrovat tím, že indikátor bude jednoduchá kyselina HA, která disociuje na H+ a A.−.
- HA ⇌ H+ + A−
Hodnota kyselá disociační konstanta, strK.A, musí být známo. The molární absorbance, εHA a εA− dvou druhů HA a A− na vlnových délkách λX a λy musí být také stanoveno předchozím experimentem. Za předpokladu Pivní zákon které je třeba dodržovat, měřené absorbance AX a Ay na dvou vlnových délkách jsou jednoduše součtem absorbance způsobené každým druhem.
Jedná se o dvě rovnice ve dvou koncentracích [HA] a [A−]. Po vyřešení se pH získá jako
Pokud jsou měření prováděna na více než dvou vlnových délkách, budou koncentrace [HA] a [A−] lze vypočítat pomocí lineární nejmenší čtverce. Ve skutečnosti lze pro tento účel použít celé spektrum. Postup je zobrazen u indikátoru bromkrezolová zelená. Pozorované spektrum (zelené) je součtem spektra HA (zlato) a A− (modrý), vážený pro koncentraci těchto dvou druhů.
Pokud je použit jediný indikátor, je tato metoda omezena na měření v rozsahu pH pK.A ± 1, ale tento rozsah lze rozšířit použitím směsí dvou nebo více indikátorů. Protože indikátory mají intenzivní absorpční spektra, je koncentrace indikátoru relativně nízká a předpokládá se, že samotný indikátor má zanedbatelný vliv na pH.
Bod ekvivalence
U acidobazických titrací může nevhodný indikátor pH vyvolat změnu barvy v roztoku obsahujícím indikátor před nebo po skutečném bodě ekvivalence. Ve výsledku lze na základě použitého indikátoru pH uzavřít různé body ekvivalence pro roztok. Je to proto, že sebemenší změna barvy roztoku obsahujícího indikátor naznačuje, že bylo dosaženo bodu ekvivalence. Proto má nejvhodnější indikátor pH efektivní rozsah pH, kde je patrná změna barvy, která zahrnuje pH bodu ekvivalence titrovaného roztoku.[3]
Přirozeně se vyskytující indikátory pH
Mnoho rostlin nebo částí rostlin obsahuje chemikálie z přirozeně zbarvených antokyan rodina sloučenin. Jsou červené v kyselých roztocích a modré v zásaditém stavu. Antokyany lze extrahovat vodou nebo jinými rozpouštědly z mnoha barevných rostlin nebo částí rostlin, včetně listů (červené zelí ); květiny (pelargónie, mák nebo růže okvětní lístky); bobule (borůvky, černý rybíz ); a stonky (rebarbora ). Extrakce antokyanů z domácích rostlin, zejména červené zelí, je vytvoření surového indikátoru pH populární úvodní ukázkou chemie.
Lakmus, používaný ve středověku alchymisty a stále snadno dostupný, je přirozeně se vyskytující indikátor pH vyrobený ze směsi lišejník zejména druhy Roccella tinctoria. Slovo lakmus je doslova z „barevného mechu“ Stará norština (vidět Litr ). Barva se mění mezi červenou v kyselých roztocích a modrou v zásadách. Termín „lakmusový test“ se stal široce používanou metaforou každého testu, který má autoritativně rozlišovat mezi alternativami.
Hydrangea macrophylla květiny mohou měnit barvu v závislosti na kyselosti půdy. V kyselých půdách dochází v půdě k chemickým reakcím hliník k dispozici těmto rostlinám, čímž změní květiny na modré. V alkalických půdách tyto reakce nemohou nastat, a proto rostlina hliník nepřijímá. Výsledkem je, že květy zůstávají růžové.
Dalším užitečným indikátorem přirozeného pH je koření Kurkuma. Je žlutá, když je vystavena působení kyselin, a červenohnědá, pokud je přítomna alkálie.
| Indikátor | Barva s nízkým pH | Barva s vysokým pH |
|---|---|---|
| Hortenzie květiny | modrý | růžová až fialová |
| Antokyany | Červené | modrý |
| Lakmus | Červené | modrý |
| Kurkuma | žlutá | červenohnědá |

Hortenzie v kyselé půdě
Hortenzie v alkalické půdě

Přechodový indikátor pH červeného zelného extraktu z kyselého roztoku vlevo k zásaditému vpravo

Fialový květák namočený do jedlé sody (vlevo) a octa (vpravo). Antokyanin působí jako indikátor pH.

Kurkuma dispergovaná ve vodě je žlutá v kyselém prostředí a hnědá za alkalických podmínek
Viz také
Reference
- ^ Schwarzenbach, Gerold (1957). Komplexometrické titrace. Přeložil Irving, Harry (1. anglické vydání). Londýn: Methuen & Co.. str. 29–46.
- ^ West, T. S. (1969). Komplexometrie s EDTA a souvisejícími činidly (3. vyd.). Poole, Velká Británie: BDH Chemicals Ltd. str. 14–82.
- ^ Zumdahl, Steven S. (2009). Chemické principy (6. vydání). New York: Společnost Houghton Mifflin. 319–324.
- Dlouhý seznam indikátorů
- "Kompletní seznam indikátorů" (PDF) (francouzsky). (57.3 KiB )


![{ displaystyle { begin {aligned} A_ {x} & = [{ ce {HA}}] varepsilon _ {{ ce {HA}}} ^ {x} + [{ ce {A-}} ] varepsilon _ {{ ce {A -}}} ^ {x} A_ {y} & = [{ ce {HA}}] varepsilon _ {{ ce {HA}}} ^ {y } + [{ ce {A -}}] varepsilon _ {{ ce {A -}}} ^ {y} end {zarovnáno}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/407bba3b954782cbec25c32d99393bf282c2c36d)
![{ displaystyle mathrm {pH} = mathrm {p} K _ { mathrm {a}} + log { frac {[{ ce {A -}}]} {[{ ce {HA}}] }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ed476e8f78a1980748a81ec195978b60032411f)




