Frustrovaný Lewisův pár - Frustrated Lewis pair
V chemii, a frustrovaný Lewisův pár (FLP) je sloučenina nebo směs obsahující a Lewisova kyselina a a Lewisova základna že kvůli sterická překážka, nelze kombinovat a vytvořit klasický adukt.[1] Bylo navrženo mnoho druhů FLP a mnoho jednoduchých substrátů vykazuje aktivaci.[2][3]
Objev, že některé FLP rozdělily H2[4] spustil rychlý růst výzkumu FLP. Vzhledem ke své „neutíchané“ reaktivitě jsou takové systémy reaktivní vůči substrátům, které mohou podstoupit heterolýza. Například mnoho FLP se dělí molekuly vodíku. Směs tedy tricyklohexylfosfin (PCy3) a tris (pentafluorfenyl) boran reaguje s vodíkem za vzniku příslušných fosfonium a borát ionty:
Tato reaktivita byla využita k výrobě FLP, které katalyzují hydrogenace reakce.[5]
Aktivace malé molekuly
Ukázalo se, že frustrované Lewisovy páry aktivují mnoho malých molekul, ať už indukcí heterolýzy nebo koordinací.
Vodík
Objev, že některé FLP jsou schopné se rozdělit, a proto aktivovat, H2[4] spustil rychlý růst výzkumu v této oblasti. Aktivace a tedy použití H2 je důležitý pro mnoho chemických a biologických transformací. Použití FLP k osvobození H2 je bez kovů, což je výhodné vzhledem k ceně a omezenému přísunu některých přechodných kovů běžně používaných k aktivaci H2 (Ni, Pd, Pt).[6] Systémy FLP reagují na substráty, které mohou podstoupit heterolýza (např. vodík) v důsledku „nezhasnuté“ reaktivity těchto systémů. Například bylo dříve prokázáno, že směs tricyklohexylfosfin (PCy3) a tris (pentafluorfenyl) boran reaguje s H2 dát příslušné fosfonium a borát ionty:
V této reakci PCy3 (Lewisova základna) a B (C.6F5)3 (Lewisova kyselina) nemůže tvořit adukt kvůli sterické zábraně z objemných cyklohexylových a pentafluorfenylových skupin. Proton na fosforu a hydridu z boritanu je nyní „aktivován“ a může být následně „dodáván“ na organický substrát, což vede k hydrogenace.
Mechanismus aktivace dihydrogenu pomocí FLP
Mechanismus pro aktivaci H2 FLP byly diskutovány jak pro intermolekulární, tak pro intramolekulární případy. Intermolekulární FLP jsou tam, kde je Lewisova báze samostatnou molekulou s Lewisovou kyselinou, předpokládá se, že tyto jednotlivé molekuly interagují prostřednictvím sekundárních Londýnských disperzních interakcí, aby spojily Lewisovou bázi a kyselinu dohromady (předorganizační účinek), kde pak mohou interagovat malé molekuly s FLP. Experimentální důkazy pro tento typ interakce na molekulární úrovni jsou nejasné. Existují však podpůrné důkazy pro tento typ interakce založené na výpočtových studiích DFT (Density Functional Theory). Intramolekulární FLP jsou místa, kde jsou Lewisova kyselina a Lewisova báze kombinovány v jedné molekule kovalentním linkerem. Navzdory vylepšeným „předorganizačním účinkům“ se předpokládá, že rigidní intramolekulární rámce FLP mají sníženou reaktivitu na malé molekuly kvůli snížení flexibility.
Příklad aktivace dihydrogenu
Aktivace H2 používání FLP bylo poprvé hlášeno v roce 2006.[4] V této zprávě bylo pozorováno, že fosfonium-boritanové druhy podléhají tepelné ztrátě H2 molekuly, za vzniku fosfinu a boranu. Fosfonium-boritanové druhy 1 byl připraven z B (C.6F5)3 a (C.6H2Mě3)2PH, vzhledem ke sterickým nárokům obou těchto molekul nemohl být vytvořen tradiční adukt a byl připraven zwitteriontový fosfonon-boronát [obrázek 1]. Byla provedena „výměna H-za-F“ 2 který byl stabilní vůči vlhkosti a vzduchu. Tato sůl uvolní molekulární H2 při zahřátí nad 100 ° C byla také pozorována změna barvy od bezbarvé 2 do oranžovo-červené 3 (oba v THF). Tato reakce je obrácena reakcí 3 s H.2 na 25 °, kde je změna barvy obrácená a 2 je reformovaný. Reakce H2 s 3 byl úspěšný pro teploty až 25 ° C. Rekrystalizace z 3 z THF poskytly bezbarvé krystaly aduktu 4.

Další substráty s malou molekulou
FLP jsou také reaktivní vůči mnoha nenasyceným substrátům za hranicí H2. Některé FLP reagují s CO2, konkrétně při deoxygenativní redukci CO2 na metan.[7]
Ethylen také reaguje s FLP:[8]
Pro páry kyselin-bází chovat se současně nukleofilně i elektrofilně nabízí způsob otevření kruhu cyklickým etherům, jako je THF, 2,5-dihydrofuran, kumaran a dioxan.[9]
Použití při katalýze
Hydrogenace iminu, nitrilu a aziridinu

Snížení iminy, nitrily, a aziridiny na primární a sekundární aminy tradičně se provádí reakcí s hydridy kovů, např. lithiumaluminiumhydrid a kyanoborohydrid sodný. Hydrogenace těchto nenasycených substrátů lze provádět reakcemi katalyzovanými kovem. Katalytická hydrogenace bez obsahu kovů byla prováděna za použití katalyzátoru na bázi fosfoniumboritanu (R.2PH) (C.6F4) BH (C.6F5)2 (R = 2,4,6-Me3C6H2) 1. Tento typ hydrogenace bez kovů má potenciál nahradit nákladný kovový katalyzátor.
Mechanismus redukce iminu je navržen tak, aby zahrnoval protonaci dusíkem za vzniku iminiové soli. Bazicita centra dusíku určuje rychlost reakce. Více iminů bohatých na elektrony se snižuje rychleji než iminy chudé na elektrony. Výsledné iminiové centrum prochází nukleofilní útok borohydridovým aniontem za vzniku aminu. Malé aminy se vážou na boran a potlačují další reakce. Tento problém lze překonat pomocí různých metod: 1) Aplikace zvýšených teplot 2) Použití stericky objemné iminové substituenty 3) Ochrana iminu pomocí B (C6F5)3skupina, která také slouží jako promotor Lewisovy kyseliny.[10]
Enantioselektivní iminová hydrogenace
Chirální boronát Lewisova kyselina odvozeno z (1R)-(+) -camphor tvoří frustrovaný Lewisův pár tBu3P, který je izolovatelný jako sůl. Tento FLP katalyzuje enantioselektivní hydrogenace některých aryliminů ve vysokém výtěžku, ale skromná ee (až 83%).

Ačkoli je koncepčně zajímavý, protokol trpí nedostatkem obecnosti. Bylo zjištěno, že zvětšování sterického objemu já těžím substituenty vedou ke snížení výtěžku a ee z amin produkt. methoxy-substituovaný iminy vykazují vyšší výtěžek a ee 's.[10]
Asymetrické hydrosilylace
Skupina katalyzátorů, frustrované Lewisovy páry chirálních alkenylboranů a fosfinů, jsou prospěšné pro asymetrické Piersovy hydrosilylace 1,2-dikarbonylových sloučenin a alfa-ketoesterů, což vede k produktům enantioselektivity s vysokým výtěžkem. Avšak ve srovnání s konvenční Piersovou hydrosilylací nejsou asymetrické Piersovy hydrosilylace tak dobře vyvinuté
V následujícím příkladu se chirální alkenylboran tvoří in situ z chirálního diynu a HB (C6F5)2. Heterolytické štěpení vazby Si-H z PhMe2SiH katalyzátorem FLP tvoří iontový komplex silylia a hydridoboritanu.[11]
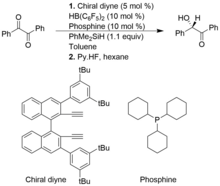
Alkyně hydrogenace
Hydrogenace bez aktivovaných vnitřních alkynů na kov bez obsahu kovů cis-alkenů lze snadno dosáhnout pomocí katalyzátorů na bázi FLP.[12] Podmínky pro tuto reakci byly relativně mírné při použití 2 barů H2. Z hlediska mechanismu je alkynový materiál první hydroborovaný a potom výsledný FLP na bázi vinylboranu pak může aktivovat dihydrogen. Krokem protodeborylace se uvolní cis-alkenový produkt, který se získává díky syn-hydroborylační proces a regenerace katalyzátoru. I když jsou katalyzátory na bázi FLP aktivní pro hydrogenaci alkinu, neusnadňují hydrogenaci alkenů na alkany.

Reakce je syn-hydroborace a ve výsledku je pozorována vysoká cis selektivita. V závěrečné fázi katalytického cyklu C6F5 skupina se odštěpuje snadněji než alkylová skupina, což vede spíše k degradaci katalyzátoru než k uvolňování alkanu. Katalytický cyklus má tři kroky:
- Vazba substrátu (hydroborace alkynu)
- H2 štěpení vinylboranem, následované intramolekulární protodeborylací vinylového substituentu, čímž se získá N, N-dimethyl-2 - [(pentafluorfenyl) boryl] anilin
- Uvolňování cis-alkenu
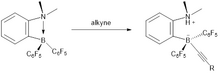
S interními alkiny dochází ke kompetitivní reakci, kdy může být proton vázaný na dusík přidán k fluorobenzenům. Toto přidání proto příliš nepokračuje, zdá se, že tvorba alkenu je příznivá.
Ale terminální alkyny se neváží na bór hydroborací, ale spíše aktivací CH. Přidání protonu k alkinu tedy povede k počátečnímu terminálnímu alkinu. Proto tento hydrogenační proces není vhodný pro koncové alkyny a poskytne pouze pentafluorbenzen.
Hydrogenace koncových alkynů na příslušné alkeny bez obsahu kovů byla nedávno dosažena za použití systému na bázi pyridonboranu.[13] Tento systém snadno aktivuje vodík při teplotě místnosti za vzniku komplexu pyridon-boran.[14] Disociace tohoto komplexu umožňuje hydroboraci alkynu volným boranem. Po protodeborylaci volným pyridonem cis je generován alken. Hydrogenace koncových alkynů je u tohoto systému možná, protože aktivace CH je reverzibilní a soutěží s aktivací vodíku.
Borylace
Aminoboranové FLP katalyzují borylaci aromatických heterocyklů bohatých na elektrony (schéma 1).[15] Reakce je řízena uvolňováním vodíku aktivací CH pomocí FLP. Aromatické borylace se často používají ve farmaceutickém vývoji, zejména kvůli hojnosti, nízké ceně a nízké toxicitě sloučenin boru ve srovnání s ušlechtilými kovy.,

Substrát pro reakci má dva hlavní požadavky, silně spojené s mechanismem borylace. Nejprve musí být substrát bohatý na elektrony, což dokládá absence reakce s thiofenem, zatímco jeho deriváty bohatší na elektrony - methoxythiofen a 3,4-ethylendioxythiofen - může podstoupit reakci s amino-boranem. Dále substituce 1-methylpyrrolu (který může reagovat) se silným odběrem elektronů terc-butyloxykarbonyl (Boc) skupina v poloze 2 zcela inhibuje reakci. Druhým požadavkem je nepřítomnost bazických aminových skupin v substrátu, které by jinak vytvořily nežádoucí adukt. To lze ilustrovat absencí reakce s pyrrolem, zatímco deriváty 1-methylu i N-benzylpyrrolu jsou schopné reagovat.
Další práce stejných autorů odhalily, že jednoduše piperidin jako aminová skupina R (na rozdíl od tetramethylpiperidinu, na obrázku výše) zrychlil rychlost reakce. Prostřednictvím kinetických a DFT studií autoři navrhli, že aktivační krok CH byl snadnější než s většími substituenty.[16]
Dearomatizace může být také dosažena za podobných podmínek, ale za použití N-tosylindolů. Syn- získají se hydrogenylované indoliny.[17]
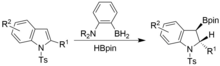
Rovněž byla pozorována borylace vazeb S-H v thiolech dehydrogenačním procesem. Alkoholy a aminy, jako je terc-butanol a terc-butylamin, vytvářejí stabilní produkty, které zabraňují katalýze v důsledku silné vazby π mezi osamělým párem atomu dusíku a bórem, zatímco totéž neplatí pro thioly, což umožňuje úspěšnou katalýzu . Kromě toho bylo dosaženo úspěšné borylace vazeb Se-H. Ve všech případech je tvorba H2 plyn je silnou hnací silou reakcí.[18]
Zachycování uhlíku
Chemie FLP je koncepčně relevantní pro zachycování uhlíku.[19] K selektivnímu zachycení a uvolnění oxidu uhličitého byly použity jak intermolekulární (schéma 1), tak intramolekulární (schéma 2) FLP sestávající z fosfinu a boranu. Když bylo řešení FLP pokryto atmosférou CO2 při pokojové teplotě, FLP-CO2 sloučenina se okamžitě vysráží jako bílá pevná látka.[19][20]

Zahřívání intermolekulárního FLP-CO2 sloučenina v brombenzenu při 80 ° C ve vakuu po dobu 5 hodin způsobila uvolnění přibližně poloviny CO2 a regeneraci dvou základních složek FLP. Po několika dalších hodinách sedění při teplotě místnosti ve vakuu došlo k úplnému uvolnění CO2 a došlo k regeneraci FLP.[19]
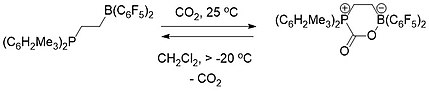
Intramolekulární FLP-CO2 sloučenina byla naopak stabilní jako pevná látka při teplotě místnosti, ale plně se rozkládala při teplotách nad -20 ° C jako roztok v dichlormethanu uvolňujícího CO2 a regenerace molekuly FLP.[19]
Tuto metodu zachycování uhlíku FLP lze přizpůsobit pro práci v systémech průtokové chemie.[21]
Reference
- ^ Stephan, Douglas W. (2008). „Frustrované Lewisovy páry: koncept nové reaktivity a katalýzy“. Org. Biomol. Chem. 6 (9): 1535–1539. doi:10.1039 / b802575b. PMID 18421382.

- ^ Stephan, Douglas W .; Erker, Gerhard (2010). „Frustrované páry Lewis: Aktivace vodíku bez obsahu kovů a další“. Angewandte Chemie International Edition. 49 (1): 46–76. doi:10.1002 / anie.200903708. ISSN 1433-7851. PMID 20025001.

- ^ Stephan, Douglas W .; Erker, Gerhard (2017). „Frustrovaná chemie Lewisových párů“. Filozofické transakce Královské společnosti A: Matematické, fyzikální a technické vědy. 375 (2101): 20170239. Bibcode:2017RSPTA.37570239S. doi:10.1098 / rsta.2017.0239. ISSN 1364-503X. PMC 5540845. PMID 28739971.

- ^ A b C Welch, Gregory C.; Juan, Ronan R. San; Masuda, Jason D .; Stephan, Douglas W. (2006). "Reverzibilní aktivace vodíku bez obsahu kovů". Věda. 314 (5802): 1124–1126. Bibcode:2006Sci ... 314.1124W. doi:10.1126 / science.1134230. ISSN 0036-8075. PMID 17110572.

- ^ Lam, Jolie; Szkop, Kevin M .; Mosaferi, Eliar; Stephan, Douglas W. (2018). "FLP katalýza: hlavní skupina hydrogenací organických nenasycených substrátů". Recenze chemické společnosti. 41 (13): 3592–3612. doi:10.1039 / C8CS00277K. PMID 30178796.
- ^ Welch, Gregory C .; Juan, Ronan R. San; Masuda, Jason D .; Stephan, Douglas W. (2006-11-17). "Reverzibilní aktivace vodíku bez obsahu kovů". Věda. 314 (5802): 1124–1126. Bibcode:2006Sci ... 314.1124W. doi:10.1126 / science.1134230. ISSN 0036-8075. PMID 17110572.
- ^ Berkefeld, Andreas; Piers, Warren E .; Parvez, Masood (11.08.2010). „Tandemová frustrovaná Lewisova dvojice / tris (pentafluorfenyl) boranem katalyzovaná deoxygenativní hydrosilylace oxidu uhličitého“. Journal of the American Chemical Society. 132 (31): 10660–10661. doi:10.1021 / ja105320c. ISSN 0002-7863. PMID 20681691.
- ^ Stephan, D. W. (2009). ""Frustrated Lewis Pairs „: Nová strategie pro aktivaci malých molekul a hydrogenační katalýzu“. Dalton Trans (17): 3129–3136. doi:10.1039 / b819621d. PMID 19421613.

- ^ Tochertermam, W (1966). "Struktury a reakce organických jedlých komplexů". Angew. Chem. Int. Vyd. 5 (4): 351–171. doi:10,1002 / anie.196603511.
- ^ A b Chen, Dianjun; Wang, Yutian; Klankermayer, Jürgen (03.12.2010). "Enantioselektivní hydrogenace s chirálně frustrovanými Lewisovými páry". Angewandte Chemie International Edition. 49 (49): 9475–9478. doi:10,1002 / anie.201004525. ISSN 1521-3773. PMID 21031385.
- ^ Ren, Xiaoyu; Du, Haifeng (2016-01-15). „Chiral Frustrated Lewis Pairs Catalyzed Highly Enantioselective Hydrosilylations of 1,2-Dicarbonyl Compounds“. Journal of the American Chemical Society. 138 (3): 810–813. doi:10.1021 / jacs.5b13104. ISSN 0002-7863. PMID 26750998.
- ^ Černichenko, Konstantin; Madarász, Ádám; Pápai, Imre; Nieger, Martin; Leskelä, Markku; Repo, Timo (2013). „Přístup frustrovaných Lewisových párů ke katalytické redukci alkynů na cis-alkeny“ (PDF). Přírodní chemie. 5 (8): 718–723. Bibcode:2013NatCh ... 5..718C. doi:10.1038 / nchem.1693. PMID 23881505.

- ^ Wech, Felix; Hasenbeck, Max; Gellrich, Urs (2020-09-18). „Semihydrogenace alkylů katalyzovaných komplexem pyridon-boran: Frustrovaná Lewisova dvojice reaktivity a spolupráce bor-ligand ve shodě“. Chemistry - A European Journal: chem.202001276. doi:10.1002 / chem.202001276. ISSN 0947-6539.
- ^ Gellrich, Urs (2018). „Reverzibilní aktivace vodíku komplexem pyridonát-boran: Kombinace frustrované reaktivity Lewisova páru se spoluprací bor-ligand“. Angewandte Chemie International Edition. 57 (17): 4779–4782. doi:10.1002 / anie.201713119. ISSN 1521-3773.
- ^ Légaré, Marc A .; Courtmanche, Marc A .; Rochette, Étienne; Fontaine, Frédéric G. (2015-07-30). "Aktivace katalytické vazby C-H bez kovů a borylace heteroarenů". Věda. 349 (6247): 513–516. Bibcode:2015Sci ... 349..513L. doi:10.1126 / science.aab3591. hdl:20.500.11794/30087. ISSN 0036-8075. PMID 26228143.

- ^ Légaré Lavergne, Julien; Jayaraman, Arumugam; Misal Castro, Luis C .; Rochette, Étienne; Fontaine, Frédéric-Georges (06.10.2017). „Bezkovová borylace heteroarenů pomocí ambifilních aminoboranů: O důležitosti stereiky při aktivaci vazby frustrovaným Lewisovým párem – H“. Journal of the American Chemical Society. 139 (41): 14714–14723. doi:10.1021 / jacs.7b08143. hdl:20.500.11794/30144. ISSN 0002-7863. PMID 28901757.
- ^ Jayaraman, Arumugam; Misal Castro, Luis C .; Desrosiers, Vincent; Fontaine, Frédéric-Georges (2018). „Bezkovová borylativní dearomatizace indolů: zkoumání divergentní reaktivity aminoboranových C – H borylačních katalyzátorů“. Chemická věda. 9 (22): 5057–5063. doi:10.1039 / c8sc01093e. ISSN 2041-6520. PMC 5994747. PMID 29938036.
- ^ Rochette, Étienne; Boutin, Hugo; Fontaine, Frédéric-Georges (30.06.2017). „Frustrovaný Lewis Pair katalyzoval S-H Bond Borylation“. Organometallics. 36 (15): 2870–2876. doi:10.1021 / acs.organomet.7b00346. hdl:20.500.11794/30088. ISSN 0276-7333.
- ^ A b C d Mömming, Cornelia M .; Otten, Edwin; Kehr, Gerald; Fröhlich, Roland; Grimme, Stefan; Stephan, Douglas W .; Erker, Gerhard (2009-08-24). „Oboustranné vázání oxidu uhličitého bez obsahu kovů od frustrovaných Lewisových párů“ (PDF). Angewandte Chemie International Edition. 48 (36): 6643–6646. doi:10.1002 / anie.200901636. ISSN 1433-7851. PMID 19569151.
- ^ Stephan, Douglas W .; Erker, Gerhard (2015-05-14). „Frustrated Lewis Pair Chemistry: Development and Perspectives“. Angewandte Chemie International Edition. 54 (22): 6400–6441. doi:10,1002 / anie.201409800. ISSN 1433-7851. PMID 25974714.
- ^ Abolhasani, Milad; Günther, Axel; Kumacheva, Eugenia (2014-06-24). „Mikrofluidní studie oxidu uhličitého“. Angewandte Chemie International Edition. 53 (31): 7992–8002. doi:10,1002 / anie.201403719. ISSN 1433-7851. PMID 24961230.

![{displaystyle {ce {PCy3 + B (C6F5) 3 + H2 -> [HPCy3] + [HB (C6F5) 3] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)
