Kyselina chirální Lewis - Chiral Lewis acid
tento článek vyžaduje pozornost odborníka na chemii. Specifický problém je: úzké, neúplné pokrytí / rozsah, chybí mnoho důležitých individuálních přispěvatelů a aspektů oboru a také některé bloky volných textových citací a anglické, formátovací a typografické chyby. (listopad 2013) |
Chirálně Lewisovy kyseliny (CLA) jsou typem Lewisova kyselina katalyzátor který ovlivňuje chiralitu substrátu, jak s ním reaguje. Při těchto reakcích syntéza podporuje tvorbu specifického enantiomeru nebo diastereomeru. Metoda je pak enantioselektivní asymetrická syntéza reakce. Protože ovlivňují chirality, produkují opticky aktivní produkty z opticky neaktivních nebo smíšených výchozích materiálů. Tento typ preferenčního formování jednoho enantiomer nebo diastereomer nad druhou je formálně znám jako asymetrická indukce. V tomto druhu Lewisovy kyseliny. atom přijímající elektrony je obvykle kov, například indium, zinek, lithium, hliník, titan nebo bór. The chirální - měnící se ligandy používané pro syntézu těchto kyselin mají nejčastěji více Lewis základní weby (často a diol nebo dinitrogenová struktura), které umožňují vytvoření kruhové struktury zahrnující atom kovu.[1][2]
Kyseliny Achiral Lewis jsou používány po celá desetiletí k podpoře syntézy racemické směsi v nesčetných různých reakcích. Od šedesátých let minulého století chemici používají chirální Lewisovy kyseliny k vyvolání enantioselektivních reakcí. To je užitečné, pokud je požadovaným produktem specifický enantiomer, běžný při syntéze léčiv. Mezi běžné typy reakcí patří Diels-Alder reakce, en reakce, [2+2] cykloadice reakce, kyanovodík aldehydů a především Sharplessova epoxidace.[3]
Teorie
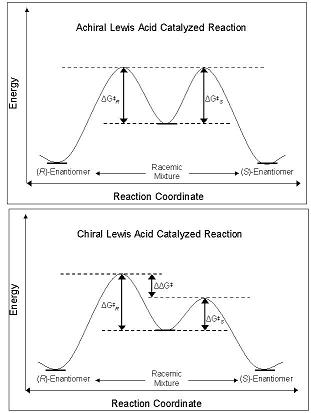
Enantioselektivita CLA se odvíjí od jejich schopnosti rušit svobodné energetická bariéra podél souřadnice reakce cesta, která vede buď k R- nebo S- enantiomer. Diastereomery a enantiomery základního stavu mají v základním stavu stejnou energii, a když reagují s achirální kyselinou lewisovou, jejich diastereomerní meziprodukty, přechodové stavy „a výrobky mají rovněž stejnou energii. To vede k výrobě racemické směsi produktů. Pokud se však ve stejné reakci použije CLA, je energetická bariéra tvorby jednoho diastereomeru menší než u jiné - reakce je pod kinetické ovládání. Pokud jsou rozdíly v energetických bariérách mezi diastereomerními přechodovými stavy dostatečné velikosti, pak vysoký enantiomerní přebytek je třeba pozorovat jeden izomer (obrázek 2).[4]
Aplikace CLA v asymetrické syntéze
Diels-Alderova reakce
Diels-Alderovy reakce dochází mezi konjugovanými dien a alken (běžně známý jako dienophile ). Tento cykloadice proces umožňuje stereoselektivní formování cyklohexen prsteny schopné vlastnit až čtyři sousedící stereogenní centra.
Diels-Alderovy reakce mohou vést k tvorbě různých strukturních izomerů a stereoizomerů. The molekulární orbitální teorie domnívá se, že je upřednostňován přechodový stav endo místo přechodového stavu exo (pravidlo přidání endo). Také se předpokládá, že rozšířené sekundární orbitální interakce jsou zdrojem vylepšené diastereoselace endo.

Přidání CLA selektivně aktivuje jednu složku reakce (dien nebo dienofil) a současně poskytuje stereodefinované prostředí, které umožňuje jedinečnou enantioselektivitu.
Společnost Koga a spolupracovníci zveřejnili první praktický příklad katalytické enantioselektivní Diels-Alderovy reakce podporované CLA - menthoxyaluminium dichlorid - odvozený od mentolu a ethylaluminium dichloridu.[5]

O deset let později Elias James Corey představil účinný regulátor hliníku a diaminu pro Diels-Alderovu reakci. Tvorba aktivního katalyzátoru se dosáhne zpracováním bis (sulfonamidu) trimethylaluminiem; výtěžek ligandu byl v podstatě kvantitativní. Navrhovaný tetrakoordinovaný hliník brání imidu působícímu jako chelatující Lewisova báze, zatímco zvyšuje a-vinylový proton dienofilu a benzylový proton katalyzátoru.

The Struktura rentgenového záření katalyzátoru vykazovalo stereodefinované prostředí.[6]

V roce 1993 Wulff a spolupracovníci našli komplex odvozený od diethylaluminiumchlorid a „klenutý“ biarylový ligand níže katalyzoval enantioselektivní Diels-Alderovu reakci mezi cyklopentadienem a methakroleinem. Chirální ligand se izoluje kvantitativně na silikagelu chromatografie.[7]
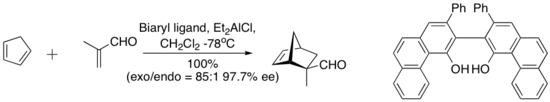
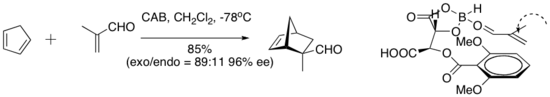
Hisashi Yamamoto a spolupracovníci vyvinuli praktický Diels-Alderův katalyzátor pro aldehydové dienofily. Chirální (acyloxy) boranový (CAB) komplex je účinný při katalýze řady aldehydových Diels-Alderových reakcí. NMR spektroskopické experimenty ukázaly těsnou blízkost aldehydu a arylového kruhu. Rovněž bylo navrženo skládání Pi mezi arylovou skupinou a aldehydem jako organizační vlastnost, která cykloadici dodávala vysokou enantioselektivitu.[8]
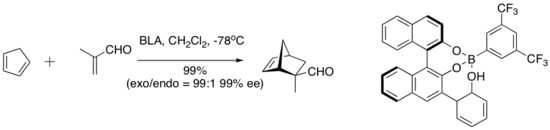
Yamamoto a spolupracovníci představili koncepčně zajímavou řadu katalyzátorů, které do aktivního katalyzátoru začleňují kyselý proton. Tento druh takzvané Bronstedovy kyseliny chirální Lewisovy kyseliny (BLA) katalyzuje řadu dien-aldehydových cykloadičních reakcí.[9]
Aldolová reakce
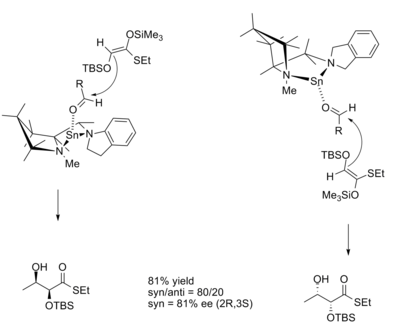
V aldol reakce je diastereoselektivita produktu často dána geometrií enolátu podle modelu Zimmerman-Traxler. Model předpovídá, že Z izolovat dá syn produkty a které E enoláty dá proti produkty. Kyseliny Chirálního Lewise umožňují produktům, které vzdorují modelu Zimmerman-Traxler, a umožňují kontrolu absolutních hodnot stereochemie. Kobayashi a Horibe to prokázali při syntéze dihydroxythioesterových derivátů pomocí a cín - chirální Lewisova kyselina na bázi.[10]

Přechodové struktury pro reakce s R i S katalyzátorem enantiomery jsou zobrazeny níže.
Baylis-Hillmanova reakce
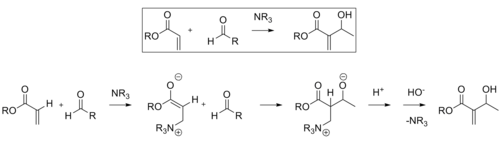
The Baylis-Hillmanova reakce je cesta pro tvorbu vazby C-C mezi alfa, beta-nenasycenou karbonyl a aldehyd, který vyžaduje nukleofilní katalyzátor, obvykle terciární amin, pro přidání a eliminaci typu Michael. Stereoselektivita těchto reakcí je obvykle špatná. Chen a kol. prokázala enantioselektivní chirální Lewisovou kyselinou katalyzovanou reakci. Lanthan byl použit v tomto případě. Podobně může být také použit chirální amin pro dosažení stereoselektivity.[11]
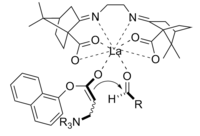
Produkt získaný reakcí za použití chirální látky katalyzátor byl získán v dobrém výtěžku s vynikající enantioselektivitou.
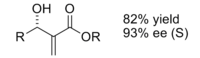
Ene reakce
Chirální Lewisovy kyseliny se také osvědčily v en reakce. Je-li katalyzována achirálně lewisovou kyselinou, reakce obvykle poskytuje dobrou diastereoselektivitu.[12]
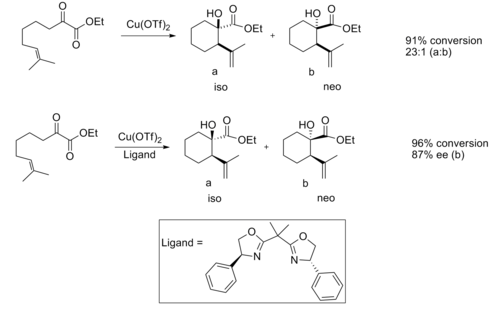
Při použití chirálního katalyzátoru na bázi kyseliny lewisové byla pozorována dobrá enantioselektivita.

Předpokládá se, že enantioselektivita je způsobena sterický interakce mezi methyl a fenyl skupina, což činí přechodovou strukturu iso produktu podstatně příznivější.
Příklady achirálních Lewisových kyselin ve stereoselektivní syntéze
Nikl katalyzovaná kondenzace 1,3-dienů s aldehydy V některých případech může achirální Lewisova kyselina poskytovat dobrou stereoselektivitu. Kimura a kol. prokázala regio- a diastereoselektivní vazbu 1,3-dienes s aldehydy.[13]
Využití chirálních Lewisových kyselin
Asymetrická syntéza a výroba enantiomerně čistých látek pomocí CLA je zvláště zajímavá pro organické chemiky a farmaceutické společnosti. Protože mnoho farmaceutických přípravků cílí na enzymy, které jsou specifické pro určitý enantiomer, musí být sloučeniny určené pro podávání pacientům vysoce opticky čisté. Dále rozlišení konkrétního enantiomeru z a racemický směs je nákladná i nehospodárná.
Poznámky
- ^ Reagencie s kyselinou Lewisovou. Praktický přístup. Yamamoto, H., Oxford University Press. 1999 (zpřístupněno 3. prosince 2008)
- ^ Bin, Y., Pikul, S., Imwinkelried, R., Corey, E.J. 1989, JACS, (14) 5493-5495
- ^ Narasaka, K. Syntéza. 1991 (01) 1-11
- ^ Morrison, J.D., Mosher, H.S. (1971). Asymetrické organické reakce. Prentice-Hall, Inc. ISBN 978-0-13-049551-8.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Hashimoto S-I, Komeshima N, Koga K, 1979, J Chem Soc Chem Commun, 437
- ^ Coery, EJ; Sarshar, S; Bordner, J, 1992, J Am Chem Soc, 114, 7938
- ^ Bao, J; Wulff, WD; Rheingold, AL, 1993, J Am Chem Soc, 115, 3814
- ^ Ishihara, K; Gao, Q; Yamamoto, H, 1993, J Am Chem Soc, 115, 10412
- ^ Ishihara, K; Yamamoto, H, 1994, J Am Chem Soc, 116, 1561
- ^ * Kobayashi, S .; Horibe, M., 1997, Chem. Eur. J., 3, 9, 1472-1481
- ^ Yang, K .; Lee, W .; Pan, J .; Chen, K., 2003, J. Org. Chem., 68, 915-919
- ^ Yang, D .; Yang, M .; Zhu, N., 2003 Org. Lett., 5, 20, 3749-3752
- ^ * Kimura, M .; Ezoe, A ,; Mori, M .; Iwata, K .; Tamaru., Y., 2006, JACS, 128, 8559-8568
Reference
- Reagencie s kyselinou Lewisovou. Praktický přístup. Yamamoto, H., Oxford University Press., 1999
- Bin, Y., Pikul, S., Imwinkelried, R., Corey, E.J. 1989, JACS, (14) 5493-5495
- Narasaka, K. 1991, Syntéza, (01) 1-11
- Asymetrické organické reakce. Morrison, J.D., Mosher, H.S. Prentice-Hall, Inc., 1971
