Tropinon - Tropinone - Wikipedia
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 8-Methyl-8-azabicyklo [3.2.1] oktan-3-on | |
| Ostatní jména 3-tropinon | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.007.756 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H13NE | |
| Molární hmotnost | 139,195 g / mol |
| Vzhled | Hnědá pevná látka |
| Bod tání | 42,5 ° C (108,5 ° F; 315,6 K) |
| Bod varu | (rozkládá se) |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tropinon je alkaloid, skvěle syntetizovaný v roce 1917 autorem Robert Robinson jako syntetický předchůdce atropin, vzácná komodita v průběhu roku první světová válka.[1][2] Tropinon a alkaloidy kokain a atropin sdílejí všechny stejné tropan základní struktura. Jeho odpovídající konjugovaná kyselina při pH 7,3 je hlavní druh známá jako tropiniumon.[3]
Syntéza
První syntéza tropinonu byla Richard Willstätter v roce 1901. Začalo to zdánlivě příbuzným cykloheptanon, ale vyžadovalo mnoho kroků k zavedení dusíkatého můstku; celkově výtěžek pro cestu syntézy je pouze 0,75%.[4] Willstätter předtím syntetizoval kokain z tropinonu, což byla první syntéza a objasnění struktury kokainu.[5]

Robinsonova „dvojitá Mannichova“ reakce
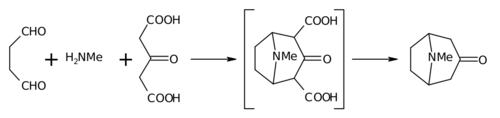
Syntéza Robinsona z roku 1917 je považována za klasiku celková syntéza[7] díky své jednoduchosti a biomimetickému přístupu. Tropinon je a bicyklická molekula, ale reaktanty použité při jeho přípravě jsou poměrně jednoduché: sukcinaldehyd, methylamin a acetonedikarboxylová kyselina (nebo dokonce aceton ). Syntéza je dobrým příkladem a biomimetický reakce nebo syntéza biogenetického typu protože biosyntéza využívá stejné stavební bloky. Rovněž ukazuje a tandemová reakce v syntéza v jedné nádobě. Kromě toho byl výtěžek syntézy 17% a s následným zlepšením přesáhl 90%.[4]
Tato reakce je popsána jako intramolekulární „dvojník“ Mannichova reakce „ze zřejmých důvodů. V tomto ohledu to není ojedinělé, protože se o to pokusili i ostatní při syntéze piperidinu.[8][9]
Místo acetonu je kyselina acetonedikarboxylová známá jako „syntetický ekvivalent „skupiny 1,3-dikarboxylové kyseliny jsou tzv.“aktivační skupiny "k usnadnění reakcí tvořících kruh. Vápenatá sůl je tam jako"nárazník „jak se tvrdí, že jsou možné vyšší výtěžky, pokud se reakce provádí při“fyziologický pH ".
Reakční mechanismus
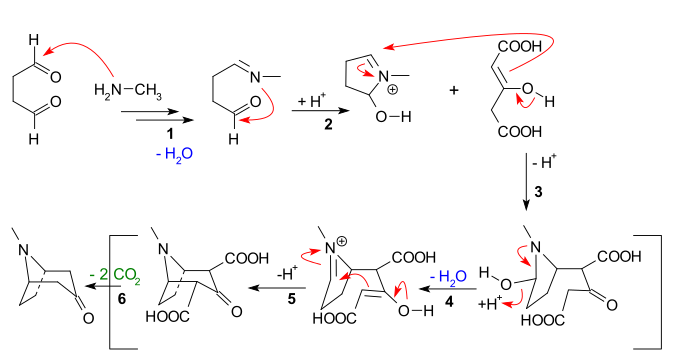
Hlavní rysy vyplývající z níže uvedené reakční sekvence jsou:
- Nukleofilní přidání z methylamin na sukcinaldehyd, následovaná ztrátou vody k vytvoření já těžím
- Intramolekulární přidání iminu do druhé aldehydové jednotky a uzavření prvního kruhu
- Mezimolekulární Mannichova reakce z izolovat aceton dikarboxylátu
- Nová tvorba enolátu a nová tvorba iminu se ztrátou vody pro
- Druhá intramolekulární Mannichova reakce a uzavření druhého kruhu
- Ztráta 2 karboxylových skupin na tropinon
Někteří autoři se ve skutečnosti pokusili udržet jednoho z CO2H skupiny.[10]
CO2R-tropinon má 4 stereoizomery, i když odpovídající ekgonidin alkylester má pouze pár enantiomerů.
Snížení tropinonu
Snížení tropinonu je zprostředkováno NADPH -individuální reduktázové enzymy, které byly charakterizovány u mnoha druhů rostlin.[11] Všechny tyto rostlinné druhy obsahují dva typy enzymů reduktázy, tropinon reduktázu I a tropinon reduktázu II. TRI produkuje tropin a TRII produkuje pseudotropin. Kvůli rozdílným kinetickým a pH / aktivním charakteristikám enzymů a 25krát vyšší aktivitou TRI oproti TRII je většina redukce tropinonu z TRI za vzniku tropinu.[12]

Viz také
- 2-karbomethoxytropinon (2-CMT) meziprodukt při tvorbě ekgonin analogy kokainu
Reference
- ^ Robinson, R. (1917). "LXIII. Syntéza tropinonu". Journal of the Chemical Society, Transactions. 111: 762–768. doi:10.1039 / CT9171100762.
- ^ Nicolaou, K. C.; Vourloumis, D .; Winssinger, N .; Baran, P. S. (2000). „Umění a věda totální syntézy na úsvitu dvacátého prvního století“. Angewandte Chemie International Edition. 39 (1): 44–122. doi:10.1002 / (SICI) 1521-3773 (20000103) 39: 1 <44 :: AID-ANIE44> 3.0.CO; 2-L. PMID 10649349.
- ^ Chemické entity biologického zájmu Identifikační kód: ChEBI: 57851 "tropiniumon"
- ^ A b Smit, Wim A .; Smit, William A .; Bochkov, Alekseĭ Feodosʹevich; Caple, Ron (1998). Organická syntéza. doi:10.1039/9781847551573. ISBN 978-0-85404-544-0.
- ^ Humphrey, A. J .; O'Hagan, D. (2001). „Biosyntéza tropanových alkaloidů. Století starý problém nevyřešen“. Zprávy o přírodních produktech. Royal Society of Chemistry. 18 (5): 494–502. doi:10,1039 / b001713m. PMID 11699882.
- ^ Doble, Mukesh; Kruthiventi, Anil Kumar (2007). Zelená chemie a inženýrství. Oxford: Elsevier. p. 34. ISBN 978-0-12-372532-5.
- ^ Birch, A. J. (1993). „Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S“. Poznámky a záznamy Královské společnosti v Londýně. 47 (2): 277–296. doi:10.1098 / rsnr.1993.0034. JSTOR 531792.
- ^ Wang, S .; Sakamuri, S .; Enyedy, I.J .; Kozikowski, A. P .; Deschaux, O .; Bandyopadhyay, B. C .; Tella, S. R .; Zaman, W. A .; Johnson, K. M. (2000). „Objev nového inhibitoru transportéru dopaminu, 4-hydroxy-1-methyl-4- (4-methylfenyl) -3-piperidyl-4-methylfenylketonu, jako potenciálního antagonisty kokainu prostřednictvím 3D-databázového vyhledávání farmakoforů. vztahů aktivity a farmakologických studií chování ". Journal of Medicinal Chemistry. 43 (3): 351–360. doi:10.1021 / jm990516x. PMID 10669562.
- ^ Wang, S .; Sakamuri; Enyedy; Kozikowski; Zaman; Johnson (2001). „Molekulární modelování, vztahy mezi strukturou a aktivitou a studie funkčního antagonismu 4-hydroxy-1-methyl-4- (4-methylfenyl) -3-piperidyl 4-methylfenylketonů jako nové třídy inhibitorů transportéru dopaminu“. Bioorganická a léčivá chemie. 9 (7): 1753–1764. doi:10.1016 / S0968-0896 (01) 00090-6. PMID 11425577.
- ^ Findlay, S. P. (1957). "Pokud jde o 2-karbomethoxytropinon". Journal of Organic Chemistry. 22 (11): 1385–1394. doi:10.1021 / jo01362a022.
- ^ A. Portsteffen; B. Draeger a A. Nahrstedt (1992). „Dva enzymy redukující tropinon z kořenových kultur transformovaných Datura stramonium“. Fytochemie. 31 (4): 1135. doi:10.1016 / 0031-9422 (92) 80247-C.
- ^ Boswell HD, Dräger B, McLauchlan WR a kol. (Listopad 1999). "Specifičnost enzymů z N-alkyltropanová biosyntéza v Brugmansia a Datura ". Fytochemie. 52 (5): 871–8. doi:10.1016 / S0031-9422 (99) 00293-9. PMID 10626376.