Kyselina glyoxylová - Glyoxylic acid
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Kyselina oxoctová[1] | |
| Systematický název IUPAC Kyselina oxoethanová | |
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.005.508 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C2H2Ó3 | |
| Molární hmotnost | 74.035 g · mol−1 |
| Hustota | 1,384 g / ml |
| Bod tání | 80 ° C (176 ° F; 353 K)[4] |
| Bod varu | 111 ° C (232 ° F; 384 K) |
| Kyselost (strK.A) | 3.18,[2] 3.32 [3] |
| Související sloučeniny | |
jiný anionty | glyoxylát |
Příbuzný karboxylové kyseliny | kyselina mravenčí octová kyselina kyselina glykolová kyselina šťavelová kyselina propionová kyselina pyrohroznová |
Související sloučeniny | acetaldehyd glyoxal glykolaldehyd |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina glyoxylová nebo kyselina oxoctová je organická sloučenina. Dohromady s octová kyselina, kyselina glykolová, a kyselina šťavelová, kyselina glyoxylová je jedním z C2 karboxylové kyseliny. Je to bezbarvá pevná látka, která se vyskytuje přirozeně a je průmyslově užitečná.
Struktura a nomenklatura
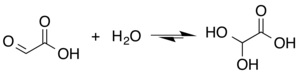
Ačkoli je struktura kyseliny glyoxylové popsána jako struktura s aldehyd funkční skupina, aldehyd je pouze minoritní složkou formy, která v některých situacích převládá. Místo toho často existuje jako hydrát nebo cyklický dimer. Například v přítomnosti vody karbonyl rychle se převádí na a geminální diol (popsáno jako „monohydrát“). The rovnovážná konstanta (K.) je 300 pro tvorbu kyseliny dihydroxyoctové při pokojové teplotě:[5]
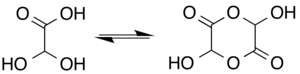
V roztoku existuje monohydrát v rovnováze s a poloacetal dimerní forma:[6]
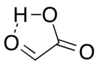
V izolaci má hlavní roli aldehydová struktura konformátor cyklický vodíkově vázané struktura s aldehydovým karbonylem v těsné blízkosti karboxyl vodík:[7]
The Henryho zákon konstanta kyseliny glyoxylové je K.H = 1.09 × 104 × exp [(40,0 × 103/ R) × (1 / T - 1/298)].[8]
Přípravy
The konjugovaná báze kyseliny glyoxylové je známá jako glyoxylát a je formou, že sloučenina existuje v roztoku při neutrálním pH. Glyoxylát je vedlejším produktem amidace proces v biosyntéze několika amidovaných peptidy.
Pro historický záznam byla kyselina glyoxylová připravena z kyseliny šťavelové elektrosynteticky:[9][10] v organické syntéze, oxid olovnatý katody byly použity pro přípravu kyseliny glyoxylové z kyselina šťavelová v elektrolytu s kyselinou sírovou.[11]
Horký kyselina dusičná umět okysličovat glyoxal na glyoxylovou; tato reakce je však vysoce exotermická a náchylná k tepelnému úniku. Kyselina šťavelová je navíc hlavním vedlejším produktem.
Taky, ozonolýza z kyselina maleinová je efektivní.[6]
Biologická role
Glyoxylát je meziproduktem glyoxylátový cyklus, což umožňuje organismy, jako jsou bakterie,[12] houby a rostliny [13] převést mastné kyseliny do sacharidy. Glyoxylátový cyklus je také důležitý pro indukci obranných mechanismů rostlin v reakci na houby.[14] Glyoxylátový cyklus je iniciován aktivitou isocitrát lyázy, která převádí isocitrát na glyoxylát a sukcinát. Probíhá výzkum za účelem kooptování cesty pro různé účely, jako je biosyntéza sukcinátu.[15]
U lidí
Glyoxylát se vyrábí dvěma cestami: oxidací glykolátu v peroxisomech nebo katabolismem hydroxyprolinu v mitochondriích.[16] V peroxisomech se glyoxylát převádí na glycin pomocí AGT1 nebo na oxalát pomocí glykolát oxidázy. V mitochondriích se glyoxylát převádí na glycin AGT2 nebo na glykolát glykolátreduktázou. Malé množství glyoxylátu se cytoplazmatickou laktátdehydrogenázou přemění na oxalát.[17]

V rostlinách
Kromě toho, že je glyoxylát meziproduktem v glyoxylátové dráze, je také důležitým meziproduktem v fotorespirace cesta. Fotorespirace je výsledkem vedlejší reakce Rubisca s O2 místo CO2. I když se zpočátku považovala za plýtvání energií a zdroji, ukázalo se, že fotorespirace je důležitou metodou regenerace uhlíku a CO2, odstranění toxického fosfoglykolátu a zahájení obranných mechanismů.[18][19] Ve fotorespiraci se glyoxylát převádí z glykolátu aktivitou glykolát oxidázy v peroxisomu. Poté se prostřednictvím SGAT a GGAT převádí na glycin, který se poté transportuje do mitochondrií.[20][19] Bylo také popsáno, že komplex pyruvátdehydrogenázy může hrát roli v metabolismu glykolátu a glyoxylátu.[21]

Relevance nemoci
tento článek příliš spoléhá na Reference na primární zdroje. (Březen 2017) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
Cukrovka
Glyoxylát je považován za potenciální časný marker pro Cukrovka typu II.[22] Jednou z klíčových podmínek diabetické patologie je produkce koncové produkty pokročilé glykace (VĚKY) způsobené hyperglykémie.[23] VĚKY mohou vést k dalším komplikacím cukrovky, jako je poškození tkání a kardiovaskulární onemocnění.[24] Obecně se tvoří z reaktivních aldehydů, jako jsou ty, které jsou přítomny při redukci cukrů a alfa-oxoaldehydů. Ve studii bylo zjištěno, že hladiny glyoxylátu byly významně zvýšeny u pacientů, u kterých byla později diagnostikována cukrovka typu II.[22] Zvýšené hladiny byly zjištěny někdy až tři roky před diagnózou, což ukazuje na potenciální roli glyoxylátu jako časného prediktivního markeru.
Nefrolitiáza
Glyoxylát se podílí na vývoji hyperoxalurie, klíčová příčina nefrolitiáza (běžně známé jako ledvinové kameny). Glyoxylát je jak substrátem, tak induktorem sulfátového aniontového transportéru-1 (sat-1), genu odpovědného za transport oxalátu, což mu umožňuje zvýšit expresi sat-1 mRNA a v důsledku toho odtok oxalátu z buňky. Zvýšené uvolňování oxalátu umožňuje hromadění oxalátu vápenatého v moči, a tím i případnou tvorbu ledvinových kamenů.[17]
Porucha metabolismu glyoxylátu poskytuje další mechanismus rozvoje hyperoxalurie. Ztráta funkčních mutací v genu HOGA1 vede ke ztrátě 4-hydroxy-2-oxoglutarát aldolázy, enzymu v dráze hydroxyprolinu na glyoxylát. Glyoxylát, který je výsledkem této dráhy, se obvykle skladuje, aby se zabránilo oxidaci na oxalát v cytosolu. Přerušená cesta však způsobuje nahromadění 4-hydroxy-2-oxoglutarátu, který může být také transportován do cytosolu a přeměněn na glyoxylát prostřednictvím jiné aldolázy. Tyto molekuly glyoxylátu mohou být oxidovány na oxalát, což zvyšuje jeho koncentraci a způsobuje hyperoxalurii.[16]
Reakce a použití
Kyselina glyoxylová je asi desetkrát silnější než kyselina octová kyselina, s kyselá disociační konstanta 4,7 × 10−4 (strK.A = 3.32):
- OCHCO2H ⇌ OCHCO−
2 + H+
S bází, kyselinou glyoxylovou nepřiměřené, formování kyselina hydroxyoctová a kyselina šťavelová:[Citace je zapotřebí ]
- 2 OCHCO2H + H2O → HOCH2CO2H + HO2CCO2H
Kyselina glyoxylová poskytuje heterocykly kondenzace s močovina a 1,2-diaminobenzen.
Fenolové deriváty
Kyselina glyoxylová obecně podléhá elektrofilní aromatická substituce reakce s fenoly, univerzální krok v syntéze několika dalších sloučenin.
Okamžitý produkt s fenol sám o sobě je Kyselina 4-hydroxymandlová. Tento druh reaguje s amoniakem za vzniku hydroxyfenylglycinu, předchůdce léčiva amoxicilin. Redukce kyseliny 4-hydroxymandlové dává Kyselina 4-hydroxyfenyloctová, předchůdce drogy atenolol.
Sled reakcí, při kterých reaguje kyselina glyoxylová guajakol fenolová složka následovaná oxidací a dekarboxylace, poskytuje cestu do vanilin jako síť formylace proces.[6][25][26]
Hopkinsova reakce
Kyselina glyoxylová je součástí Hopkinsova-Coleova reakce, slouží ke kontrole přítomnosti tryptofan v bílkovinách.[27]
Chemie životního prostředí
Kyselina glyoxylová je jednou z několika karboxylových kyselin obsahujících keton a aldehyd, které jsou společně bohaté na sekundární organické aerosoly. V přítomnosti vody a slunečního světla může kyselina glyoxylová podstoupit fotochemické oxidace. Může následovat několik různých reakčních cest, které vedou k různým dalším produktům karboxylové kyseliny a aldehydu.[28]
Bezpečnost
Sloučenina není velmi toxická s LD50 pro potkany 2500 mg / kg.
Reference
- ^ A b „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 748. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Disociační konstanty organických kyselin a zásad (600 sloučenin), http://zirchrom.com/organic.htm.
- ^ Údaje pKa sestavil R. Williams, „Archivovaná kopie“ (PDF). Archivovány od originál (PDF) dne 02.06.2010. Citováno 2010-06-02.CS1 maint: archivovaná kopie jako titul (odkaz).
- ^ Index společnosti Merck, 11. vydání, 4394
- ^ Sørensen, P. E .; Bruhn, K .; Lindeløv, F. (1974). „Kinetika a rovnováha pro reverzibilní hydrataci aldehydové skupiny v kyselině glyoxylové“. Acta Chem. Scand. 28: 162–168. doi:10,3891 / acta.chem.scand.28a-0162.
- ^ A b C Georges Mattioda a Yani Christidis „Glyoxylic Acid“ Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a12_495
- ^ Redington, Richard L .; Liang, Chin-Kang Jim (1984). "Vibrační spektra monomerů kyseliny glyoxylové". Journal of Molecular Spectroscopy. 104 (1): 25–39. Bibcode:1984JMoSp. 104 ... 25R. doi:10.1016 / 0022-2852 (84) 90242-X.
- ^ Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen (2009). „Efektivní Henryho zákonné konstanty glyoxalu, kyseliny glyoxylové a kyseliny glykolové“ (PDF). Dopisy o geofyzikálním výzkumu. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. doi:10.1029 / 2008GL036212.
- ^ Tafel, Julius; Friedrichs, Gustav (1904). „Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung“. Berichte der Deutschen Chemischen Gesellschaft. 37 (3): 3187–3191. doi:10,1002 / cber.190403703116.
- ^ Cohen, Julius (1920). Praktická organická chemie 2. vyd (PDF). London: Macmillan and Co. Limited. 102–104.
- ^ François Cardarelli (2008). Příručka materiálů: Stručná reference pro stolní počítače. Springer. str. 574. ISBN 978-1-84628-668-1.
- ^ Holms WH (1987). „Řízení toku cyklem kyseliny citronové a obtokem glyoxylátu v Escherichia coli“. Biochem Soc Symp. 54: 17–31. PMID 3332993.
- ^ Escher CL, Widmer F (1997). „Mobilizace lipidů a glukoneogeneze v rostlinách: představují aktivity enzymu glyoxylátového cyklu skutečný cyklus? Hypotéza“. Biol. Chem. 378 (8): 803–813. PMID 9377475.
- ^ Dubey, Mukesh K .; Broberg, Anders; Sooriyaarachchi, Sanjeewani; Ubhayasekera, Wimal; Jensen, Dan Funck; Karlsson, Magnus (září 2013). „Glyoxylátový cyklus se účastní pleotropních fenotypů, antagonismu a indukce obranných odpovědí rostlin v houbové biokontrolní látce Trichoderma atroviride.“ Plísňová genetika a biologie. 58–59: 33–41. doi:10.1016 / j.fgb.2013.06.008. ISSN 1087-1845. PMID 23850601.
- ^ Zhu, Li-Wen; Li, Xiao-Hong; Zhang, Lei; Li, Hong-Mei; Liu, Jian-Hua; Yuan, Zhan-Peng; Chen, Tao; Tang, Ya-Jie (listopad 2013). „Aktivace glyoxylátové cesty bez aktivace jejího příbuzného genu v produkované Escherichia coli produkující sukcinát“. Metabolické inženýrství. 20: 9–19. doi:10.1016 / j.ymben.2013.07.004. ISSN 1096-7176. PMID 23876414.
- ^ A b Belostotsky, Ruth; Pitt, James Jonathon; Frishberg, Yaacov (2012-12-01). „Primární hyperoxalurie typu III - model pro studium poruch metabolismu glyoxylátu“. Journal of Molecular Medicine. 90 (12): 1497–1504. doi:10.1007 / s00109-012-0930-z. hdl:11343/220107. ISSN 0946-2716. PMID 22729392. S2CID 11549218.
- ^ A b Schnedler, Nina; Burckhardt, Gerhard; Burckhardt, Birgitta C. (březen 2011). „Glyoxylát je substrátem sulfát-oxalátového výměníku sat-1 a zvyšuje jeho expresi v buňkách HepG2.“ Journal of Hepatology. 54 (3): 513–520. doi:10.1016 / j.jhep.2010.07.036. ISSN 0168-8278. PMID 21093948.
- ^ "fotorespirace". Citováno 2017-03-09.
- ^ A b Peterhansel, Christoph; Horst, Ina; Niessen, Markus; Blume, Christian; Kebeish, Rashad; Kürkcüoglu, Sophia; Kreuzaler, Fritz (2010-03-23). "Fotorespirace". Kniha Arabidopsis / Americká společnost rostlinných biologů. 8: e0130. doi:10.1199 / tab.0130. ISSN 1543-8120. PMC 3244903. PMID 22303256.
- ^ Zhang, Zhisheng; Mao, Xingxue; Ou, Juanying; Ye, Nenghui; Zhang, Jianhua; Peng, Xinxiang (leden 2015). „Zřetelné fotorespirační reakce jsou přednostně katalyzovány glutamátem: glyoxylátem a serinem: glyoxylátem aminotransferázami v rýži.“ Journal of Photochemistry and Photobiology B: Biology. 142: 110–117. doi:10.1016 / j.jphotobiol.2014.11.009. ISSN 1011-1344. PMID 25528301.
- ^ Blume, Christian; Behrens, Christof; Eubel, Holger; Braun, Hans-Peter; Peterhansel, Christoph (listopad 2013). "Možná role komplexu chloroplast pyruvát dehydrogenázy v rostlinném glykolátu a metabolismu glyoxylátu". Fytochemie. 95: 168–176. doi:10.1016 / j.phytochem.2013.07.009. ISSN 0031-9422. PMID 23916564.
- ^ A b Nikiforova, Victoria J .; Giesbertz, Pieter; Wiemer, Jan; Bethan, Bianca; Volnější, Ralf; Liebenberg, Volker; Ruiz Noppinger, Patricia; Daniel, Hannelore; Rein, Dietrich (2014). „Glyoxylát, nový značkový metabolit diabetu typu 2“. Journal of Diabetes Research. 2014: 685204. doi:10.1155/2014/685204. ISSN 2314-6745. PMC 4265698. PMID 25525609.
- ^ Nguyen, Dung V .; Shaw, Lynn C .; Grant, Maria B. (2012-12-21). „Zánět v patogenezi mikrovaskulárních komplikací u diabetu“. Hranice v endokrinologii. 3: 170. doi:10.3389 / fendo.2012.00170. ISSN 1664-2392. PMC 3527746. PMID 23267348.
- ^ Piarulli, Francesco; Sartore, Giovanni; Lapolla, Annunziata (duben 2013). „Glykooxidace a kardiovaskulární komplikace u diabetu typu 2: klinická aktualizace“. Acta Diabetologica. 50 (2): 101–110. doi:10.1007 / s00592-012-0412-3. ISSN 0940-5429. PMC 3634985. PMID 22763581.
- ^ Fatiadi, Alexander; Schaffer, Robert (1974). "Vylepšený postup pro syntézu DLKyselina -4-hydroxy-3-methoxymandlová (DL- "Vanillyl" - kyselina mandlová, VMA) ". Journal of Research of the National Bureau of Standards Section A. 78A (3): 411–412. doi:10,6028 / jres.078A.024. PMID 32189791.
- ^ Kamlet, Jonas; Mathieson, Olin (1953). Výroba vanilinu a jeho homologů US Patent 2640 083 (PDF). Americký patentový úřad.
- ^ R.A. Joshi (2006). Otázka Bank of Biochemistry. New Age International. str. 64. ISBN 978-81-224-1736-4.
- ^ Eugene, Alexis J .; Xia, Sha-Sha; Guzman, Marcelo I. (2016). "Vodná fotochemie kyseliny glyoxylové". J. Phys. Chem. A. 120 (21): 3817–3826. Bibcode:2016JPCA..120.3817E. doi:10.1021 / acs.jpca.6b00225. PMID 27192089.