(acyl-nosič-protein) S-malonyltransferáza - (acyl-carrier-protein) S-malonyltransferase
| Malonyl-CoA: ACP transacyláza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.3.1.39 | ||||||||
| Číslo CAS | 37257-17-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a [acyl-nosič-protein] S-malonyltransferáza (ES 2.3.1.39 ) je enzym že katalyzuje the chemická reakce
- malonyl-CoA + acylový protein ⇌ CoA + malonyl- [acyl-nosič-protein]
Tedy dva substráty tohoto enzymu jsou malonyl-CoA a acylový protein, zatímco jeho dva produkty jsou CoA a malonyl-acyl-nosičový protein. Tento enzym patří do rodiny transferázy, konkrétně ty acyltransferázy přenos jiné skupiny než aminoacylové skupiny. Tento enzym se účastní biosyntéza mastných kyselin.
Nomenklatura
The systematické jméno z této třídy enzymů je malonyl-CoA: [acyl-nosič-protein] S-malonyltransferáza. Mezi další běžně používaná jména patří transacyláza malonyl koenzymu A-acylového nosného proteinu,
- [protein acylového nosiče] malonyltransferáza,
- FabD,
- malonyl transacyláza,
- malonyl transferáza,
- malonyl-CoA-acylová nosná bílkovina transacyláza,
- malonyl-CoA: transacyláza ACP,
- malonyl-CoA: AcpM transacyláza,
- malonyl-CoA: acylový nosičový protein transacyláza,
- MAT a
- MCAT.
Struktura
Krystalové struktury FabD z E-coli [1] a Streptomyces coelicolor [2] jsou známé a poskytují skvělý přehled o katalytickém mechanismu FabD. v E-coli, FabD primárně zapojený do FAS dráhy. Nicméně v Streptomyces coelicolor„FabD se účastní drah FAS a polyketid syntázy. V obou případech jsou struktury a aktivní stránky velmi podobné.
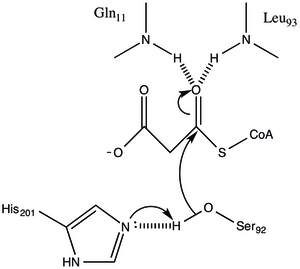
Protein má architekturu typu α / β, ale záhyb je jedinečný. aktivní místo odvozené z polohy katalytického Ser92 obsahuje typický nukleofilní loket, jak je pozorováno u α / β hydroláz.[1] Serin 92 je vodíkově vázán k His 201 způsobem podobným různým serinovým hyrdolases. avšak místo karboxylové kyseliny, která se typicky nachází v katalytických triádách, slouží karbonyl hlavního řetězce Gln 250 jako akceptor vodíkové vazby v interakci s His 201.[1] Dva další zbytky, Arg-117 a Glu-11, jsou také umístěny v aktivním místě, ale jejich funkce není jasná.
Funkce
The mastné kyseliny syntetická cesta je hlavní cestou pro výrobu membrány fosfolipid acylové řetězce v bakteriích a rostlinách.[3] Reakční sekvence se provádí řadou jednotlivých rozpustných proteinů, z nichž každý je kódován diskrétním genem, a meziprodukty dráhy jsou propojeny mezi enzymy.[3] Malony-CoA: ACP transacyláza (FabD) je jeden takový individuální rozpustný protein a katalyzuje následující reakci:
- malonyl-CoA + acylový protein ⇌ CoA + malonyl- [acyl-nosič-protein]
Převod malonát na acylový nosičový protein (ACP) převádí acylové skupiny na thioesterové formy, které jsou charakteristické pro acylové meziprodukty při syntéze mastných kyselin a které jsou striktně nutné pro kondenzační reakce katalyzované β-ketoacyl-ACP syntetázou.[4]
Mechanismus
Malonyl-CoA: ACP Transacylase používá a kinetický mechanismus ping-pongu s navázaným malony esterem jako acylovým meziproduktem připojeným k serinovému zbytku pobývajícímu v pentapeptidu GHSLG.[5] FabD nejprve váže malonyl-CoA, malonylová část se poté přenáší na aktivní místo Ser 92 a CoA se uvolňuje z enzymu. ACP se poté váže a malonylová skupina se přenáší na koncový sulfhydryl protetické skupiny ACP. Tato reakce je snadno reverzibilní.[3][6]

Průmyslová relevance
Ze všech známých metabolických cest v živých systémech biosyntéza mastných kyselin poskytuje produkty s nejvyšší energetickou hustotou.[7] Výsledkem je, že se mikrobiální deriváty mastných kyselin stávají slibnou alternativou obnovitelné energie k přepravním palivům z fosilních paliv. Nedávno Khosla a kol.[7] vyvinuli postup pro rekonstituci E.Coli mastné kyseliny syntázy s použitím purifikovaných proteinových složek (včetně FabD) a uvedli podrobnou kinetickou analýzu tohoto in vitro rekonstituovaného systému.[8] Jejich nález poskytuje nový základ pro hodnocení rozsahu a omezení použití E.Coli jako biokatalyzátoru pro výrobu motorové nafty.
Klinický význam
FabD jako cíl pro objevování antibakteriálních léků: nadcházející pole
Biosyntézu mastných kyselin provádí všudypřítomný Syntáza mastných kyselin.[9] Syntáza mastných kyselin cesty jsou rozděleny do dvou odlišných molekulárních forem: Typ I a Typ II.[10] U typu I, Syntáza mastných kyselin (nalezený u lidí a jiných savců) je jediný velký polypeptid složený z několika odlišných domén.[11] Na druhou stranu každá enzymatická aktivita (Kondenzační reakce, Redukční reakce, Dehydratační reakce ) se nachází jako samostatný protein v systémech typu II.[12] Rozdíl v organizaci aktivního místa a převaha systémů FAS typu II v bakteriích činí z enzymů této dráhy atraktivní cíle pro antibakteriální látky.[9][12]
FabD (Acyl-Carrier-Protein S-Malonyltransferase) je rozumný cíl vzhledem k tomu, že je k dispozici krystalová struktura s vysokým rozlišením.[9] V literatuře a v recenzních článcích na toto téma však nebyly popsány žádné inhibitory FabD.[9] Zdá se, že jednoduchá struktura a kyselost malonátu umožňuje několik přístupů k syntéze derivátů (působících jako potenciální inhibitory), které si zachovávají charakter molekuly.
Druhý přístup pro použití FabD jako lékového cíle je často identifikován v literatuře: FabD může poskytnout užitečnou značku pro lokalizaci genů fab, protože gen FabD obvykle sousedí s alespoň jedním dalším genem fab.[13] Nicméně (od roku 2015) se žádné potenciální léky nepokusily tuto vlastnost využít.
Reference
- ^ A b C d Serre L, Verbree EC, Dauter Z, Stuitje AR, Derewenda ZS (červen 1995). „Malonyl-CoA z Escherichia coli: acylový nosičový protein transacyláza v rozlišení 1,5-A. Krystalová struktura složky syntázy mastných kyselin“. The Journal of Biological Chemistry. 270 (22): 12961–4. doi:10.1074 / jbc.270.22.12961. PMID 7768883.
- ^ Keatinge-Clay AT, Shelat AA, Savage DF, Tsai SC, Miercke LJ, O'Connell JD, Khosla C, Stroud RM (únor 2003). „Katalýza, specificita a dokovací místo ACP Streptomyces coelicolor malonyl-CoA: transacyláza ACP“. Struktura. 11 (2): 147–54. doi:10.1016 / s0969-2126 (03) 00004-2. PMID 12575934.
- ^ A b C d White SW, Zheng J, Zhang YM (červen 2005). "Strukturní biologie biosyntézy mastných kyselin typu II". Roční přehled biochemie. 74 (1): 791–831. doi:10,1146 / annurev.biochem.74.082803.133524. PMID 15952903.
- ^ Ruch FE, Vagelos PR (prosinec 1973). „Izolace a obecné vlastnosti transacylázy nosného proteinu A-acyl nosného proteinu Escherichia coli malonyl.“ The Journal of Biological Chemistry. 248 (23): 8086–94. PMID 4584822.
- ^ Ruch FE, Vagelos PR (prosinec 1973). "Izolace a obecné vlastnosti Escherichia coli malonyl koenzym A-acylový nosný protein transacyláza ". The Journal of Biological Chemistry. 248 (23): 8086–94. PMID 4584822.
- ^ Oefner C, Schulz H, D'Arcy A, Dale GE (červen 2006). "Mapování aktivního místa malonyl-CoA-acylového nosního proteinu transacylázy (FabD) Escherichia coli pomocí proteinové krystalografie". Acta Crystallographica oddíl D. 62 (Pt 6): 613–618. doi:10.1107 / S0907444906009474. PMID 16699188.
- ^ A b Liu T, Khosla C (2010). "Genetické inženýrství Escherichia coli pro výrobu biopaliv". Výroční přehled genetiky. 44: 53–69. doi:10.1146 / annurev-genet-102209-163440. PMID 20822440.
- ^ Yu X, Liu T, Zhu F, Khosla C (listopad 2011). „Rekonstituce in vitro a analýza syntézy mastných kyselin z Escherichia coli v ustáleném stavu“. Sborník Národní akademie věd Spojených států amerických. 108 (46): 18643–8. Bibcode:2011PNAS..10818643Y. doi:10.1073 / pnas.1110852108. PMC 3219124. PMID 22042840.
- ^ A b C d Payne DJ, Warren PV, Holmes DJ, Ji Y, Lonsdale JT (květen 2001). „Bakteriální biosyntéza mastných kyselin: cíl zaměřený na genomiku pro objevování antibakteriálních léčiv“. Objev drog dnes. 6 (10): 537–544. doi:10.1016 / S1359-6446 (01) 01774-3. PMID 11369293.
- ^ Rock CO, Cronan JE (červenec 1996). „Escherichia coli jako model pro regulaci biosyntézy disociovatelné mastné kyseliny typu II“. Biochimica et Biophysica Acta (BBA) - lipidy a metabolismus lipidů. 1302 (1): 1–16. doi:10.1016/0005-2760(96)00056-2. PMID 8695652.
- ^ Chirala SS, Huang WY, Jayakumar A, Sakai K, Wakil SJ (květen 1997). „Živočišná syntáza mastných kyselin: funkční mapování a klonování a exprese základních složek domény I“. Sborník Národní akademie věd Spojených států amerických. 94 (11): 5588–93. Bibcode:1997PNAS ... 94.5588C. doi:10.1073 / pnas.94.11.5588. PMC 20822. PMID 9159116.
- ^ A b Tsay JT, Oh W, Larson TJ, Jackowski S, Rock CO (duben 1992). „Izolace a charakterizace genu pro beta-ketoacyl-acylový proteinový protein syntázy III (fabH) z Escherichia coli K-12“. The Journal of Biological Chemistry. 267 (10): 6807–14. PMID 1551888.
- ^ Campbell JW, Cronan JE (2001). „Bakteriální biosyntéza mastných kyselin: cíle pro objev antibakteriálních léčiv“. Výroční přehled mikrobiologie. 55: 305–32. doi:10.1146 / annurev.micro.55.1.305. PMID 11544358.
Další čtení
- Alberts AW, Majerus PW, Vagelos PR (1969). "Acetyl-CoA acylový nosičový protein transacyláza". Metody Enzymol. Metody v enzymologii. 14: 50–53. doi:10.1016 / S0076-6879 (69) 14009-4. ISBN 978-0-12-181871-5.
- Prescott DJ, Vagelos PR (1972). "Acylový nosičový protein". Pokroky v enzymologii a souvisejících oblastech molekulární biologie. Pokroky v enzymologii a souvisejících oblastech molekulární biologie. 36. 269–311. doi:10.1002 / 9780470122815.ch8. ISBN 9780470122815. PMID 4561013.
- Williamson IP, Wakil SJ (květen 1966). „Studie mechanismu syntézy mastných kyselin. XVII. Příprava a obecné vlastnosti transacyláz nosného proteinu acetyl koenzymu A a malonylu koenzymu A-acylu“. The Journal of Biological Chemistry. 241 (10): 2326–32. PMID 5330116.
- Joshi VC, Wakil SJ (duben 1971). "Studie mechanismu syntézy mastných kyselin. XXVI. Čištění a vlastnosti malonyl-koenzymu A - acylového nosného proteinu transacylázy z Escherichia coli". Archivy biochemie a biofyziky. 143 (2): 493–505. doi:10.1016/0003-9861(71)90234-7. PMID 4934182.
- Kremer L, Nampoothiri KM, Lesjean S, Dover LG, Graham S, Betts J, Brennan PJ, Minnikin DE, Locht C, Besra GS (červenec 2001). „Biochemická charakterizace acylového nosného proteinu (AcpM) a malonyl-CoA: AcpM transacyláza (mtFabD), dvě hlavní složky syntázy mastných kyselin Mycobacterium tuberculosis II“. The Journal of Biological Chemistry. 276 (30): 27967–74. doi:10,1074 / jbc.M103687200. PMID 11373295.
- Keatinge-Clay AT, Shelat AA, Savage DF, Tsai SC, Miercke LJ, O'Connell JD, Khosla C, Stroud RM (únor 2003). „Katalýza, specificita a dokovací místo ACP Streptomyces coelicolor malonyl-CoA: transacyláza ACP“. Struktura. 11 (2): 147–54. doi:10.1016 / S0969-2126 (03) 00004-2. PMID 12575934.
- Szafranska AE, Hitchman TS, Cox RJ, Crosby J, Simpson TJ (únor 2002). „Kinetická a mechanická analýza malonylu CoA: transacyláza ACP ze Streptomyces coelicolor naznačuje jediný katalyticky kompetentní serinový nukleofil v aktivním místě“. Biochemie. 41 (5): 1421–7. doi:10.1021 / bi012001p. PMID 11814333.

