Claisenův přesmyk - Claisen rearrangement - Wikipedia
| Claisenův přesmyk | |
|---|---|
| Pojmenoval podle | Rainer Ludwig Claisen |
| Typ reakce | Reakce přesmyku |
| Identifikátory | |
| Portál organické chemie | klaisenovo přeskupení |
| RSC ontologické ID | RXNO: 0000148 |
The Claisenův přesmyk je mocný uhlík -uhlík pouto -formující chemická reakce objevená Rainer Ludwig Claisen. Vytápění allyl vinyl éter zahájí a [3,3] -sigmatropní přesmyk za vzniku y, 8-nenasyceného karbonylu.

Claisenovo přesmyk, který byl objeven v roce 1912, je prvním zaznamenaným příkladem [3,3] -sigmatropního přeskupení.[1][2][3] Bylo napsáno mnoho recenzí.[4][5][6][7]
Mechanismus
Claisenův přesmyk je exotermické společně (štěpení vazby a rekombinace) pericyklický reakce. Woodward – Hoffmann vládne ukazují suprafaciální, stereospecifickou reakční cestu. Kinetika je prvního řádu a celá transformace probíhá vysoce uspořádaným cyklickým přechodovým stavem a je intramolekulární. Crossover experimenty vyloučit možnost přesmyku, ke kterému dochází prostřednictvím mezimolekuly mechanismus reakce a jsou v souladu s intramolekulárním procesem.[8][9]
Existují podstatné rozpouštědlové efekty pozorováno v Claisenově přesmyku, kde polární rozpouštědla mají tendenci urychlovat reakci ve větší míře. Rozpouštědla vázající vodík poskytly konstanty nejvyšší rychlosti. Například, ethanol směsi vody a rozpouštědla poskytují rychlostní konstanty 10krát vyšší než sulfolan.[10][11] Trojmocná organohlinitá činidla, jako je např trimethylaluminium Bylo prokázáno, že tuto reakci urychlují.[12][13]
Variace
Aromatický Claisenův přesmyk
První hlášené Claisenovo přeskupení je [3,3] -sigmatropní přesmyk z allyl fenyl éter na střední 1, který rychle tautomerizuje do ortho-substituovaný fenol.

Meta-substituce ovlivňuje regioselektivita tohoto přeskupení.[14][15] Například skupiny přitahující elektrony (jako je bromid) na meta- poloha směřuje přeskupení na ortho-pozice (71% ortho produkt), zatímco skupiny poskytující elektrony (jako je methoxy), přímé přeskupení na odst-pozice (69% odst produkt). Navíc přítomnost ortho substituenty vedou výlučně k para-substituovaným přesmykovým produktům (tandemový Claisenův a Copeův přesmyk).[16]
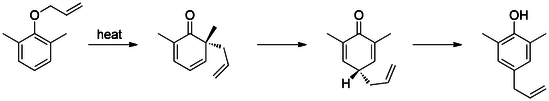
Pokud aldehyd nebo karboxylová kyselina zabírá ortho nebo odst pozic, allylový postranní řetězec přemístí skupinu a uvolní ji jako kysličník uhelnatý nebo oxid uhličitý, resp.[17][18]
Bellus – Claisenův přesmyk
Bellus – Claisenův přesmyk je reakce allylických etherů, aminů a thioetherů s keteny za vzniku γ, δ-nenasycených esterů, amidů a thioesterů.[19][20][21] Tuto transformaci náhodně pozoroval Bellus v roce 1979 syntézou klíčového meziproduktu insekticidu, pyrethroidu. Halogenem substituované keteny (R.1, R.2) se v této reakci často používají pro svou vysokou elektrofilitu. Byla vyvinuta řada redukčních metod pro odstranění výsledných α-haloesterů, amidů a thioesterů.[22][23] Bellus-Claisen nabízí syntetickým chemikům jedinečnou příležitost pro strategie expanze prstenců.

Eschenmoser – Claisenův přesmyk
Přeuspořádání Eschenmoser – Claisen probíhá zahříváním allylalkoholů za přítomnosti N,N-dimethylacetamid dimethylacetal za vzniku y, 5-nenasyceného amidu. To bylo vyvinuto Albert Eschenmoser v roce 1964.[24][25] Eschenmoser-Claisenův přesmyk byl použit jako klíčový krok v celkové syntéze morfinu.[26]
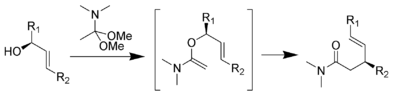
Mechanismus:[16]

Irsko – Claisenův přesmyk
Irsko – Claisenův přesmyk je reakcí allylický karboxylát se silnou základnou (např lithium diisopropylamid ) za vzniku γ, δ-nenasyceného karboxylová kyselina.[27][28][29] Přesmyk probíhá prostřednictvím silylketen-acetalu, který se vytváří zachycením lithného enolátu s chlortrimethylsilanem. Stejně jako Bellus-Claisen (výše), i Irsko-Claisenův přesmyk může probíhat při pokojové teplotě a vyšší. The E- a Z-konfigurované silylketenacetaly vedou k produktům s přeskupením anti a syn.[30] V literatuře existuje řada příkladů enantioselektivních přeskupení Irska a Claisena, které zahrnují chirální bórová činidla a použití chirálních pomocných látek.[31][32]

Johnson – Claisenův přesmyk
Johnson-Claisenův přesmyk je reakcí allylický alkohol s orthoester výtěžek a y, δ-nenasycené ester.[33] K katalýze této reakce byly použity slabé kyseliny, jako je kyselina propionová. Toto přeskupení často vyžaduje vysoké teploty (100–200 ° C) a může trvat kdekoli od 10 do 120 hodin.[34] Avšak mikrovlnné zahřívání v přítomnosti jíl KSF nebo kyseliny propionové prokázalo dramatické zvýšení reakční rychlosti a výtěžků.[35][36]

Mechanismus:[16]

Photo-Claisenův přesmyk
Claisenův přesmyk aryletherů lze také provést jako a fotochemické reakce. Kromě tradičních ortho produkt získaný za tepelných podmínek (produkt [3,3] přesmyku), fotochemická variace také dává odst produkt ([3,5] produkt), alternativní izomery allylové skupiny (například produkty [1,3] a [1,5]) a jednoduchá ztráta etherové skupiny a dokonce může navíc uspořádat alkylethery na allylethery. Fotochemická reakce probíhá postupným procesem radikálového štěpení, po kterém následuje spíše tvorba vazby, než koordinovaná pericyklická reakce, což tedy umožňuje příležitost pro větší rozmanitost možných substrátů a izomerů produktů.[37] [1,3] a [1,5] výsledky foto-Claisenova přesmyku jsou analogické s foto-hranolky přesmyk arylesterů a příbuzných acylových sloučenin.[38]
Hetero-Claisens
Aza – Claisen
An iminium může sloužit jako jedna z částí vázaných na pí v přesmyku.[39]

Oxidace chromu
Chrom může oxidovat allylalkoholy na α, β-nenasycené ketony na opačné straně nenasycené vazby od alkoholu. To je prostřednictvím koordinované hetero-Claisenovy reakce, i když existují mechanistické rozdíly od doby chrom atom má přístup k d-orbitalům, které umožňují reakci v méně omezené sadě geometrií.[40][41]
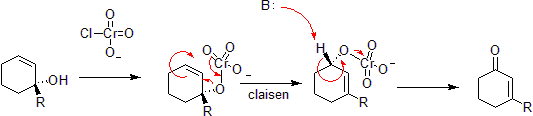
Reakce Chen – Mapp
Chen – Mappova reakce, známá také jako [3,3] -fosforimidátový přesmyk nebo Staudinger – Claisenova reakce, instaluje místo alkoholu alkohol fosfit a využívá výhod Staudingerova redukce převést to na imin. Následující Claisen je řízen skutečností, že dvojná vazba P = O je energeticky výhodnější než dvojná vazba P = N.[42]

Overman přesmyk
The Overman přesmyk (pojmenoval podle Larry Overman ) je Claisenův přesmyk allyl trichloracetimidátů na allyl trichloracetamidy.[43][44][45]

Overmanovo přesmyk je použitelný pro syntézu vicinol diaminosloučenin z 1,2-vicinálních allylových diolů.
Zwitterionický Claisenův přesmyk
Na rozdíl od typických Claisenových přeskupení, která vyžadují topení, zwitterionický Claisenovy přesmyky probíhají při pokojové teplotě nebo nižší. The acyl amonné ionty jsou vysoce selektivní pro Z-enoláty za mírných podmínek.[46][47]

V přírodě
Enzym chorismát mutáza (EC 5.4.99.5) katalyzuje Claisenův přesmyk chorismát na prefenovat, klíčový meziprodukt v biosyntetický cesta k syntéze fenylalanin a tyrosin.[48]

Viz také
Reference
- ^ Claisen, L. (1912). „Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole“. Chemische Berichte. 45 (3): 3157–3166. doi:10.1002 / cber.19120450348.
- ^ Claisen, L .; Tietze, E. (1925). „Über den Mechanismus der Umlagerung der Phenol-allyläther“. Chemische Berichte. 58 (2): 275. doi:10,1002 / cber.19250580207.
- ^ Claisen, L .; Tietze, E. (1926). „Über den Mechanismus der Umlagerung der Phenol-allyläther. (2. Mitteilung)“. Chemische Berichte. 59 (9): 2344. doi:10,1002 / cber.19260590927.
- ^ Hiersemann, M .; Nubbemeyer, U. (2007) Claisenův přesmyk. Wiley-VCH. ISBN 3-527-30825-3
- ^ Rhoads, S. J .; Raulins, N. R. (1975). Claisen a Cope přesmyky. Org. Reagovat. 22. s. 1–252. doi:10.1002 / 0471264180.nebo022.01. ISBN 978-0471264187.
- ^ Ziegler, F. E. (1988). "Tepelné, alifatické Claisenovo přeskupení". Chem. Rev. 88 (8): 1423–1452. doi:10.1021 / cr00090a001.
- ^ Wipf, P. (1991). "Claisenovy přesmyky". Komplexní organická syntéza. Kompr. Org. Synth. 5. 827–873. doi:10.1016 / B978-0-08-052349-1.00140-2. ISBN 978-0-08-052349-1.
- ^ Hurd, C. D .; Schmerling, L. (1937). "Postřehy o přesmyku allyl arylových etherů". J. Am. Chem. Soc. 59: 107. doi:10.1021 / ja01280a024.
- ^ Francis A. Carey; Richard J. Sundberg (2007). Pokročilá organická chemie: Část A: Struktura a mechanismy. Springer. 934–935. ISBN 978-0-387-44897-8.
- ^ Claisen, L. (1912). „Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole“. Chemische Berichte. 45 (3): 3157–3166. doi:10.1002 / cber.19120450348.
- ^ Claisen, L .; Tietze, E. (1925). „Über den Mechanismus der Umlagerung der Phenol-allyläther“. Chemische Berichte. 58 (2): 275. doi:10.1002 / cber.19250580207.
- ^ Goering, H. L .; Jacobson, R. R. (1958). „Kinetická studie ortho-Claisenova přesmyku1“. J. Am. Chem. Soc. 80 (13): 3277. doi:10.1021 / ja01546a024.
- ^ White, W. N .; Wolfarth, E. F. (1970). „O-Claisenův přesmyk. VIII. Účinky rozpouštědel“. J. Org. Chem. 35 (7): 2196. doi:10.1021 / jo00832a019.
- ^ White, William; a Slater, Carl, William N .; Slater, Carl D. (1961). „The ortho- Vyřízené přeskupení. V. Produkty přesmyku Allyl m-X-fenylové ethery “. The Journal of Organic Chemistry. 26 (10): 3631–3638. doi:10.1021 / jo01068a004.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Gozzo, Fábio; Fernandes, Sergio; Rodrigues, Denise; Eberlin, Marcos; a Marsaioli, Anita, Fábio Cesar; Fernandes, Sergio Antonio; Rodrigues, Denise Cristina; Eberlin, Marcos Nogueira; Marsaioli, Anita Jocelyne (2003). "Regioselektivita v aromatických Claisenových přeskupeních". The Journal of Organic Chemistry. 68 (14): 5493–5499. doi:10.1021 / jo026385g. PMID 12839439.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C László Kürti; Barbara Czakó (2005). Strategické aplikace pojmenovaných reakcí v organické syntéze: Pozadí a podrobná mechanika: 250 pojmenovaných reakcí. Akademický tisk. ISBN 978-0-12-429785-2. Citováno 27. března 2013.
- ^ Adams, Rodger (1944). Organické reakce, svazek II. New York: John Wiley & Sons, Inc. s. 11–12.
- ^ Claisen, L .; Eisleb, O. (1913). „Über die Umlagerung von Phenolallyläthern in die isomeren Allylphenole“. Justus Liebigs Annalen der Chemie. 401 (1): 90. doi:10.1002 / jlac.19134010103.
- ^ Malherbe, R .; Bellus, D. (1978). „Nový typ Claisenova přesmyku zahrnujícího 1,3-dipolární meziprodukty. Předběžná komunikace“. Helv. Chim. Acta. 61 (8): 3096–3099. doi:10,1002 / hlca.19780610836.
- ^ Malherbe, R .; Rist, G .; Bellus, D. (1983). „Reakce haloketenů s allylethery a thioethery: nový typ Claisenova přesmyku“. J. Org. Chem. 48 (6): 860–869. doi:10.1021 / jo00154a023.
- ^ Gonda, J. (2004). „Belluš – Claisenův přesmyk“. Angew. Chem. Int. Vyd. 43 (27): 3516–3524. doi:10.1002 / anie.200301718. PMID 15293240.
- ^ Edstrom, E (1991). „Neočekávaný obrat ve stereochemii transanulárních cyklizací. Stereoselektivní syntéza (±) -epilupininu“. Čtyřstěn dopisy. 32 (41): 5709–5712. doi:10.1016 / S0040-4039 (00) 93536-6.
- ^ Bellus (1983). „Reakce haloketenů s allylethery a thioethery: nový typ Claisenova přesmyku“. The Journal of Organic Chemistry. 48 (6): 860–869. doi:10.1021 / jo00154a023.
- ^ Wick, A.E .; Felix, D .; Steen, K .; Eschenmoser, A. (1964). „CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit Hilfe von Acetalen des N, N-Dimethylacetamids. Vorläufige Mitteilung“. Helv. Chim. Acta. 47 (8): 2425–2429. doi:10,1002 / hlca.19640470835.
- ^ Wick, A.E .; Felix, D .; Gschwend-Steen, K .; Eschenmoser, A. (1969). „CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit 1-Dimethylamino-1-methoxy-äthen“. Helv. Chim. Acta. 52 (4): 1030–1042. doi:10,1002 / hlca.19690520418.
- ^ Guillou, C (2008). "Diastereoselektivní celková syntéza (±) -kodeinu". Chem. Eur. J. 14 (22): 6606–6608. doi:10.1002 / chem.200800744. PMID 18561354.
- ^ Irsko, R. E .; Mueller, R. H. (1972). "Claisenův přesmyk allylesterů". Journal of the American Chemical Society. 94 (16): 5897. doi:10.1021 / ja00771a062.
- ^ Irsko, R. E .; Willard, A. K. (1975). "Stereoselektivní generace esterových enolátů". Tetrahedron Lett. 16 (46): 3975–3978. doi:10.1016 / S0040-4039 (00) 91213-9.
- ^ Irsko, R. E .; Mueller, R. H .; Willard, A. K. (1976). "Ester enolát Claisenův přesmyk. Stereochemická kontrola prostřednictvím stereoselektivní tvorby enolátu". Journal of the American Chemical Society. 98 (10): 2868. doi:10.1021 / ja00426a033.
- ^ Irsko, R. E. (1991). "Stereochemická kontrola v Clanově přeskupení enolátu enolátu". 56 (2): 650–657. doi:10.1021 / jo00002a030. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Enders, E (1996). „Asymetrické [3,3] -sigmatropní přesmyky v organické syntéze“. Čtyřstěn: Asymetrie. 7 (7): 1847–1882. doi:10.1016/0957-4166(96)00220-0.
- ^ Corey, E (1991). „Vysoce enantioselektivní a diastereoselektivní irsko-Claisenovo přeskupení achirálních allylových esterů“. Journal of the American Chemical Society. 113 (10): 4026–4028. doi:10.1021 / ja00010a074.
- ^ Johnson, William Summer; Werthemann, Lucius; Bartlett, William R .; Brocksom, Timothy J .; Li, Tsung-Tee; Faulkner, D. John; Petersen, Michael R. (1. února 1970). „Jednoduchá stereoselektivní verze Claisenova přesmyku vedoucí k trans-trisubstituovaným olefinickým vazbám. Syntéza skvalenu“. Journal of the American Chemical Society. 92 (3): 741–743. doi:10.1021 / ja00706a074. ISSN 0002-7863.
- ^ Fernandes, R. A. (2013). „Nové uspořádání Orthoester Johnson-Claisen v syntéze bioaktivních molekul, přírodních produktů a syntetických meziproduktů - poslední pokroky“. European Journal of Organic Chemistry. 2014 (14): 2833–2871. doi:10.1002 / ejoc.201301033.
- ^ Huber, R. S. (1992). "Zrychlení orthoesterového Claisenova přesmyku jílovou katalyzovanou mikrovlnnou termolýzou: rychlá cesta k bicyklickým laktonům". The Journal of Organic Chemistry. 57 (21): 5778–5780. doi:10.1021 / jo00047a041.
- ^ Srikrishna, A (1995). „Aplikace techniky mikrovlnného ohřevu pro rychlou syntézu γ, δ-nenasycených esterů“. Čtyřstěn. 51 (6): 1809–1816. doi:10.1016/0040-4020(94)01058-8.
- ^ Galindo, Francisco (2005). „Fotochemické přeskupení aromatických etherů: přehled reakce Photo-Claisen“. Journal of Photochemistry and Photobiology C: Photochemistry Reviews. 6: 123–138. doi:10.1016 / j.jphotochemrev.2005.08.001.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “foto-hranolky přesmyk ". doi:10.1351 / zlatá kniha.P04614
- ^ Kurth, M. J .; Decker, O. H. W. (1985). "Enantioselektivní příprava 3-substituovaných 4-pentenových kyselin prostřednictvím Claisenova přesmyku". J. Org. Chem. 50 (26): 5769–5775. doi:10.1021 / jo00350a067.
- ^ Dauben, W. G .; Michno, D. M. (1977). „Přímá oxidace terciárních allylalkoholů. Jednoduchá a účinná metoda pro alkylační karbonylovou transpozici“. J. Org. Chem. 42 (4): 682. doi:10.1021 / jo00424a023.
- ^ „(R) - (+) - 3,4-dimethylcyklohex-2-en-1-on". Organické syntézy. 82: 108. 2005. doi:10.15227 / orgsyn.082.0108.
- ^ Chen, B .; Mapp, A. (2005). „Tepelné a katalyzované [3,3] -fosforimidátové přesmyky“. Journal of the American Chemical Society. 127 (18): 6712–6718. doi:10.1021 / ja050759g. PMID 15869293.
- ^ Overman, L. E. (1974). „Termální a rtuťnatý iont katalyzovaný [3,3] -sigmatropní přesmyk allylových trichloracetimidátů. 1,3-Transpozice alkoholových a aminových funkcí“. Journal of the American Chemical Society. 96 (2): 597–599. doi:10.1021 / ja00809a054.
- ^ Overman, L. E. (1976). "Obecná metoda pro syntézu aminů přesmykem allyl trichloracetimidátů. 1,3-Transpozice alkoholových a aminových funkcí". Journal of the American Chemical Society. 98 (10): 2901–2910. doi:10.1021 / ja00426a038.
- ^ "Allylicky transponované aminy z allylalkoholů: 3,7-dimethyl-1,6-oktadien-3-amin". Organické syntézy. 58: 4. 1978. doi:10,15227 / orgsyn.058.0004.
- ^ Yu, C.-M .; Choi, H.-S .; Lee, J .; Jung, W.-H .; Kim, H.-J. (1996). „Samoregulační molekulární přesmyk: Diastereoselektivní zwitteriontový aza-Claisenův protokol“. J. Chem. Soc., Perkin Trans. 1 (2): 115–116. doi:10.1039 / p19960000115.
- ^ Nubbemeyer, U. (1995). „1,2-asymetrická indukce v Zwitterionic Claisenově přesmyku alylaminů“. J. Org. Chem. 60 (12): 3773–3780. doi:10.1021 / jo00117a032.
- ^ Ganem, B. (1996). „Mechanismus Claisenova přesmyku: Déjà Vu znovu dokola“. Angew. Chem. Int. Vyd. Angl. 35 (9): 936–945. doi:10.1002 / anie.199609361.
