Odolnost vůči chorobám rostlin - Plant disease resistance - Wikipedia


Odolnost vůči chorobám rostlin chrání rostliny před patogeny dvěma způsoby: předem vytvořenými strukturami a chemikáliemi a reakcemi imunitního systému vyvolanými infekcemi. Ve vztahu k náchylné rostlině, odolnost vůči chorobám je omezení růstu patogenů na rostlině nebo v rostlině (a tedy snížení choroby), zatímco termín tolerance k chorobám popisuje rostliny, které vykazují malé poškození chorobou navzdory značné úrovni patogenů. Výsledek onemocnění je určen třícestnou interakcí patogenu, rostliny a podmínek prostředí (interakce známá jako trojúhelník nemoci).
Sloučeniny aktivující obranu se mohou pohybovat z buňky do buňky a systematicky přes cévní systém rostliny. Rostliny však nemají cirkulaci imunitní buňky, takže většina typů buněk vykazuje širokou sadu antimikrobiální obrany. I když je to zřejmé kvalitativní rozdíly v rezistenci vůči chorobám lze pozorovat při srovnání více vzorků (což umožňuje klasifikaci jako „rezistentní“ nebo „náchylné“ po infekci stejným kmenem patogenů na podobných úrovních inokula v podobných prostředích), gradace kvantitativní rozdíly v odolnosti vůči chorobám jsou typičtěji pozorovány mezi kmeny rostlin nebo genotypy. Rostliny trvale odolávají určitým patogenům, ale podlehají ostatním; rezistence je obvykle specifická pro určité druhy patogenů nebo kmeny patogenů.
Pozadí
Odolnost proti chorobám rostlin je zásadní pro spolehlivou produkci potravin a poskytuje významné snížení zemědělského využití půdy, vody, paliva a dalších vstupů. Rostliny v přirozené i kultivované populaci nesou inherentní odolnost vůči chorobám, ale ne vždy je to chránilo.
Pozdní plíseň Velký hladomor Irska čtyřicátých let byla způsobena oomycete Phytophthora infestans. První masově kultivovaný na světě banán kultivar Gros Michel byl ztracen ve 20. letech 20. století Panamská nemoc způsobené houbou Fusarium oxysporum. Současná pšenice rez stonku, rez listí a rez žlutým pruhem epidemie šířící se z východní Afriky na indický subkontinent jsou způsobeny rzi Puccinia graminis a P. striiformis. Mezi další epidemie patří Kaštanová plíseň, stejně jako opakující se závažné choroby rostlin, jako je Rýže výbuch, Sojový cystový nematoda, Citrusová rakovina.[1][2]
Rostlinné patogeny se mohou rychle šířit na velké vzdálenosti, přičemž jsou přenášeny vodou, větrem, hmyzem a lidmi. Odhaduje se, že v rozlehlých oblastech a mnoha druzích plodin choroby obvykle snižují výnosy rostlin každý rok o 10% ve vyspělejších zemích nebo zemědělských systémech, ale ztráta výnosu chorob často přesahuje 20% v méně rozvinutých podmínkách.[1]
Kontrola choroby je však u většiny plodin poměrně úspěšná. Kontrola nemocí se dosahuje použitím rostlin, které byly vyšlechtěny pro dobrou odolnost vůči mnoha chorobám, a pomocí postupů pěstování rostlin, jako je střídání plodin, osivo bez patogenů, vhodné datum výsadby a hustota rostlin, kontrola vlhkosti pole a pesticid použití.
Běžné mechanismy odolnosti vůči chorobám
Předtvarované struktury a sloučeniny
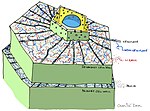
- Rostlinná kutikula /povrch
- Rostlina buněčné stěny
- Antimikrobiální Chemikálie (například: polyfenoly, seskviterpenové laktony, saponiny )
- Antimikrobiální peptidy
- Inhibitory enzymů
- Detoxikační enzymy, které štěpí deriváty patogenů toxiny
- Receptory, které vnímají přítomnost patogenů a aktivují indukovatelnou obranu rostlin[3]
Indukovatelná obrana rostlin po infekci
- Buněčná stěna výztuž (celulóza, lignin, ponorka, callose, proteiny buněčné stěny)[4]
- Antimikrobiální chemikálie, včetně reaktivních forem kyslíku, jako je peroxid vodíku nebo peroxynitrit nebo složitější fytoalexiny jako genistein nebo camalexin
- Antimikrobiální proteiny jako např defensiny, thioniny nebo PR-1
- Antimikrobiální enzymy jako např chitinázy, beta-glukanázy nebo peroxidázy[4]
- Hypersenzitivní reakce - rychlá reakce smrti hostitelských buněk spojená s indukcí obrany.
Imunitní systém
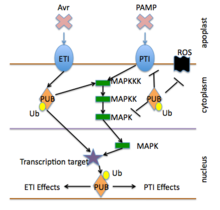
Imunitní systém rostlin nese dvě vzájemně propojené úrovně receptorů, jednu nejčastěji snímající molekuly mimo buňku a druhou nejčastěji snímající molekuly uvnitř buňky. Oba systémy smysl vetřelce a reagovat aktivací antimikrobiální obrany v infikované buňce a sousedních buňkách. V některých případech se signály aktivující obranu rozšířily do zbytku rostliny nebo dokonce do sousedních rostlin. Tyto dva systémy detekují různé typy molekul patogenu a třídy proteinů rostlinných receptorů.[5][6]
První úroveň se primárně řídí receptory rozpoznávání vzoru které se aktivují rozpoznáním evolučně konzervovaných patogenní nebo mikrobiálně spojené molekulární vzorce (PAMP nebo MAMP). Aktivace PRR vede k intracelulární signalizaci, transkripčnímu přeprogramování a biosyntéze komplexní výstupní reakce, která omezuje kolonizaci. Systém je znám jako PAMP-Triggered Immunity nebo jako Pattern-Triggered Immunity (PTI).[6][7]
Druhá vrstva, primárně řízena R gen se často označuje jako efektorem vyvolaná imunita (ETI). ETI se typicky aktivuje přítomností „efektorů“ specifického patogenu a poté spouští silné antimikrobiální reakce (viz část R gen níže).
Kromě PTI a ETI lze obranyschopnost rostlin aktivovat snímáním sloučenin souvisejících s poškozením (DAMP), jako jsou části buněčné stěny rostlin uvolněné během patogenní infekce.
Mezi odpovědi aktivované receptory PTI a ETI patří iontový kanál vrata, oxidační výbuch, buněčný redox změny, nebo protein kináza kaskády, které přímo aktivují buněčné změny (například vyztužení buněčné stěny nebo produkci antimikrobiálních látek) nebo aktivují změny v genová exprese které pak pozvednou další obranné reakce
Imunitní systémy rostlin vykazují určité mechanické podobnosti s imunitní systémy hmyzu a savců, ale také vykazují mnoho vlastností specifických pro rostliny.[8] Dvě výše popsané úrovně jsou pro imunitu rostlin ústřední, ale plně nepopisují imunitní systémy rostlin. Mnoho konkrétních příkladů zjevných PTI nebo ETI navíc porušuje běžné definice PTI / ETI, což naznačuje potřebu rozšířených definic a / nebo paradigmat.[9]
Imunita vyvolaná vzorem
PAMP, konzervované molekuly, které obývají více patogenů rody, jsou mnoha výzkumníky označovány jako MAMP. Obrany vyvolané vnímáním MAMP jsou dostatečné k odpuzování většiny patogenů. Efektorové proteiny patogenu (viz níže) jsou však přizpůsobeny k potlačení bazální obrany, jako je PTI. Bylo objeveno mnoho receptorů pro MAMP (a DAMP). MAMP a DAMP jsou často detekovány transmembránovými receptorovými kinázami, které přenášejí LRR nebo LysM extracelulární domény.[5]
Imunita vyvolaná efektorem
Effector Triggered Immunity (ETI) se aktivuje přítomností patogenních efektorů. Odezva ETI závisí na R geny, a je aktivován specifickými kmeny patogenů. ETI rostlin často způsobuje apoptotický hypersenzitivní reakce.
R geny a R proteiny
Rostliny se vyvinuly R geny (geny rezistence), jejichž produkty zprostředkovávají rezistenci na konkrétní viry, bakterie, oomycety, houby, hlístice nebo kmeny hmyzu. Produkty R genu jsou proteiny, které umožňují rozpoznání specifických patogenních efektorů, a to buď přímou vazbou, nebo rozpoznáním změny efektoru hostitelského proteinu.[6] Mnoho genů R kóduje proteiny NB-LRR (proteiny s vazba nukleotidů a opakování bohaté na leucin domény, známé také jako NLR proteiny nebo STAND proteiny, mimo jiné). Většina rostlinných imunitních systémů nese repertoár 100-600 různých homologů genů R. Bylo prokázáno, že jednotlivé R geny zprostředkovávají rezistenci na konkrétní viry, bakterie, oomycete, houby, hlístice nebo kmeny hmyzu. Produkty R genu kontrolují širokou škálu reakcí rezistence na choroby, jejichž indukce je často dostatečná k zastavení dalšího růstu / šíření patogenů.
Studované R geny obvykle propůjčují specificitu pro konkrétní kmeny druhů patogenů (ty, které exprimují rozpoznaný efektor). Jak nejprve poznamenal Harold Flor v jeho formulaci z poloviny 20. století vztah gen-pro-gen, rostlinný gen R má specificitu pro gen avirulence patogenu (gen Avr). Nyní je známo, že geny avirulence kódují efektory. Gen Avr patogenu musí mít shodnou specificitu s genem R pro tento gen R, aby propůjčil rezistenci, což naznačuje receptor /ligand interakce pro geny Avr a R.[8] Alternativně může efektor modifikovat svůj hostitelský buněčný cíl (nebo molekulární návnadu tohoto cíle) a produkt genu R (protein NLR) aktivuje obranu, když detekuje modifikovanou formu hostitelského cíle nebo návnady.[6]
Efektorová biologie
Efektory jsou ústřední pro patogenní nebo symbiotický potenciál mikrobů a mikroskopických rostlin kolonizujících živočichů, jako jsou hlístice.[10][11][12] Efektory jsou typicky proteiny, které jsou dodávány mimo mikrob a do hostitelské buňky. Tyto efektory odvozené od kolonistů manipulují s buněčnou fyziologií a vývojem hostitele. Jako takové nabízejí efektory příklady společné evoluce (příklad: fungální protein, který funguje mimo houbu, ale uvnitř rostlinných buněk se vyvinul, aby převzal funkce specifické pro rostliny). Rozsah hostitele patogenu je mimo jiné určen přítomností vhodných efektorů, které umožňují kolonizaci konkrétního hostitele.[5] Efektory odvozené od patogenu jsou mocným nástrojem k identifikaci funkcí rostlin, které hrají klíčovou roli v nemoci a v odolnosti vůči chorobám. Zdá se, že většina efektorů funguje tak, že manipuluje fyziologii hostitele, aby umožnila výskyt nemoci. Dobře prostudované bakteriální rostlinné patogeny obvykle exprimují několik desítek efektorů, které jsou často do hostitele dodávány a Sekrece typu III zařízení.[10] Plísňové, oomycetové a nematodové rostlinné patogeny zjevně exprimují několik stovek efektorů.[11][12]
Takzvané „základní“ efektory jsou operativně definovány jejich širokou distribucí v populaci konkrétního patogenu a jejich podstatným příspěvkem k virulenci patogenu. Genomika může být použita k identifikaci základních efektorů, které pak mohou být použity k objevení nového R genu alely, které lze použít při šlechtění rostlin pro odolnost vůči chorobám.
Malé RNA a interference RNA
Dráhy rostlinné sRNA se chápou jako důležité složky imunity spouštěné s patogeny (PAMP) (PAMP) a imunity spouštěné efektorem (ETI).[13][14] Bakteriemi indukované miRNA v Arabidopsis Bylo prokázáno, že ovlivňují hormonální signalizaci, včetně auxinu, kyseliny abscisové (ABA), kyseliny jasmonové (JA) a kyseliny salicylové (SA).[15][16] Pokroky v celogenomových studiích odhalily masivní přizpůsobení vzorců exprese miRNA hostitele po infekci houbovými patogeny Fusarium virguliforme, [17] Erysiphe graminis,[18] Verticillium dahliae,[19] a Cronartium quercuum,[20] a oomycete Phytophthora sojae.[21] Změny exprese sRNA v reakci na houbové patogeny naznačují, že v této obranné cestě může být zahrnuto umlčení genu. Existují však také důkazy, že antimykotická obranná reakce na Colletotrichum spp. infekce u kukuřice není zcela regulována specifickou indukcí miRNA, ale může místo toho působit k vyladění rovnováhy mezi genetickými a metabolickými složkami po infekci.[Citace je zapotřebí ]
Transport sRNA během infekce pravděpodobně usnadňují extracelulární vezikuly (EV) a multivezikulární tělíska (MVB).[22] Složení RNA v rostlinných EV nebylo plně hodnoceno, ale je pravděpodobné, že jsou částečně odpovědné za obchodování s RNA. Rostliny mohou systémově přenášet virové RNA, mRNA, mikroRNA (miRNA) a malé interferující RNA (siRNA) prostřednictvím floému.[23] Předpokládá se, že tento proces probíhá přes plasmodesmata a zahrnuje proteiny vázající RNA, které pomáhají lokalizovat RNA v buňkách mezofylu. Ačkoli byly identifikovány ve floému pomocí mRNA, neexistují žádné přesvědčivé důkazy o tom, že zprostředkovávají dálkový transport RNA.[24] EV proto mohou přispívat k alternativní dráze zavádění RNA do floému nebo mohou případně transportovat RNA apoplastem.[25] Existují také důkazy, že rostlinné EV mohou umožňovat mezidruhový přenos sRNA interferencí RNA, jako je HIGS (Host-Induced Gene Silencing).[26][27] Transport RNA mezi rostlinami a houbami se zdá být obousměrný jako sRNA z fungálního patogenu Botrytis cinerea Bylo prokázáno, že cílí na obranné geny hostitele u Arabidopsis a Tomato.[28]
Odolnost na úrovni druhů
V malém počtu případů jsou rostlinné geny účinné proti celému druhu patogenu, i když druh, který je patogenní pro jiné genotypy daného hostitelského druhu. Mezi příklady patří ječmen MLO proti padlí, pšenice Lr34 proti rez listí a pšenice Yr36 proti rez pšeničným pruhem. Může existovat řada mechanismů pro tento typ rezistence v závislosti na konkrétní kombinaci genu a rostlinného patogenu. Mezi další důvody účinné imunity rostlin patří nedostatek společná adaptace (patogen a / nebo rostlina postrádají více mechanismů potřebných pro kolonizaci a růst v tomto hostitelském druhu) nebo obzvláště účinná sada předem vytvořených obranných prostředků.[Citace je zapotřebí ]
Signalizační mechanismy
Vnímání přítomnosti patogenu
Signalizace obrany rostlin je aktivována receptory detekujícími patogeny, které jsou popsány ve výše uvedené části.[5] Aktivované receptory často vyvolávají reaktivní kyslík a oxid dusnatý Výroba, vápník, draslík a proton iontové toky, změněné úrovně kyselina salicylová a další hormony a aktivace MAP kinázy a další konkrétní proteinové kinázy.[8] Tyto události zase obvykle vedou k modifikaci proteinů, které kontrolují genová transkripce, a aktivace obranné genová exprese.[7]
Transkripční faktory a hormonální odpověď
Bylo identifikováno mnoho genů a / nebo proteinů, jakož i dalších molekul, které zprostředkovávají transdukci signálu obrany rostlin.[29][30] Cytoskelet a váček dynamika obchodování pomáhá orientovat reakce obrany rostlin směrem k bodu napadení patogeny.
Mechanismy transkripčních faktorů a hormonů
Aktivita imunitního systému rostlin je částečně regulována signalizačními hormony, jako jsou:[31][32]
Mezi těmito cestami může docházet k podstatným rozhovorům.[31]
Regulace degradací
Stejně jako u mnoha signálních transdukčních drah může být exprese rostlinného genu během imunitních odpovědí regulována degradací. K tomu často dochází, když se stimuluje vazba hormonů na hormonální receptory ubikvitin - související degradace represorových proteinů, které blokují expresi určitých genů. Čistým výsledkem je hormonálně aktivovaná genová exprese. Příklady:[33]
- Auxin: váže se na receptory, které pak získávají a degradují represory transkripčních aktivátorů, které stimulují expresi genů specifických pro auxin.
- Kyselina jasmonová: podobná auxinu, s výjimkou jasmonátových receptorů ovlivňujících signalizační mediátory jasmonátové odezvy, jako jsou proteiny JAZ.
- Kyselina giberelová: Gibberellin způsobuje recepční konformační změny a vazbu a degradaci Della proteiny.
- Ethylen: Inhibiční fosforylace aktivátoru odezvy na ethylen EIN2 je blokována vazbou ethylenu. Když tohle fosforylace je snížen, protein EIN2 je štěpen a část proteinu se přesune do jádra, aby aktivovala expresi genu pro reakci ethylenu.
Signalizace ubikvitinu a E3
Ubikvitinace hraje ústřední roli v buněčné signalizaci, která reguluje procesy včetně degradace proteinů a imunologické odpovědi.[34] Ačkoli jednou z hlavních funkcí ubikvitinu je cílit proteiny na destrukci, je také užitečný při signálních drahách, uvolňování hormonů, apoptóze a translokaci materiálů v celé buňce. Ubikvitinace je součástí několika imunitních odpovědí. Bez správného fungování ubikvitinu by se invaze patogenů a dalších škodlivých molekul dramaticky zvýšila kvůli oslabené imunitní obraně.[34]
Signalizace E3
E3 Ubikvitin ligáza Enzym je hlavní složkou, která poskytuje specificitu v degradačních drahách proteinů, včetně imunitních signálních drah.[33] Složky enzymu E3 lze seskupit podle toho, které domény obsahují, a zahrnují několik typů.[35] Patří mezi ně jednoduchá podjednotka Ring a U-box, HECT a CRL.[36][37] Signální dráhy rostlin včetně imunitních odpovědí jsou řízeny několika cestami zpětné vazby, které často zahrnují negativní zpětnou vazbu; a mohou být regulovány de-ubikvitinačními enzymy, degradací transkripčních faktorů a degradací negativních regulátorů transkripce.[33][38]
Šlechtění rostlin pro odolnost vůči chorobám
Šlechtitelé rostlin zdůrazňují výběr a vývoj rostlinných linií odolných vůči chorobám. Choroby rostlin lze také částečně potlačit použitím pesticidy a kultivačními postupy, jako je střídání plodin, zpracování půdy, hustota výsadby, semena bez chorob a čištění zařízení, ale obecně se upřednostňují odrůdy rostlin s vlastní (geneticky podmíněnou) odolností vůči chorobám.[2] Šlechtění na odolnost vůči chorobám začalo, když byly rostliny poprvé domestikovány. Chovatelské úsilí pokračuje, protože populace patogenů jsou pod selekční tlak kvůli zvýšené virulenci se objevují nové patogeny, vývoj kultivačních postupů a změna klimatu mohou snížit rezistenci a / nebo posílit patogeny a šlechtění rostlin pro jiné vlastnosti může narušit předchozí rezistenci.[39] Rostlinná linie s přijatelnou rezistencí proti jednomu patogenu může postrádat rezistenci vůči ostatním.
Chov rezistence obvykle zahrnuje:
- Identifikace rostlin, které mohou být méně žádoucí jinými způsoby, ale které nesou užitečnou vlastnost odolnosti vůči chorobám, včetně divokých rostlinných linií, které často vyjadřují zvýšenou odolnost.
- Křížení žádoucí odrůdy náchylné k chorobám na rostlinu, která je zdrojem rezistence.
- Růst chovných kandidátů v prostředí příznivém pro onemocnění, případně včetně inokulace patogenů. Je třeba věnovat pozornost konkrétním izolátům patogenů, aby se vyřešila variabilita v rámci jednoho druhu patogenu.
- Výběr jedinců odolných vůči chorobám, kteří si zachovají další žádoucí vlastnosti, jako je výnos, kvalita a zahrnující další vlastnosti odolné vůči chorobám.[39]
Odpor se nazývá odolný pokud bude i nadále efektivní po několik let rozšířeného používání s vývojem populací patogenů. "Svislý odpor „je specifický pro určité rasy nebo kmeny druhů patogenů, je často ovládán jedincem R geny a může být méně odolný. Horizontální nebo širokospektrální odpor proti celému druhu patogenu je často jen neúplně efektivní, ale odolnější a je často řízen mnoha geny, které se v chovných populacích segregují.[2]
Plodiny, jako jsou brambory, jablka, banány a cukrová třtina, se často množí vegetativní reprodukce zachovat vysoce žádoucí odrůdy rostlin, protože u těchto druhů křížení vážně narušuje preferované vlastnosti. Viz také nepohlavní šíření. Vegetativně vypěstované plodiny mohou být jedním z nejlepších cílů pro zlepšení rezistence u biotechnologie způsob rostlin proměna řídit geny, které ovlivňují odolnost vůči chorobám.[1]
Vědecké šlechtění na odolnost vůči chorobám vzniklo u sira Rowland Biffen, který identifikoval jediný recesivní gen pro rezistenci vůči pšeničné žluté rzi. Téměř každá plodina byla poté vyšlechtěna tak, aby zahrnovala geny rezistence vůči chorobám (R), mnohé introgrese od kompatibilních divokých příbuzných.[1]
Rezistence na GM nebo transgenní inženýrství
Pojem GM ("geneticky modifikovaný" ) se často používá jako synonymum transgenní označovat rostliny modifikované pomocí technologií rekombinantní DNA. Rostliny s odolností vůči transgenním / GM chorobám proti hmyzem škůdcům byly mimořádně úspěšné jako komerční produkty, zejména u kukuřice a bavlny, a jsou každoročně vysazovány na více než 20 milionech hektarů ve více než 20 zemích světa[40] (viz také geneticky modifikované plodiny ). Odolnost transgenních chorob rostlin proti mikrobiálním patogenům byla poprvé prokázána v roce 1986. Exprese virový plášť sekvence genového proteinu poskytly virovou rezistenci prostřednictvím malé RNA. To se ukázalo jako široce použitelný mechanismus pro inhibici replikace viru.[41] Vědci vyvinuli kombinaci genů obalového proteinu ze tří různých virů squash hybridy s polem ověřenou multivirovou rezistencí. Podobného stupně rezistence na tuto rozmanitost virů nebylo dosaženo konvenčním šlechtěním.
Podobná strategie byla nasazena do boje virus papáje ringspot, který do roku 1994 hrozil zničením Havaj Je papája průmysl. Polní pokusy prokázaly vynikající účinnost a vysokou kvalitu ovoce. Do roku 1998 byla schválena k prodeji první papája rezistentní na viry. Odolnost vůči chorobám trvá déle než 15 let. Transgenní papája tvoří ~ 85% havajské produkce. Ovoce je schváleno k prodeji v USA, Kanadě a Japonsku.
Bramborové linie exprimující sekvence virových replikáz, které propůjčují rezistenci na virus bramborových listů, byly prodávány pod obchodními názvy NewLeaf Y a NewLeaf Plus a v komerční produkci byly široce přijímány v letech 1999-2001, dokud se McDonald's Corp. nerozhodla nekupovat GM brambory a Monsanto se rozhodlo aby ukončili činnost v oboru brambor NatureMark.[42] Brambory NewLeaf Y a NewLeaf Plus měly dva znaky GM, protože také vyjadřovaly rezistenci zprostředkovanou Bt vůči bramborovému bramboru Colorado.
Do roku 2013 se na trh nedostala žádná jiná plodina s vytvořenou odolností proti chorobám proti mikrobiálním patogenům, ačkoli více než tucet bylo v určitém stavu vývoje a testování.
| Rok vydání | Oříznutí | Odolnost vůči chorobám | Mechanismus | Stav vývoje |
|---|---|---|---|---|
| 2012 | Rajče | Bakteriální skvrna | R gen z pepře | 8 let polní zkoušky |
| 2012 | Rýže | Bakteriální plíseň a bakteriální pruh | Upravený gen E. | Laboratoř |
| 2012 | Pšenice | Padlí | Nadměrně exprimovaný gen R z pšenice | 2 roky polních pokusů v době vydání |
| 2011 | Jablko | strupovitost jabloně houba | Thionin gen z ječmen | 4 roky polních pokusů v době vydání |
| 2011 | Brambor | Virus brambor Y | Rezistence odvozená od patogenu | 1 rok polní zkoušky v době vydání |
| 2010 | Jablko | Plíseň ohně | Antibakteriální protein z mol | 12 let polních pokusů v době vydání |
| 2010 | Rajče | Multibakteriální rezistence | PRR od Arabidopsis | Laboratorní váha |
| 2010 | Banán | Xanthomonas vadne | Nový gen z pepře | Nyní v polní zkoušce |
| 2009 | Brambor | Pozdní plíseň | R geny od divokých příbuzných | 3 roky polních zkoušek |
| 2009 | Brambor | Pozdní plíseň | R gen od divokého příbuzného | 2 roky polních pokusů v době vydání |
| 2008 | Brambor | Pozdní plíseň | R gen z divokého příbuzného | 2 roky polních pokusů v době vydání |
| 2008 | Švestka | Virus neštovic | Rezistence odvozená od patogenu | Regulační schválení, žádné komerční prodeje |
| 2005 | Rýže | Bakteriální pruh | Gen R z kukuřice | Laboratoř |
| 2002 | Ječmen | Rez stonek | Gen klidové lymfocyty kinázy (RLK) z kultivaru rezistentního ječmene | Laboratoř |
| 1997 | Papája | Virus ring spot | Rezistence odvozená od patogenu | Schváleno a komerčně prodáváno od roku 1998, do Japonska prodáváno od roku 2012 |
| 1995 | Squash | Tři mozaikové viry | Rezistence odvozená od patogenu | Schváleno a komerčně prodáváno od roku 1994 |
| 1993 | Brambor | Virus brambor X | Savčí enzym indukovaný interferonem | 3 roky polních pokusů v době vydání |
Přenos PRR
Výzkum zaměřený na inženýrský odpor sleduje několik strategií. Jedním z nich je přenos užitečných PRR na druhy, které je nemají. Identifikace funkčních PRR a jejich přenos na příjemce, kterému chybí ortologický receptor, by mohla poskytnout obecnou cestu k dalším rozšířeným repertoárům PRR. Například Arabidopsis PRR EF-Tu receptor (EFR) rozpoznává bakteriální faktor prodloužení překladu EF-Tu. Výzkum prováděný v Sainsbury Laboratory demonstroval, že zavedení EFR do obou Nicotiana benthamiana nebo Solanum lycopersicum (rajče), který nemůže rozpoznat EF-Tu, poskytla rezistenci vůči širokému spektru bakteriálních patogenů. Exprese EFR v rajčatech byla obzvláště účinná proti rozšířené a ničivé půdní bakterii Ralstonia solanacearum.[43] Naopak, rajče PRR Verticillium 1 (Ve1) gen lze přenést z rajčete na Arabidopsis, kde uděluje odpor závodu 1 Verticillium izoláty.[1]
Stohování
Druhá strategie se pokouší nasadit více genů NLR současně, šlechtitelská strategie známá jako stohování. Kultivary generované pomocí DNA molekulární chov nebo genový přenos pravděpodobně bude mít trvalejší odolnost, protože patogeny by musely mutovat více efektorových genů. Sekvenování DNA umožňuje vědcům funkčně „těžit“ geny NLR z více druhů / kmenů.[1]
The avrBs2 efektorový gen z Xanthomona perforans je původcem bakteriální skvrnité nemoci pepře a rajčat. První „efektorově racionalizované“ hledání potenciálně odolného R genu následovalo po zjištění avrBs2 se vyskytuje ve většině způsobujících nemoci Xanthomonas druh a je vyžadován pro zdatnost patogenů. The Bs2 Gen NLR z divokého pepře, Capsicum chacoense, byl přesunut do rajčete, kde inhiboval růst patogenů. Polní pokusy prokázaly robustní odolnost bez baktericidních chemikálií. Nicméně, vzácné kmeny Xanthomonas překonal Bs2-zprostředkovaný odpor u pepře získáním avrBs2 mutace, které se vyhýbají rozpoznání, ale zachovávají si virulenci Stohování R genů, které každý rozpoznává jiný základní efektor, by mohlo oddálit nebo zabránit adaptaci.[1]
Více než 50 lokusů v kmenech pšenice propůjčuje odolnost vůči chorobám proti patogenům rodu pšenice, listů a žlutého pruhu. Kmen rez 35 (Sr35) NLR gen, klonovaný z diploidního příbuzného pěstované pšenice, Triticum monococcum, poskytuje odolnost vůči pšeničné rezavé izolaci Ug99. Podobně, Sr33, od příbuzného pšenice Aegilops tauschii, kóduje ortolog pšenice na ječmen Mla geny odolné proti padlí. Oba geny jsou u pšenice a jejích příbuzných neobvyklé. V kombinaci s Sr2 gen, který působí aditivně s alespoň Sr33, by mohly poskytnout trvalou odolnost vůči chorobám Ug99 a jeho deriváty.[1]
Exekutorské geny
Další třída genů odolnosti vůči chorobám rostlin otevírá „pasti“, které rychle zabíjejí napadené buňky a zastavují množení patogenů. Xanthomonas a Ralstonia transkripční aktivátor –Faktory podobné (TAL) jsou proteiny vázající DNA, které aktivují expresi hostitelského genu za účelem zvýšení virulence patogenu. U rýžové i pepřové linie se nezávisle vyvinula vazebná místa TAL-efektor, která místo toho fungují jako popravčí, který indukuje hypersenzitivní smrt hostitelských buněk, když je up-regulován. Xa27 z rýže a Bs3 a Bs4c z pepře, jsou takové „prováděcí“ (nebo „prováděcí“) geny, které kódují nehomologní rostlinné proteiny neznámé funkce. Exekutorské geny jsou exprimovány pouze v přítomnosti specifického TAL efektoru.[1]
Inženýrské prováděcí geny byly demonstrovány úspěšným redesignem pepře Bs3 promotor obsahující dvě další vazebná místa pro TAL efektory z různorodých kmenů patogenů. Následně byl do rýže zaveden inženýrsky prováděný gen přidáním pěti TAL efektorových vazebných míst k Xa27 promotér. Syntetický Xa27 konstrukt poskytl rezistenci proti bakteriální plísni Xanthomonas a druhům bakteriálních pruhů listů.[1]
Alely náchylnosti k hostiteli
Většina rostlinných patogenů přeprogramuje vzorce exprese hostitelského genu tak, aby měly přímý prospěch pro patogen. Přeprogramované geny potřebné k přežití a šíření patogenů lze považovat za „geny náchylné k chorobám“. Geny pro recesivní rezistenci jsou kandidáty na náchylnost k chorobám. Například mutace deaktivovala Arabidopsis kódování genů pektát lyáza (podílí se na degradaci buněčné stěny), což propůjčuje rezistenci patogenu padlí Golovinomyces cichoracearum. Podobně ječmen MLO gen a spontánně mutovaný hrášek a rajče MLO ortology také udělují odolnost proti padlí.[1]
Lr34 je gen, který poskytuje částečnou odolnost vůči listovým a žlutým rezům a padlí v pšenici. Lr34 kóduje adenosintrifosfát (ATP) - transportér vázací kazety (ABC). Dominantní alela, která poskytuje odolnost vůči chorobám, byla nedávno nalezena u kultivované pšenice (nikoli u divokých kmenů) a podobně MLO poskytuje širokospektrální rezistenci u ječmene.[1]
Přirozené alely iniciačních faktorů prodlužování translace hostitele eif4e a eif4g jsou také recesivní geny virové rezistence. Některé byly nasazeny k ovládání potyviry v ječmeni, rýži, rajčatech, pepři, hrášku, salátu a melounu. Objev vedl k úspěšnému screeningu mutantů na chemicky indukované eif4e alely v rajčatech.[1]
Přirozená variace promotoru může vést k vývoji recesivních alel odolných vůči chorobám. Například gen recesivní rezistence xa13 v rýži je alela Os-8N3. Os-8N3 je transkripčně aktivovánXanthomonas oryzae pv. oryzae kmeny, které exprimují TAL efektor PthXo1. The xa13 Gen má ve svém promotoru mutovaný prvek vázající efektor, který eliminuje PthXo1 vazba a činí tyto řádky odolnými vůči kmenům, na které se spoléhají PthXo1. Toto zjištění to také prokázalo Os-8N3 je vyžadován pro citlivost.[1]
Pro vývoj pylu je zapotřebí Xa13 / Os-8N3, což ukazuje, že takové mutantní alely mohou být problematické, pokud by fenotyp náchylnosti k chorobám změnil funkci v jiných procesech. Mutace v Os11N3 (OsSWEET14) TAL prvek vázající efektor byl vyroben fúzí TAL efektorů s nukleázami (TALEN ). Rostliny rýže upravené genomem se změnami Os11N3 vazebná místa zůstala rezistentní vůči Xanthomonas oryzae pv. oryzae, ale stále poskytuje normální vývojovou funkci.[1]
Umlčení genů
Umlčení RNA rezistence založená na odolnosti je mocný nástroj pro konstrukci odolných plodin. Výhoda RNAi jako nové genové terapie proti houbové, virové a bakteriální infekci v rostlinách spočívá ve skutečnosti, že reguluje genovou expresi prostřednictvím messenger RNA degradace, represe překladu a chromatin remodelace prostřednictvím malých nekódujících RNA. Mechanicky jsou procesy umlčování vedeny zpracováním produktů dvouvláknové RNA (dsRNA ) spoušť, které jsou známé jako malé interferující RNA a mikroRNA.[44]
Rozsah hostitelů
Z tisíců druhů rostlinných patogenních mikroorganismů má pouze malá menšina schopnost infikovat širokou škálu rostlinných druhů. Většina patogenů místo toho vykazuje vysoký stupeň specificity pro hostitele. O hostitelských druzích rostlin se často říká, že se vyjadřují nehostitelský odpor. Termín odpor hostitele se používá, když druh patogenu může být patogenní na hostitelském druhu, ale určité kmeny tohoto rostlinného druhu odolávají určitým kmenům druhu patogenu. Příčiny odporu hostitele a odporu jiného hostitele se mohou překrývat. Rozsah hostitele patogenu je mimo jiné určen přítomností vhodných efektorů, které umožňují kolonizaci konkrétního hostitele.[5] Rozsah hostitele patogenu se může zcela náhle změnit, pokud je například schopnost patogenu syntetizovat toxin nebo efektor specifický pro hostitele získána přeskupováním / mutací genů nebo horizontální přenos genů.[45][46]
Epidemie a populační biologie
Nativní populace jsou často charakterizovány podstatnou rozmanitostí genotypů a rozptýlenými populacemi (růst ve směsi s mnoha jinými druhy rostlin). Také prošli rostlinným patogenem koevoluce. Dokud se tedy nové patogeny nezavádějí / nevyvíjejí, tyto populace obecně vykazují pouze nízký výskyt závažných onemocnění epidemie.[47]
Monokropové zemědělské systémy poskytují ideální prostředí pro vývoj patogenů, protože nabízejí vysokou hustotu cílových vzorků s podobnými / identickými genotypy.[47] Nárůst mobility vyplývající z moderních dopravních systémů poskytuje patogenům přístup k více potenciálním cílům.[47] Změna klimatu může změnit životaschopný geografický rozsah druhů patogenů a způsobit, že se některá onemocnění stanou problémem v oblastech, kde byla dříve nemoc méně důležitá.[47]
Díky těmto faktorům je moderní zemědělství náchylnější k epidemii chorob. Mezi běžná řešení patří neustálé šlechtění na odolnost vůči chorobám, používání pesticidů, používání hraničních kontrol a dovozních omezení rostlin, udržování významné genetické rozmanitosti v genofondu plodin (viz rozmanitost plodin ) a neustálý dohled za účelem urychlení zahájení vhodných odpovědí. Některé druhy patogenů mají mnohem větší schopnost překonávat odolnost vůči chorobám rostlin než jiné, často kvůli své schopnosti rychle se vyvíjet a široce se šířit.[47]
Viz také
- Odolnost vůči chorobám u ovoce a zeleniny
- Vztah gen pro gen
- Obrana rostlin proti bylinožravcům
- Patologie rostlin
- Rostlinné využití endofytických hub při obraně
- Systémová získaná rezistence
- Indukovaná systémová rezistence
Reference
Poznámky
- ^ A b C d E F G h i j k l m n Ó p Dangl, J. L .; Horvath, D. M .; Staskawicz, B. J. (2013). „Otočení imunitního systému rostlin od disekce k nasazení“. Věda. 341 (6147): 746–751. Bibcode:2013Sci ... 341..746D. doi:10.1126 / science.1236011. PMC 3869199. PMID 23950531.
- ^ A b C Agrios, George N. (2005). Plant Pathology, páté vydání. Akademický tisk. ISBN 978-0120445653.
- ^ Lutz, Diana (2012). Byla odhalena klíčová část systému rychlé reakce rostlin. Washingtonská univerzita v St. Louis.
- ^ A b Dadáková, K .; Havelkova, M .; Kurkova, B .; Tlolkova, I .; Kasparovsky, T .; Zdrahal, Z .; Lochman, J. (2015-04-24). "Proteomová a přepisová analýza buněčných kultur Vitis vinifera vystavených infekci Botrytis cinerea". Journal of Proteomics. 119: 143–153. doi:10.1016 / j.jprot.2015.02.001. PMID 25688916.
- ^ A b C d E Dodds, P. N .; Rathjen, J. P. (2010). „Imunita rostlin: Směrem k integrovanému pohledu na interakce rostlin a patogenů“. Genetika hodnocení přírody. 11 (8): 539–548. doi:10.1038 / nrg2812. PMID 20585331. S2CID 8989912.
- ^ A b C d Jones, J. D .; Dangl, J.L. (2006). „Imunitní systém rostlin“. Příroda. 444 (7117): 323–329. Bibcode:2006 Natur.444..323J. doi:10.1038 / nature05286. PMID 17108957.
- ^ A b Li, B .; Meng, X .; Shan, L .; On, P. (2016). „Regulace transkripce imunity vyvolané vzorem u rostlin“. Buněčný hostitelský mikrob. 19 (5): 641–650. doi:10.1016 / j.chom.2016.04.011. PMC 5049704. PMID 27173932.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C Nurnberger, T .; Brunner, F., Kemmerling, B. a Piater, L .; Kemmerling, B; Piater, L (2004). „Vrozená imunita u rostlin a zvířat: nápadné podobnosti a zjevné rozdíly“. Imunologické recenze. 198: 249–266. doi:10.1111 / j.0105-2896.2004.0119.x. PMID 15199967. S2CID 32547933.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Thomma, B .; Nurnberger, T .; Joosten, M. (2011). „Of PAMPs and Effects: The Blurred PTI-ETI Dichotomy“. Rostlinná buňka. 23 (4): 4–15. doi:10.1105 / tpc.110.082602. PMC 3051239. PMID 21278123.
- ^ A b Lindeberg, M; Cunnac S, Collmer A (2012). "Pseudomonas syringae type III effector repertoires: last words in endless arguments". Trends Microbiol. 20 (4): 199–208. doi:10.1016/j.tim.2012.01.003. PMID 22341410.
- ^ A b Rafiqi, M; Ellis JG, Ludowici VA, Hardham AR, Dodds PN (2012). "Challenges and progress towards understanding the role of effectors in plant-fungal interactions". Curr Opin Plant Biol. 15 (4): 477–482. doi:10.1016/j.pbi.2012.05.003. PMID 22658704.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Hewezi, T; Baum T (2013). "Manipulation of plant cells by cyst and root-knot nematode effectors". Mol Plant Microbe Interact. 26 (1): 9–16. doi:10.1094/MPMI-05-12-0106-FI. PMID 22809272.
- ^ Jin, Hailing (2008-07-11). "Endogenous small RNAs and antibacterial immunity in plants". FEBS Dopisy. 582 (18): 2679–2684. doi:10.1016/j.febslet.2008.06.053. ISSN 0014-5793. PMC 5912937. PMID 18619960.
- ^ Padmanabhan, Chellappan; Zhang, Xiaoming; Jin, Hailing (August 2009). "Host small RNAs are big contributors to plant innate immunity". Aktuální názor na biologii rostlin. 12 (4): 465–472. doi:10.1016/j.pbi.2009.06.005. ISSN 1369-5266. PMID 19608454.
- ^ Zhang, Weixiong; Gao, Shang; Zhou, Xiang; Chellappan, Padmanabhan; Chen, Zheng; Zhou, Xuefeng; Zhang, Xiaoming; Fromuth, Nyssa; Coutino, Gabriela (2010-12-12). "Bacteria-responsive microRNAs regulate plant innate immunity by modulating plant hormone networks". Molekulární biologie rostlin. 75 (1–2): 93–105. doi:10.1007/s11103-010-9710-8. ISSN 0167-4412. PMC 3005105. PMID 21153682.
- ^ Boccara, Martine; Sarazin, Alexis; Thiébeauld, Odon; Jay, Florence; Voinnet, Olivier; Navarro, Lionel; Colot, Vincent (2014-01-16). "The Arabidopsis miR472-RDR6 Silencing Pathway Modulates PAMP- and Effector-Triggered Immunity through the Post-transcriptional Control of Disease Resistance Genes". PLOS patogeny. 10 (1): e1003883. doi:10.1371/journal.ppat.1003883. ISSN 1553-7374. PMC 3894208. PMID 24453975.
- ^ Radwan, Osman; Liu, Yu; Clough, Steven J. (August 2011). "Transcriptional Analysis of Soybean Root Response to Fusarium virguliforme, the Causal Agent of Sudden Death Syndrome". Molekulární interakce rostlin a mikrobů. 24 (8): 958–972. doi:10.1094/mpmi-11-10-0271. ISSN 0894-0282. PMID 21751852.
- ^ Xin, Mingming; Wang, Yu; Yao, Yingyin; Xie, Chaojie; Peng, Huiru; Ni, Zhongfu; Sun, Qixin (2010). "Diverse set of microRNAs are responsive to powdery mildew infection and heat stress in wheat (Triticum aestivum L.)". Biologie rostlin BMC. 10 (1): 123. doi:10.1186/1471-2229-10-123. ISSN 1471-2229. PMC 3095282. PMID 20573268.
- ^ Yin, Zujun; Li, Yan; Han, Xiulan; Shen, Fafu (2012-04-25). "Genome-Wide Profiling of miRNAs and Other Small Non-Coding RNAs in the Verticillium dahliae–Inoculated Cotton Roots". PLOS ONE. 7 (4): e35765. Bibcode:2012PLoSO...735765Y. doi:10.1371/journal.pone.0035765. ISSN 1932-6203. PMC 3338460. PMID 22558219.
- ^ Lu, Shanfa; Sun, Ying-Hsuan; Amerson, Henry; Chiang, Vincent L. (2007-08-07). "MicroRNAs in loblolly pine (Pinus taeda L.) and their association with fusiform rust gall development". The Plant Journal. 51 (6): 1077–1098. doi:10.1111/j.1365-313x.2007.03208.x. ISSN 0960-7412. PMID 17635765.
- ^ Guo, Na; Ye, Wen-Wu; Wu, Xiao-Ling; Shen, Dan-Yu; Wang, Yuan-Chao; Xing, Han; Dou, Dao-Long (November 2011). "Microarray profiling reveals microRNAs involving soybean resistance to Phytophthora sojae". Genom. 54 (11): 954–958. doi:10.1139/g11-050. ISSN 0831-2796. PMID 21995769.
- ^ Micali, Cristina O.; Neumann, Ulla; Grunewald, Dorit; Panstruga, Ralph; O'Connell, Richard (2010-10-28). "Biogenesis of a specialized plant-fungal interface during host cell internalization of Golovinomyces orontii haustoria". Cellular Microbiology. 13 (2): 210–226. doi:10.1111/j.1462-5822.2010.01530.x. ISSN 1462-5814. PMID 20880355. S2CID 39002035.
- ^ Kehr, J.; Buhtz, A. (2007-12-18). "Long distance transport and movement of RNA through the phloem". Journal of Experimental Botany. 59 (1): 85–92. doi:10.1093/jxb/erm176. ISSN 0022-0957. PMID 17905731.
- ^ Gómez, G.; Torres, H.; Pallás, V. (2004-11-29). "Identification of translocatable RNA-binding phloem proteins from melon, potential components of the long-distance RNA transport system". The Plant Journal. 41 (1): 107–116. doi:10.1111/j.1365-313x.2004.02278.x. ISSN 0960-7412. PMID 15610353.
- ^ Rutter, Brian D; Innes, Roger W (August 2018). "Extracellular vesicles as key mediators of plant–microbe interactions". Aktuální názor na biologii rostlin. 44: 16–22. doi:10.1016/j.pbi.2018.01.008. ISSN 1369-5266. PMID 29452903.
- ^ Ghag, Siddhesh B. (December 2017). "Host induced gene silencing, an emerging science to engineer crop resistance against harmful plant pathogens". Fyziologická a molekulární patologie rostlin. 100: 242–254. doi:10.1016/j.pmpp.2017.10.003. ISSN 0885-5765.
- ^ Nowara, Daniela; Gay, Alexandra; Lacomme, Christophe; Shaw, Jane; Ridout, Christopher; Douchkov, Dimitar; Hensel, Götz; Kumlehn, Jochen; Schweizer, Patrick (September 2010). "HIGS: Host-Induced Gene Silencing in the Obligate Biotrophic Fungal PathogenBlumeria graminis". Rostlinná buňka. 22 (9): 3130–3141. doi:10.1105/tpc.110.077040. ISSN 1040-4651. PMC 2965548. PMID 20884801.
- ^ Weiberg, Arne; Wang, Ming; Lin, Feng-Mao; Zhao, Hongwei; Zhang, Zhihong; Kaloshian, Isgouhi; Huang, Hsien-Da; Jin, Hailing (2013-10-03). "Fungal Small RNAs Suppress Plant Immunity by Hijacking Host RNA Interference Pathways". Věda. 342 (6154): 118–123. Bibcode:2013Sci...342..118W. doi:10.1126/science.1239705. ISSN 0036-8075. PMC 4096153. PMID 24092744.
- ^ Hammond-Kosack KE; Parker JE (Apr 2003). „Dešifrování komunikace rostlin a patogenů: nové perspektivy pro šlechtění molekulární rezistence“. Curr Opin Biotechnol. 14 (2): 177–193. doi:10.1016/s0958-1669(03)00035-1. PMID 12732319.
- ^ Dadakova, Katerina; Klempova, Jitka; Jendrisakova, Tereza; Lochman, Jan; Kasparovsky, Tomas (2013-12-01). "Elucidation of signaling molecules involved in ergosterol perception in tobacco". Fyziologie rostlin a biochemie. 73: 121–127. doi:10.1016/j.plaphy.2013.09.009. PMID 24095918.
- ^ A b Moore, J. W .; Loake, G. J.; Spoel, S. H. (12 August 2011). "Transcription Dynamics in Plant Immunity". Rostlinná buňka. 23 (8): 2809–2820. doi:10.1105/tpc.111.087346. PMC 3180793. PMID 21841124.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Bürger, Marco; Chory, Joanne (2019-08-14). "Stressed Out About Hormones: How Plants Orchestrate Immunity". Cell Host & Microbe. 26 (2): 163–172. doi:10.1016/j.chom.2019.07.006. ISSN 1934-6069. PMC 7228804. PMID 31415749.
- ^ A b C Sadanandom, Ari; Bailey, Mark; Ewan, Richard; Lee, Jack; Nelis, Stuart (1 October 2012). "The ubiquitin-proteasome system: central modifier of plant signalling". Nový fytolog. 196 (1): 13–28. doi:10.1111/j.1469-8137.2012.04266.x. PMID 22897362.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Trujillo, M; Shirasu, K (August 2010). "Ubiquitination in plant immunity". Aktuální názor na biologii rostlin. 13 (4): 402–8. doi:10.1016/j.pbi.2010.04.002. PMID 20471305.
- ^ Craig, A .; Ewan, R.; Mesmar, J.; Gudipati, V.; Sadanandom, A. (10 March 2009). "E3 ubiquitin ligases and plant innate immunity". Journal of Experimental Botany. 60 (4): 1123–1132. doi:10.1093/jxb/erp059. PMID 19276192.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Moon, J. (1 December 2004). "The Ubiquitin-Proteasome Pathway and Plant Development". Rostlinná buňka online. 16 (12): 3181–3195. doi:10.1105/tpc.104.161220. PMC 535867. PMID 15579807.
- ^ Trujillo, Marco; Shirasu, Ken (1 August 2010). "Ubiquitination in plant immunity". Aktuální názor na biologii rostlin. 13 (4): 402–408. doi:10.1016/j.pbi.2010.04.002. PMID 20471305.
- ^ Shirsekar, Gautam; Dai, Liangying; Hu, Yajun; Wang, Xuejun; Zeng, Lirong; Wang, Guo-Liang; Hu, Yajun; Wang, Xuejun; Zeng, Lirong; Wang, Guo-Liang (2010). "Role of Ubiquitination in Plant Innate Immunity and Pathogen Virulence". Journal of Plant Biology. 53 (1): 10–18. doi:10.1007/s12374-009-9087-x. S2CID 36185464.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Stuthman, DD; Leonard, KJ; Miller-Garvin, J (2007). "Breeding crops for durable resistance to disease". Pokroky v agronomii. 95: 319–367. doi:10.1016/S0065-2113(07)95004-X. ISBN 9780123741653.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Tabashnik, Bruce E .; Brevault, Thierry; Carriere, Yves (2013). "Insect resistance to Bt crops: lessons from the first billion acres". Přírodní biotechnologie. 31 (6): 510–521. doi:10.1038/nbt.2597. PMID 23752438. S2CID 205278530.
- ^ Kavanagh, T. A .; Spillane, C. (1995-02-01). "Strategies for engineering virus resistance in transgenic plants". Euphytica. 85 (1–3): 149–158. doi:10.1007/BF00023943. ISSN 0014-2336. S2CID 20940279.
- ^ Kaniewski, Wojciech K.; Thomas, Peter E. (2004). „Bramborový příběh“. AgBioForum. 7 (1&2): 41–46.
- ^ Lacombe et al., 2010 Interfamily transfer of a plant pattern-recognition receptor confers broad-spectrum bacterial resistance, Nature Biotech 28, 365–369
- ^ Karthikeyan, A.; Deivamani, M.; Shobhana, V. G.; Sudha, M.; Anandhan, T. (2013). "RNA interference: Evolutions and applications in plant disease management". Archiv fytopatologie a ochrany rostlin. 46 (12): 1430–1441. doi:10.1080/03235408.2013.769315. S2CID 85060938.
- ^ Bettgenhaeuser, J; Gilbert B, Ayliffe M, Moscou MJ (2014). "Nonhost resistance to rust pathogens - a continuation of continua". Front Plant Sci. 5: 664. doi:10.3389/fpls.2014.00664. PMC 4263244. PMID 25566270.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Restrepo, S; Tabima JF, Mideros MF, Grünwald NJ, Matute DR (2014). "Speciation in fungal and oomycete plant pathogens". Annu Rev Phytopathol. 52: 289–316. doi:10.1146/annurev-phyto-102313-050056. PMID 24906125.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E McDonald, B. A.; Linde, C (2002). "Pathogen population genetics, evolutionary potential, and durable resistance". Roční přehled fytopatologie. 40: 349–79. doi:10.1146/annurev.phyto.40.120501.101443. PMID 12147764. S2CID 23726106.
Další čtení
- Lucas, J.A., "Plant Defence." Chapter 9 in Plant Pathology and Plant Pathogens, 3rd ed. 1998 Blackwell Science. ISBN 0-632-03046-1
- Hammond-Kosack, K. and Jones, J.D.G. "Responses to plant pathogens." In: Buchanan, Gruissem and Jones, eds. Biochemistry and Molecular Biology of Plants, Second Edition. 2015. Wiley-Blackwell, Hoboken, NJ. ISBN 9780470714218
- Dodds, P.; Rathjen, J. (2010). "Plant immunity: towards an integrated view of plant–pathogen interactions". Genetika hodnocení přírody. 11 (8): 539–548. doi:10.1038/nrg2812. PMID 20585331. S2CID 8989912.
- Schumann, G. Plant Diseases: Their Biology and Social Impact. 1991 APS Press, St. Paul, MN. ISBN 0890541167
