Obnova fluorescence po fotobělení - Fluorescence recovery after photobleaching
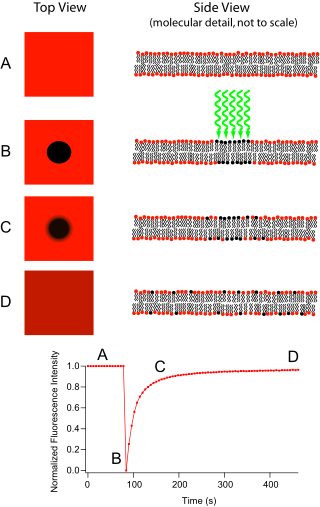
Obnova fluorescence po fotobělení (FRAP) je metoda pro stanovení kinetiky difúze tkání nebo buněk. Je schopen kvantifikovat dvourozměrnou boční difúzi molekulárně tenkého filmu obsahujícího fluorescenčně značené sondy nebo zkoumat jednotlivé buňky. Tato technika je velmi užitečná při biologických studiích buněčná membrána difúze a vazba na bílkoviny. Kromě toho povrchová depozice fluoreskující fosfolipid dvouvrstvá (nebo jednovrstvá) umožňuje charakterizaci hydrofilní (nebo hydrofobní ) povrchy z hlediska povrchové struktury a volné energie.
Podobné, i když méně známé techniky, byly vyvinuty pro zkoumání trojrozměrnosti difúze a vazba molekul uvnitř buňky; jsou také označovány jako FRAP.
Experimentální nastavení
Základní aparát obsahuje optický mikroskop, a zdroj světla a nějaký fluorescenční sonda. Fluorescenční emise je podmíněno absorpcí specifické optické vlnové délky nebo barvy, která omezuje výběr lamp. Nejčastěji široký spektrum rtuť nebo xenon zdroj se používá ve spojení s barevným filtrem. Tato technika začíná uložením obrázku na pozadí vzorku před fotobělením. Dále je světelný zdroj zaostřen na malou oblast viditelné oblasti buď přepnutím na objektiv mikroskopu s větším zvětšením, nebo pomocí laser světlo vhodné vlnové délky. Fluorofory v této oblasti dostávají osvětlení o vysoké intenzitě, což způsobí, že jejich fluorescenční životnost rychle uplyne (omezeno na zhruba 105 fotony před vyhynutím). Nyní je v mikroskopu obraz rovnoměrně fluorescenčního pole s nápadnou tmavou skvrnou. Jak postupuje Brownův pohyb, stále fluoreskující sondy budou difundovat po celém vzorku a nahradí nefluorescenční sondy v bělené oblasti. Tato difúze probíhá uspořádaným způsobem, analyticky určitelným z difúzní rovnice. Za předpokladu, že Gaussian profil pro bělící paprsek, difúzní konstanta D lze jednoduše vypočítat z:
kde w je poloměr paprsku a tD je „charakteristická“ doba difúze.[1][2]
Aplikace
Podporované lipidové dvojvrstvy
Technika FRAP byla původně určena k použití jako prostředek k charakterizaci mobility jednotlivých lipidových molekul v buněčné membráně.[1] Současný výzkum poskytuje velkou užitečnost v této roli a spíše se opírá o výzkum umělých lipidových membrán. Podporováno hydrofilními nebo hydrofobními substráty (k výrobě lipidových dvojvrstev nebo jednovrstvých vrstev) a začlenění membránové proteiny, tyto biomimetické struktury jsou potenciálně užitečné jako analytická zařízení pro stanovení identity neznámých látek, porozumění buněčné transdukci a identifikaci vazebných míst ligandu.
Vazba na bílkoviny
Tato technika se běžně používá ve spojení s zelený fluorescenční protein (GFP) fúzní proteiny, kde je studovaný protein fúzován s GFP. Při excitaci specifickou vlnovou délkou světla bude protein fluoreskovat.[3] Když je studovaný protein produkován pomocí GFP, lze sledovat fluorescenci. Fotodestrukcí GFP a následným sledováním repopulace do vybělené oblasti lze odhalit informace o partnerech interakce s proteiny, kontinuitě organel a obchodování s proteiny.[4]
Pokud po určité době fluorescence již nedosáhne počáteční úrovně, pak je určitá část fluorescence způsobena nepohyblivou frakcí (kterou nelze doplnit difúzí). Podobně, pokud se fluorescenční proteiny vážou na statické buněčné receptory, rychlost zotavení bude zpomalena faktorem souvisejícím s asociačními a disociačními koeficienty vazby. Toto pozorování bylo naposledy využito ke zkoumání vazby na proteiny.[3][5][6] Podobně, pokud je protein značený GFP konstitutivně začleněn do většího komplexu, bude dynamika obnovy fluorescence charakterizována difúzí většího komplexu.[7]
Aplikace mimo membránu
FRAP lze také použít ke sledování proteinů mimo membránu. Poté, co je požadovaný protein fluorescenční, obvykle expresí jako fúzní protein GFP, a konfokální mikroskop se používá k fotobělení a monitorování oblasti cytoplazma,[3] mitotické vřeteno, jádro nebo jiná buněčná struktura.[8] Průměrná fluorescence v oblasti pak může být vynesena proti času od fotobělení a výsledná křivka může poskytnout kinetické koeficienty, jako jsou například vazebné reakce proteinu a / nebo difúzní koeficient proteinu v médiu, kde je monitorován.[9] Jedinou uvažovanou dynamikou jsou často difúzní a vazebné / vazebné interakce, nicméně v zásadě se proteiny mohou pohybovat také tokem, tj. Procházet řízeným pohybem, což bylo Axelrodem a kol. Rozpoznáno velmi brzy.[1] Může to být způsobeno tokem cytoplazmy nebo nukleoplazmy nebo transportem po vláknech v buňce, jako je mikrotubuly podle molekulární motory.
Analýza je nejjednodušší, když je obnova fluorescence omezena buď rychlostí difúze do bělené oblasti, nebo rychlostí, při které se bělené proteiny oddělí od svých vazebných míst v bělené oblasti, a jsou nahrazeny fluorescenčním proteinem. Podívejme se na tyto dva limity pro běžný případ bělení fúzního proteinu GFP v živé buňce.
Obnova fluorescence omezená difúzí
Pro kruhovou bělící skvrnu o poloměru a zotavení ovládané difúzí je fluorescence popsána rovnicí odvozenou Soumpasis[10] (což zahrnuje upravené Besselovy funkce a )
s charakteristický časový rámec pro difúzi a je čas. je normalizovaná fluorescence (jde k 1 jako jde do nekonečna). Časový rozsah difúze pro vybělené místo o poloměru je , s D koeficient difúze.
Všimněte si, že toto je pro okamžité bělidlo s profilem krokové funkce, tj. Zlomek bílkovin se předpokládalo, že jsou okamžitě běleny je , a , pro je vzdálenost od středu bělené oblasti. Rovněž se předpokládá, že zotavení lze modelovat difúzí ve dvou rozměrech, která je také stejnoměrná i izotropní. Jinými slovy, tato difúze probíhá v jednotném médiu, takže účinná difúzní konstanta D je všude stejná a že difúze je izotropní, tj. vyskytuje se stejnou rychlostí podél všech os v rovině.
V praxi žádný z těchto předpokladů nebude v buňce striktně pravdivý.
- Bělení nebude okamžité. Zejména pokud je vyžadováno silné bělení na velké ploše, může bělení vyžadovat významnou část časového rozptylu difúze . Poté významná část běleného proteinu difunduje z bělené oblasti ve skutečnosti během bělení. Pokud to nebudete brát v úvahu, způsobí to významnou chybu D.[11][12][13]
- Bělený profil nebude funkcí radiálního kroku. Pokud je vybělená skvrna účinně jediným pixelem, bude bělení jako funkce polohy obvykle difrakčně omezeno a určeno optikou konfokální laserový skenovací mikroskop použitý. Nejedná se o radiální krokovou funkci a také se mění podél osy kolmé k rovině.
- Buňky jsou samozřejmě trojrozměrné, nikoli dvourozměrné, stejně jako vybledlý objem. Zanedbávání difúze z roviny (považujeme to za xy rovina) bude rozumnou aproximací, pouze pokud se fluorescence obnoví převážně difúzí v této rovině. To bude platit například v případě, že je válcový objem vybělený osou válce podél z Osa as tímto válcovým objemem procházející celou výškou buňky. Pak difúze podél z osa nezpůsobuje zotavení fluorescence, protože veškerý protein je bělen rovnoměrně podél z osa, a tak je zanedbání, jak to dělá Soumpasisova rovnice, neškodné. Pokud se však šíří podél z osa přispívá k obnově fluorescence, pak je třeba s ní počítat.
- Není důvod očekávat, že buněčná cytoplazma nebo nukleoplazma budou zcela prostorově uniformní nebo izotropní.
Rovnice Soumpasis je tedy jen užitečná aproximace, kterou lze použít, když jsou výše uvedené předpoklady dobrou aproximací skutečné situace a když je obnova fluorescence skutečně omezena časovým rozsahem difúze . Všimněte si, že jen proto, že Soumpasis lze adekvátně přizpůsobit datům, nutně neznamená, že předpoklady jsou pravdivé a že obnova dominuje šíření.
Obnova omezená reakcí
Rovnice popisující fluorescenci jako funkci času je zvláště jednoduchá v jiném limitu. Pokud se velký počet proteinů váže na místa v malém objemu tak, že tam fluorescenční signál dominuje signálem z vázaných proteinů, a pokud je tato vazba v jednom stavu s rychlostí off kvypnuto, pak je fluorescence jako funkce času dána vztahem[14]
Pamatujte, že zotavení závisí na rychlostní konstantě pro uvolnění, kvypnuto, pouze. Nezáleží na rychlosti vazby. I když to záleží na řadě předpokladů[14]
- Rychlost zapnutí musí být dostatečně velká, aby lokální koncentrace vázaného proteinu výrazně překročila lokální koncentraci volného proteinu, a tak nám dovolte zanedbávat příspěvek k F volného proteinu.
- Reakce je jednoduchá bimolekulární reakce, kdy se protein váže na lokalizovaná místa, která se během zotavení významně nepohybují
- Výměna je mnohem pomalejší než difúze (nebo jakýkoli transportní mechanismus, který je zodpovědný za mobilitu), protože teprve poté se difuzní frakce rychle zotavuje a poté působí jako zdroj fluorescenčního proteinu, který váže a nahrazuje vázaný bělený protein, a tak zvyšuje fluorescenci. S r poloměr vybělené skvrny, to znamená, že rovnice je platná pouze v případě, že je vázaná životnost .
Pokud jsou všechny tyto předpoklady splněny, pak přizpůsobení exponenciálu křivce zotavení poskytne konstantu off rate, kvypnuto. Jiná dynamika však může poskytnout křivky zotavení podobné exponenciálům, takže přizpůsobení exponenciálu nemusí nutně znamenat, že obnově dominuje jednoduchá bimolekulární reakce. Jedním ze způsobů, jak rozlišovat mezi obnovou s rychlostí určenou uvolněním a obnovou, která je omezena difúzí, je poznamenat, že rychlost obnovy pro uvolnění omezenou obnovou je nezávislá na velikosti vybělené oblasti r, zatímco se mění jako , pro zotavení omezené difúzí. Pokud je tedy vybělena malá a velká plocha, je-li obnova omezena uvolněním, pak budou rychlosti obnovy stejné pro dvě velikosti bělené plochy, zatímco pokud je obnova omezena difúzí, bude pro mnohem bělenější mnohem pomalejší plocha.
Difúze a reakce
Obecně nebude obnově fluorescence dominovat ani jednoduchá izotropní difúze, ani jediná jednoduchá rychlost vazby. Bude existovat jak difúze, tak vazba, a skutečně difúzní konstanta nemusí být jednotná v prostoru a může existovat více než jeden typ vazebných míst a tato místa mohou také mít nerovnoměrnou distribuci v prostoru. Důležité mohou být také procesy toku. Toto složitější chování znamená, že k popisu dat je vyžadován model s několika parametry; modely pouze s jedinou difúzní konstantou D nebo jednorázová konstanta rychlosti, kvypnuto, jsou nedostatečné.
Existují modely s difúzí i reakcí.[2] Jedna křivka FRAP bohužel může poskytnout nedostatečné důkazy pro spolehlivé a jedinečné přizpůsobení (možná hlučných) experimentálních dat. Sadegh Zadeh et al. [15] ukázaly, že křivky FRAP lze přizpůsobit pomocí odlišný páry hodnot difuzní konstanty a konstanty rychlosti, nebo jinými slovy, které odpovídají FRAP, nejsou jedinečné. To je ve třech parametrech (konstanta rychlosti, konstanta rychlosti a difúzní konstanta). Vložky, které nejsou jedinečné, nejsou obecně užitečné.
U modelů s řadou parametrů tedy může být jeden experiment FRAP nedostatečný k odhadu všech parametrů modelu. Pak je zapotřebí více dat, např. Vybělením oblastí různých velikostí,[13] nezávislé určování některých parametrů modelu atd.
Viz také
Reference
- ^ A b C Axelrod, D; Koppel, D; Schlessinger, J; Elson, E; Webb, W (1976). „Měření mobility analýzou kinetiky obnovy fluorescenčního fotobělení“. Biofyzikální deník. 16 (9): 1055–69. Bibcode:1976BpJ .... 16.1055A. doi:10.1016 / S0006-3495 (76) 85755-4. PMC 1334945. PMID 786399.
- ^ A b Sprague, Brian L .; Pego, Robert L .; Stavreva, Diana A .; McNally, James G. (2004). „Analýza vazebných reakcí pomocí fluorescenčního zotavení po fotobělení“. Biofyzikální deník. 86 (6): 3473–95. Bibcode:2004BpJ .... 86,3473S. doi:10.1529 / biophysj.103.026765. PMC 1304253. PMID 15189848.
- ^ A b C Kou Qin; Chunmin Dong; Guangyu Wu; Nevin A Lambert (srpen 2011). „Předmontáž neaktivních stavů receptorů spřažených s Gq a heterotrimerů Gq“. Přírodní chemická biologie. 7 (11): 740–747. doi:10.1038 / nchembio.642. PMC 3177959. PMID 21873996.
- ^ Den, CA; Kraft, LJ; Kang, M; Kenworthy, AK (2012). „Analýza dynamiky bílkovin a lipidů pomocí konfokální obnovy fluorescence po fotobělení (FRAP)“. Současné protokoly v cytometrii. Kapitola 2: 2–19. doi:10.1002 / 0471142956.cy0219s62. PMC 3538152. PMID 23042527.
- ^ Mazza, D; Mueller, F; Stasevich, TJ; McNally, JG (2013). "Konvergence odhadů vazby chromatinu v živých buňkách". Nat metody. 10 (8): 691–2. doi:10.1038 / nmeth.2573. PMID 23900248. S2CID 27896929.
- ^ Kou Qin; Pooja R. Sethi; Nevin A. Lambert (srpen 2008). „Hojnost a stabilita komplexů obsahujících neaktivní receptory spojené s G proteinem a G proteiny“. FASEB Journal. 22 (8): 2920–2927. doi:10.1096 / fj.08-105775. PMC 2493464. PMID 18434433.
- ^ Kraft, LJ; Kenworthy, AK (2012). „Zobrazování tvorby proteinového komplexu v autofagické dráze: analýza interakce LC3 a Atg4B (C74A) v živých buňkách pomocí Försterova přenosu rezonanční energie a obnovy fluorescence po fotobělení“. J Biomed Opt. 17 (1): 011008. Bibcode:2012JBO .... 17a1008K. doi:10.1117 / 1.JBO.17.1.011008. PMC 3380812. PMID 22352642.
- ^ Tripathi, K; Parnaik, VK (2008). "Diferenciální dynamika spojovacího faktoru SC35 během buněčného cyklu". Journal of Biosciences. 33 (3): 345–54. doi:10.1007 / s12038-008-0054-3. PMID 19005234. S2CID 6332495.
- ^ Houtsmuller, AB (2005). "Obnova fluorescence po fotobělení: Aplikace na jaderné proteiny". Pokroky v biochemickém inženýrství / biotechnologii. 95: 177–99. doi:10.1007 / b102214. ISBN 978-3-540-23698-6. PMID 16080269.
- ^ Soumpasis, D (1983). „Teoretická analýza experimentů obnovy fluorescenčního fotobělení“. Biofyzikální deník. 41 (1): 95–7. Bibcode:1983BpJ .... 41 ... 95S. doi:10.1016 / S0006-3495 (83) 84410-5. PMC 1329018. PMID 6824758.
- ^ Yang, J .; Köhler, K .; Davis, D. M .; Burroughs, N. J. (2009). "Vylepšená metoda FRAP pásu pro odhad difúzních koeficientů: Oprava pro stupeň bělení fotografií". Journal of Microscopy. 238 (3): 240–53. doi:10.1111 / j.1365-2818.2009.03347.x. PMID 20579262. S2CID 21797777.
- ^ Castle, Brian T .; Howard, Stephen A .; Odde, David J. (2011). „Posouzení přepravních mechanismů, na nichž je založen gradient bicoidního morfogenu“. Buněčné a molekulární bioinženýrství. 4 (1): 116–121. doi:10.1007 / s12195-010-0157-4. PMC 3164504. PMID 21892361.
- ^ A b González-Pérez, Vinicio; Schmierer, Bernhard; Hill, Caroline S .; Sear, Richard P. (2011). "Studium dynamiky intranukleární difúze Smad2 pomocí matematického modelování experimentů FRAP". Integrativní biologie. 3 (3): 197–207. doi:10.1039 / c0ib00098a. PMID 21240396.
- ^ A b Bulinski, JC; Odde, DJ; Howell, BJ; Losos, TD; Waterman-Storer, CM (2001). "Rychlá dynamika vazby mikrosubulů ensconsinu in vivo". Journal of Cell Science. 114 (Pt 21): 3885–97. PMID 11719555.
- ^ Sadegh Zadeh, Kouroush; Montas, Hubert J; Shirmohammadi, Adel (2006). „Identifikace parametrů přenosu hmoty a rychlosti vazby v živých buňkách pomocí inverzního modelování“. Teoretická biologie a lékařské modelování. 3: 36. doi:10.1186/1742-4682-3-36. PMC 1635038. PMID 17034642.

















