HtrA serinová peptidáza 2 - HtrA serine peptidase 2
Serinová proteáza HTRA2, mitochondriální je enzym že u lidí je kódován HTRA2 gen.[5][6][7] Tento protein je součástí kaspáza -závislý apoptóza a v Parkinsonova choroba.[8][9]
Struktura
Gen
Gen HTRA2 kóduje serinproteázu. Lidský gen má 8 exony a najde na chromozóm pásmo 2p12.
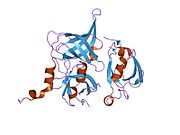
Protein
Protein HtrA2, také známý jako Omi, je a mitochondriálně - lokalizovaná serinová proteáza. Lidská proteinová serinová proteáza HTRA2, mitochondriální, má velikost 49 kDa a skládá se z 458 aminokyseliny. Peptidový fragment 1-31 aminokyseliny je mitochondriální přechodová sekvence, fragment 32-133 aminokyselin je upraven a 134-458 je zralý protein serinová proteáza HTRA2, mitochondriální a jeho teoretická pI tohoto proteinu je 6.12.[10] HtrA2 vykazuje podobnosti s DegS, bakteriální proteázou přítomnou v periplazmě gramnegativních bakterií. Strukturálně je HtrA2 trimerní molekula s centrálními doménami proteázy a a karboxy-terminál PDZ doména, která je charakteristická pro rodinu HtrA. Doména PDZ přednostně váže C-konec proteinového substrátu a moduluje proteolytickou aktivitu proteázové domény podobné trypsinu.[11]
Funkce
Rodina požadavků na vysokou teplotu (HtrA) je zachována evolučně a tyto oligomerní serinové proteázy byly klasifikovány v rodině S1B klanu PA proteáz v MEROPS databáze proteáz.[11] Aktivita proteázy člena HtrA HtrA2 / Omi je vyžadována pro mitochondriální homeostázu u myší a lidí a inaktivaci mutací spojených s neurodegenerativními poruchami, jako je Parkinsonova choroba.[8] Kromě toho se HtrA2 / Omi uvolňuje v cytosolu z mitochondrie v době apoptóza a využívá jeho čtyři nejvíce N-terminál aminokyseliny napodobující a kaspáza a být získáváni inhibitory kaspázových inhibitorů apoptózového proteinu (IAP), jako jsou XIAP a CIAP1 / 2. Jakmile je vázán, serinová proteáza štěpí IAP a snižuje inhibici buňky na aktivaci kaspázy. Stručně řečeno, HTRA2 / Omi přispívá k apoptóze jak cestami závislými na kaspázách, tak nezávislými cestami.
Klinický význam
Ukázalo se, že členové rodiny proteáz HtrA hrají klíčovou roli ve fyziologii buněk a jsou zapojeni do několika patologických procesů včetně rakoviny[12] a neurodegenerativní onemocnění.[11] Existují silné důkazy o zapojení HtrA2 do onkogeneze. Tento protein je široce exprimován v různých liniích rakovinných buněk,[13][14][15][16] Analýza vzorků biopsie ukázala změny v expresi HtrA2 v rakovinných tkáních ve srovnání s normálními tkáněmi.
HtrA2 byl nedávno identifikován jako gen související s Parkinsonovou chorobou. Mutace v Htra2 byly nalezeny u pacientů trpících Parkinsonovou chorobou. Navíc myši bez HtrA2 mají parkinsonovu chorobu fenotyp. To naznačuje, že HtrA2 je spojen s progresí Parkinsonovy choroby u lidí a myší.[9]
Interakce
Bylo prokázáno, že HtrA serinová peptidáza 2 komunikovat s MAPK14,[5] XIAP[17][18] a BIRC2.[17][18]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000115317 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000068329 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b Faccio L, Fusco C, Chen A, Martinotti S, Bonventre JV, Zervos AS (leden 2000). „Charakterizace nové lidské serinové proteázy, která má rozsáhlou homologii s bakteriálním tepelným šokem endoproteázou HtrA a je regulována ischemií ledvin“. The Journal of Biological Chemistry. 275 (4): 2581–8. doi:10.1074 / jbc.275.4.2581. PMID 10644717.
- ^ Gray CW, Ward RV, Karran E, Turconi S, Rowles A, Viglienghi D, Southan C, Barton A, Fantom KG, West A, Savopoulos J, Hassan NJ, Clinkenbeard H, Hanning C, Amegadzie B, Davis JB, Dingwall C , Livi GP, Creasy CL (září 2000). „Charakterizace lidského HtrA2, nové serinové proteázy podílející se na buněčné stresové reakci savců“. European Journal of Biochemistry / FEBS. 267 (18): 5699–710. doi:10.1046 / j.1432-1327.2000.01589.x. PMID 10971580.
- ^ „Entrez Gene: HTRA2 HtrA serinová peptidáza 2“.
- ^ A b Jones JM, Datta P, Srinivasula SM, Ji W, Gupta S, Zhang Z, Davies E, Hajnóczky G, Saunders TL, Van Keuren ML, Fernandes-Alnemri T, Meisler MH, Alnemri ES (říjen 2003). „Ztráta aktivity mitochondriální proteázy Omi způsobuje neuromuskulární poruchu mutovaných myší mnd2“ (PDF). Příroda. 425 (6959): 721–7. doi:10.1038 / nature02052. hdl:2027.42/62561. PMID 14534547. S2CID 4372496.
- ^ A b Strauss KM, Martins LM, Plun-Favreau H, Marx FP, Kautzmann S, Berg D, Gasser T, Wszolek Z, Müller T, Bornemann A, Wolburg H, Downward J, Riess O, Schulz JB, Krüger R (srpen 2005) . „Ztráta funkčních mutací v genu kódujícím Omi / HtrA2 u Parkinsonovy choroby“. Lidská molekulární genetika. 14 (15): 2099–111. doi:10,1093 / hmg / ddi215. PMID 15961413.
- ^ „Uniprot: O43464 - HTRA2_HUMAN“.
- ^ A b C Vande Walle L, Lamkanfi M, Vandenabeele P (březen 2008). „Mitochondriální serinová proteáza HtrA2 / Omi: přehled“. Buněčná smrt a diferenciace. 15 (3): 453–60. doi:10.1038 / sj.cdd.4402291. PMID 18174901.
- ^ Bulteau AL, Bayot A (červen 2011). "Mitochondriální proteázy a rakovina". Biochimica et Biophysica Acta (BBA) - bioenergetika. 1807 (6): 595–601. doi:10.1016 / j.bbabio.2010.12.011. PMID 21194520.
- ^ Bowden MA, Di Nezza-Cossens LA, Jobling T, Salamonsen LA, Nie G (říjen 2006). „Serinproteázy HTRA1 a HTRA3 jsou down-regulovány s rostoucím stupněm lidské rakoviny endometria“. Gynekologická onkologie. 103 (1): 253–60. doi:10.1016 / j.ygyno.2006.03.006. PMID 16650464.
- ^ Lee SH, Lee JW, Kim HS, Kim SY, Park WS, Kim SH, Lee JY, Yoo NJ (květen 2003). "Imunohistochemická analýza exprese Omi / HtrA2 u rakoviny žaludku". APMIS. 111 (5): 586–90. doi:10.1034 / j.1600-0463.2003.1110508.x. PMID 12887511. S2CID 24058023.
- ^ Narkiewicz J, Klasa-Mazurkiewicz D, Zurawa-Janicka D, Skorko-Glonek J, Emerich J, Lipinska B (květen 2008). "Změny v hladinách mRNA a proteinů v lidském HtrA1, HtrA2 a HtrA3 u rakoviny vaječníků". Klinická biochemie. 41 (7–8): 561–9. doi:10.1016 / j.clinbiochem.2008.01.004. PMID 18241672.
- ^ Zurawa-Janicka D, Kobiela J, Stefaniak T, Wozniak A, Narkiewicz J, Wozniak M, Limon J, Lipinska B (2008). "Změny v expresi serinových proteáz HtrA1 a HtrA2 během estrogenem vyvolaného oxidativního stresu a nefrokarcinogeneze u syrského křečka". Acta Biochimica Polonica. 55 (1): 9–19. doi:10.18388 / abp.2008_3123. PMID 18231652.
- ^ A b Hegde R, Srinivasula SM, Datta P, Madesh M, Wassell R, Zhang Z, Cheong N, Nejmeh J, Fernandes-Alnemri T, Hoshino S, Alnemri ES (říjen 2003). „Faktor uvolňující polypeptidový řetězec GSPT1 / eRF3 je proteolyticky zpracován na protein vázající IAP“. The Journal of Biological Chemistry. 278 (40): 38699–706. doi:10,1074 / jbc.M303179200. PMID 12865429.
- ^ A b Verhagen AM, Silke J, Ekert PG, Pakusch M, Kaufmann H, Connolly LM, Day CL, Tikoo A, Burke R, Wrobel C, Moritz RL, Simpson RJ, Vaux DL (leden 2002). „HtrA2 podporuje buněčnou smrt díky své aktivitě serinové proteázy a své schopnosti antagonizovat inhibitor proteinů apoptózy“. The Journal of Biological Chemistry. 277 (1): 445–54. doi:10,1074 / jbc.M109891200. PMID 11604410.
Další čtení
- Zurawa-Janicka D, Narkiewicz J, Lipińska B (2007). "[Charakterizace rodiny proteinů HtrA]". Postepy Biochemii. 53 (1): 27–36. PMID 17718385.
- Maruyama K, Sugano S (leden 1994). „Oligo-capping: jednoduchá metoda k nahrazení struktury cap eukaryotických mRNA oligoribonukleotidy“. Gen. 138 (1–2): 171–4. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (říjen 1997). "Konstrukce a charakterizace knihovny cDNA obohacené o celou délku a 5'-end". Gen. 200 (1–2): 149–56. doi:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Savopoulos JW, Carter PS, Turconi S, Pettman GR, Karran EH, Gray CW, Ward RV, Jenkins O, Creasy CL (červenec 2000). "Exprese, čištění a funkční analýza lidské serinové proteázy HtrA2". Exprese a čištění proteinů. 19 (2): 227–34. doi:10.1006 / prep.2000.1240. PMID 10873535.
- Faccio L, Fusco C, Viel A, Zervos AS (září 2000). „Tkáňově specifické sestřih Omi stresem regulované endoproteázy vede k neaktivní proteáze s modifikovaným PDZ motivem“. Genomika. 68 (3): 343–7. doi:10,1006 / geno.2000.6263. PMID 10995577.
- Suzuki Y, Imai Y, Nakayama H, Takahashi K, Takio K, Takahashi R (září 2001). „Serinová proteáza, HtrA2, se uvolňuje z mitochondrií a interaguje s XIAP, čímž indukuje buněčnou smrt.“ Molekulární buňka. 8 (3): 613–21. doi:10.1016 / S1097-2765 (01) 00341-0. PMID 11583623.
- Verhagen AM, Silke J, Ekert PG, Pakusch M, Kaufmann H, Connolly LM, Day CL, Tikoo A, Burke R, Wrobel C, Moritz RL, Simpson RJ, Vaux DL (leden 2002). „HtrA2 podporuje buněčnou smrt díky své aktivitě serinové proteázy a své schopnosti antagonizovat inhibitor proteinů apoptózy“. The Journal of Biological Chemistry. 277 (1): 445–54. doi:10,1074 / jbc.M109891200. PMID 11604410.
- Hegde R, Srinivasula SM, Zhang Z, Wassell R, Mukattash R, Cilenti L, DuBois G, Lazebnik Y, Zervos AS, Fernandes-Alnemri T, Alnemri ES (leden 2002). „Identifikace Omi / HtrA2 jako mitochondriální apoptotické serinové proteázy, která narušuje inhibitor interakce apoptóza-protein-kaspáza“. The Journal of Biological Chemistry. 277 (1): 432–8. doi:10,1074 / jbc.M109721200. PMID 11606597.
- Vucic D, Deshayes K, Ackerly H, Pisabarro MT, Kadkhodayan S, Fairbrother WJ, Dixit VM (duben 2002). „SMAC negativně reguluje antiapoptotickou aktivitu inhibitoru melanomu apoptózy (ML-IAP)“. The Journal of Biological Chemistry. 277 (14): 12275–9. doi:10,1074 / jbc.M112045200. PMID 11801603.
- van Loo G, van Gurp M, Depuydt B, Srinivasula SM, Rodriguez I, Alnemri ES, Gevaert K, Vandekerckhove J, Declercq W, Vandenabeele P (leden 2002). „Serinová proteáza Omi / HtrA2 se uvolňuje z mitochondrií během apoptózy. Omi interaguje s inhibitorem kaspázy XIAP a indukuje zvýšenou aktivitu kaspázy.“. Buněčná smrt a diferenciace. 9 (1): 20–6. doi:10.1038 / sj.cdd.4400970. PMID 11803371.
- Li W, Srinivasula SM, Chai J, Li P, Wu JW, Zhang Z, Alnemri ES, Shi Y (červen 2002). "Strukturální pohledy na pro-apoptotickou funkci mitochondriální serinové proteázy HtrA2 / Omi". Přírodní strukturní biologie. 9 (6): 436–41. doi:10.1038 / nsb795. PMID 11967569. S2CID 21170905.
- Yang QH, Church-Hajduk R, Ren J, Newton ML, Du C (červen 2003). „Omi / HtrA2 katalytické štěpení inhibitoru apoptózy (IAP) nevratně inaktivuje IAP a usnadňuje aktivitu kaspázy v apoptóze“. Geny a vývoj. 17 (12): 1487–96. doi:10.1101 / gad.1097903. PMC 196079. PMID 12815069.
- Srinivasula SM, Gupta S, Datta P, Zhang Z, Hegde R, Cheong N, Fernandes-Alnemri T, Alnemri ES (srpen 2003). „Inhibitor proteinů apoptózy jsou substráty pro mitochondriální serinproteázu Omi / HtrA2“. The Journal of Biological Chemistry. 278 (34): 31469–72. doi:10,1074 / jbc.C300240200. PMID 12835328.
- Suzuki Y, Takahashi-Niki K, Akagi T, Hashikawa T, Takahashi R (únor 2004). „Mitochondriální proteáza Omi / HtrA2 zvyšuje aktivaci kaspázy několika cestami“. Buněčná smrt a diferenciace. 11 (2): 208–16. doi:10.1038 / sj.cdd.4401343. PMID 14605674.
- Okada M, Adachi S, Imai T, Watanabe K, Toyokuni SY, Ueno M, Zervos AS, Kroemer G, Nakahata T (březen 2004). „Nový mechanismus buněčné smrti imatinib mesylátu u BCR-ABL-pozitivních lidských leukemických buněk: buněčná smrt nezávislá na kaspázách, podobná nekróze zprostředkovaná aktivitou serinové proteázy“. Krev. 103 (6): 2299–307. doi:10.1182 / krev-2003-05-1605. PMID 14645012.
- Park HJ, Seong YM, Choi JY, Kang S, Rhim H (únor 2004). „Amyloid beta spojený s Alzheimerovou chorobou interaguje s lidskou serinproteázou HtrA2 / Omi“. Neurovědy Dopisy. 357 (1): 63–7. doi:10.1016 / j.neulet.2003.11.068. PMID 15036614. S2CID 12059062.
- Guo Y, Cheong N, Zhang Z, De Rose R, Deng Y, Farber SA, Fernandes-Alnemri T, Alnemri ES (červen 2004). „Tim50, součást mitochondriálního translokátoru, reguluje mitochondriální integritu a buněčnou smrt“. The Journal of Biological Chemistry. 279 (23): 24813–25. doi:10,1074 / jbc.M402049200. PMID 15044455.