Obálka glykoprotein GP120 - Envelope glycoprotein GP120
| Obálka glykoprotein gp120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | GP120 | ||||||||
| Pfam | PF00516 | ||||||||
| InterPro | IPR000777 | ||||||||
| SCOP2 | 1gc1 / Rozsah / SUPFAM | ||||||||
| |||||||||
Obálka glykoprotein GP120 (nebo gp120) je glykoprotein vystaveny na povrchu HIV obálka. Objevili to profesoři Tun-Hou Lee a Myron "Max" Essex z Harvardská škola veřejného zdraví v roce 1988.[1] 120 v jeho názvu pochází z jeho molekulární váha 120 kDa. GP120 je nezbytný pro vstup viru do buněk, protože hraje zásadní roli ve vazbě na konkrétní buněčné povrchové receptory. Tyto receptory jsou DC-SIGN,[2] Heparan sulfátový proteoglykan[3] a konkrétní interakce s CD4 receptor,[4] zejména na pomocné T-buňky. Vazba na CD4 indukuje začátek kaskády konformační změny v gp120 a gp41, které vedou k fúzi virové membrány s hostitelem buněčná membrána. Vazba na CD4 je hlavně elektrostatický i když existují van der Waals interakce a Vodíkové vazby.[5]
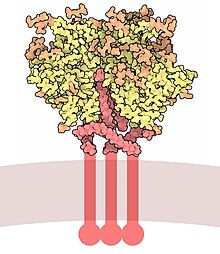
Gp120 je kódován HIV env gen, což je kolem 2.5 kb long a kóduje přibližně 850 aminokyselin.[6] Primární env Produktem je protein gp160, který se štěpí na gp120 (~ 480 aminokyselin) a gp41 (~ 345 aminokyselin) v endoplazmatické retikulum buňkou proteáza furin.[7] Krystalová struktura jádra gp120 ukazuje organizaci s vnější doménou, vnitřní doménou vzhledem k jejím koncům a překlenovací list. Gp120 je ukotven k virová membrána, nebo obálku, prostřednictvím nekovalentních vazeb s transmembránový glykoprotein, gp41. Tři gp120s a gp41s se kombinují v trimeru heterodimery vytvořit hrot obálky,[8] který zprostředkovává připojení a vstup do hostitelské buňky.
Variabilita
Protože gp120 hraje zásadní roli ve schopnosti HIV-1 vstoupit do CD4+ buněk, jeho vývoj je zvláště zajímavý. Mnoho neutralizačních protilátek se váže na místa umístěná ve variabilních oblastech gp120, takže mutace v těchto oblastech budou silně selektovány.[9] Rozmanitost env Bylo prokázáno, že se zvyšuje u HIV-1 skupiny M o 1-2% za rok a variabilní jednotky jsou pozoruhodné rychlými změnami v délce aminokyselinové sekvence. Zvýšení variability gp120 má za následek významně zvýšené hladiny virové replikace, což naznačuje zvýšení virové zdatnosti u jedinců infikovaných různými variantami HIV-1.[10] Další studie ukázaly, že variabilita potenciálních N-vázaných glykosylačních míst (PNGS) také vede ke zvýšené virové kondici. PNGS umožňují vazbu sacharidů s dlouhým řetězcem na oblasti s vysokou variabilitou gp120, takže autoři předpokládají, že počet PNGS v env může ovlivnit kondici viru tím, že poskytuje více či méně citlivost na neutralizaci protilátek. Přítomnost velkých sacharidových řetězců vystupujících z gp120 může zakrývat možná vazebná místa pro protilátky.[11]
Hranice potenciálu přidávat a eliminovat PNGS jsou naivně prozkoumány rostoucí populací virů po každé nové infekci.[12] Zatímco vysílající hostitel vyvinul neutralizační protilátkovou odpověď na gp120, nově infikovanému hostiteli chybí imunitní rozpoznání viru. Data sekvence ukazují, že počáteční virové varianty v imunologicky naivním hostiteli mají málo glykosylačních míst a kratší exponované variabilní smyčky. To může usnadnit virovou schopnost vázat receptory hostitelských buněk.[13] Protože imunitní systém hostitele vyvíjí protilátky proti gp120, zdá se, že imunitní tlaky volí zvýšenou glykosylaci, zejména na exponovaných variabilních smyčkách gp120.[14] V důsledku toho vložení dovnitř env, které propůjčují více PNGS gp120, může být virem snášen snáze, protože vyšší hustota glykanu podporuje virovou schopnost vyhnout se protilátkám, a tím podporuje vyšší virovou zdatnost.[15] Při zvažování toho, kolik by se teoreticky mohla změnit hustota PNGS, může existovat horní hranice čísla PNGS kvůli jeho inhibici skládání gp120, ale pokud počet PNGS podstatně poklesne, pak je virus příliš snadno detekován neutralizujícími protilátkami.[12] Proto je pravděpodobně nastolena stabilizační rovnováha selekce mezi nízkou a vysokou hustotou glykanu. Nižší počet objemných glykanů zlepšuje účinnost replikace virů a vyšší počet na exponovaných smyčkách napomáhá imunitnímu úniku hostitele maskováním.
Příkladem je vztah mezi gp120 a neutralizujícími protilátkami Rudá královna evoluční dynamika. Pro udržení kondice ve vztahu k pokračující evoluční adaptaci imunitně neutralizujících protilátek hostitele je nutná pokračující evoluční adaptace proteinu virového obalu a naopak, tvořící koevoluční systém.[15]
Cíl vakcíny
Vzhledem k tomu, že vazba na receptor CD4 je nejzřejmějším krokem infekce HIV, byl gp120 jedním z prvních cílů Vakcína proti HIV výzkum. Snahy o vývoj vakcín proti HIV zaměřených na gp120 však byly brzdeny chemickými a strukturními vlastnostmi gp120, které ztěžují protilátky vázat se na to. gp120 lze také snadno odstranit z povrchu viru a zachytit jej T buňky kvůli jeho uvolněné vazbě s gp41. Byla identifikována konzervovaná oblast v glykoproteinu gp120, která se podílí na metastabilním připojení gp120 k CD4, a cílení na invariantní oblast bylo dosaženo široce neutralizující protilátkou IgG1-b12.[16][17]
NIH výzkum publikovaný v Věda uvádí izolaci 3 protilátek, které neutralizují 90% HIV-1 kmeny v oblasti CD4bs gp120, potenciálně nabízející terapeutickou a vakcínovou strategii. [1] Většina protilátek, které se vážou na oblast CDbs gp120, však HIV neutralizuje,[18] a vzácné, které takové látky jako IgG1-b12 mají, mají neobvyklé vlastnosti, jako je asymetrie Fab ramen[19] nebo v jejich umístění.[20] Pokud vakcína na bázi gp120 nemůže být navržena k vyvolání protilátek se silně neutralizujícími antivirovými vlastnostmi, existuje obava, že průlomová infekce vedoucí k humorální produkci vysokých hladin neneutralizujících protilátek zaměřených na CD4 vazebné místo gp120 je spojena s rychlejší progresí onemocnění do AIDS.[21]
Soutěž
Protein gp120 je nezbytný během počáteční vazby HIV na jeho cílovou buňku. V důsledku toho může cokoli, co se váže na gp120 nebo na jeho cíle, fyzicky blokovat navázání gp120 na buňku. Pouze jeden takový agent, Maraviroc, který váže ko-receptor CCR5 je v současné době licencován a je klinicky používán. Žádný agent zaměřený na hlavního prvního partnera buněčné interakce gp120, CD4, je v současné době licencován, protože interference s takovou centrální molekulou imunitního systému může způsobit toxické vedlejší účinky, jako je anti-CD4 monoklonální protilátka OKT4. Samotné cílení na gp120 se ukázalo jako velmi obtížné kvůli jeho vysokému stupni variabilita a stínění. Fostemsavir (BMS-663068) je methylfosfátový proléčivo inhibitoru s malou molekulou BMS-626529, který zabraňuje vstupu viru vazbou na virový obal gp120 a interferuje s navázáním viru na hostitelský receptor CD4.[22]
HIV demence
Virový protein HIV gp120 indukuje apoptózu neuronálních buněk inhibicí hladin furinu a aktivátoru tkáňového plazminogenu, což jsou enzymy odpovědné za přeměnu pBDNF na mBDNF.[23] gp120 indukuje proteiny mitochondriální smrti, jako jsou kaspázy, které mohou ovlivnit regulaci Fas receptoru smrti vedoucí k apoptóze neuronálních buněk,[24] gp120 indukuje oxidační stres v neuronálních buňkách,[25] a je také známo, že aktivuje STAT1 a indukuje sekreci interleukinů IL-6 a IL-8 v neuronálních buňkách.[26]
Viz také
Reference
- ^ „Licence prodávané pro výzkum s novým proteinem“. The New York Times. 1989-02-08. Citováno 16. dubna 2018.
- ^ Curtis BM, Scharnowske S, Watson AJ (září 1992). "Sekvence a exprese s membránou asociovaného lektinu typu C, který vykazuje na CD4 nezávislé vazbě glykoproteinu gp120 viru lidské imunodeficience". Proc. Natl. Acad. Sci. USA. 89 (17): 8356–60. Bibcode:1992PNAS ... 89.8356C. doi:10.1073 / pnas.89.17.8356. PMC 49917. PMID 1518869.
- ^ de Witte L, Bobardt M, Chatterji U, Degeest G, David G, Geijtenbeek TB, Gallay P (prosinec 2007). „Syndecan-3 je dendritický buněčně specifický připojovací receptor pro HIV-1“. Proc. Natl. Acad. Sci. USA. 104 (49): 19464–9. Bibcode:2007PNAS..10419464D. doi:10.1073 / pnas.0703747104. PMC 2148312. PMID 18040049.
- ^ Dalgleish AG, Beverley PC, Clapham PR, Crawford DH, Greaves MF, Weiss RA (1984). „Antigen CD4 (T4) je základní složkou receptoru pro AIDS retrovirus.“ Příroda. 312 (5996): 763–7. Bibcode:1984Natur.312..763D. doi:10.1038 / 312763a0. PMID 6096719.
- ^ Korkut, A; Hendrickson, WA (2012). „Strukturální plasticita a konformační přechody HIV obálky glykoprotein gp120“. PLOS One. 7 (12): e52170. Bibcode:2012PLoSO ... 752170K. doi:10.1371 / journal.pone.0052170. PMC 3531394. PMID 23300605.
- ^ Kuiken, C., Leitner, T., Foley, B., et al. (2008). „Kompendium sekvence HIV“, Národní laboratoř v Los Alamos.
- ^ Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W (listopad 1992). "Inhibice furinem zprostředkované aktivace štěpení HIV-1 glykoproteinu gp160". Příroda. 360 (6402): 358–61. Bibcode:1992 Natur.360..358H. doi:10.1038 / 360358a0. PMID 1360148.
- ^ Zhu P, Winkler H, Chertova E, Taylor KA, Roux KH (listopad 2008). „Kryoelektronová tomografie hrotů obálky HIV-1: další důkazy pro nohy podobné stativu“. PLOS Pathog. 4 (11): e1000203. doi:10.1371 / journal.ppat.1000203. PMC 2577619. PMID 19008954.
- ^ Wyatt R, Kwong PD, Desjardins E, Sweet RW, Robinson J, Hendrickson WA, Sodroski JG (1998). "Antigenní struktura HIV gp120 obalového gycoproteinu". Příroda. 393 (6686): 705–711. Bibcode:1998 Natur.393..705W. doi:10.1038/31514. PMID 9641684.
- ^ Novitsky V, Lagakos S, Herzig M, Bonney C, Kebaabetswe L, Rossenkhan R, Nkwe D, Margolin L, Musonda R, Moyo S, Woldegabriel E, van Widenfelt E, Makhema J, Essex M (leden 2009). „Vývoj proviru gp120 během prvního roku infekce HIV-1 podtypu C“. Virologie. 383 (1): 47–59. doi:10.1016 / j.virol.2008.09.017. PMC 2642736. PMID 18973914.
- ^ Wood N, Bhattacharya T, Keele BF, Giorgi E, Liu M, Gaschen B, Daniels M, Ferrari G, Haynes BF, McMichael A, Shaw GM, Hahn BH, Korber B, Seoighe C (květen 2009). „Vývoj HIV v časné infekci: selekční tlaky, vzorce inzerce a delece a dopad APOBECU“. PLOS Pathog. 5 (5): e1000414. doi:10.1371 / journal.ppat.1000414. PMC 2671846. PMID 19424423.
- ^ A b Korber, Bette; Kuiken, Carla; Haigwood, Nancy; Foley, Brian; Blay, Wendy; Gaschen, Brian; Zhang, Ming (01.12.2004). „Sledování globálních vzorců variace místa N-vázaného glykosylace u vysoce variabilních virových glykoproteinů: HIV, SIV a HCV obálky a chřipkový hemaglutinin“. Glykobiologie. 14 (12): 1229–1246. doi:10.1093 / glycob / cwh106. ISSN 0959-6658. PMID 15175256.
- ^ Liu Y, Curlin ME, Diem K, Zhao H, Ghosh AK, Zhu H, Woodward AS, Maenza J, Stevens CE, Stekler J, Collier AC, Genowati I, Deng WZioni R, Corey L, Zhu T, Mullins JI (květen 2008). „Délka Env a N-vázaná glykosylace po přenosu virů lidské imunodeficience typu 1 podtypu B“. Virologie. 374 (2): 229–33. doi:10.1016 / j.virol.2008.01.029. PMC 2441482. PMID 18314154.
- ^ Pantophlet R, Burton DR (2006). „GP120: cíl pro neutralizaci protilátek HIV-1“. Annu. Rev. Immunol. 24: 739–69. doi:10.1146 / annurev.immunol.24.021605.090557. PMID 16551265.
- ^ A b Frost SD, Wrin T, Smith DM, Kosakovsky Pond SL, Liu Y, Paxinos E, Chappey C, Galovich J, Beauchaine J, Petropoulos CJ, Little SJ, Richman DD (prosinec 2005). „Neutralizující protilátkové reakce řídí vývoj obalu viru lidské imunodeficience typu 1 během nedávné infekce HIV“. Proc. Natl. Acad. Sci. USA. 102 (51): 18514–9. Bibcode:2005PNAS..10218514F. doi:10.1073 / pnas.0504658102. PMC 1310509. PMID 16339909.
- ^ Barbas CF, Björling E, Chiodi F, Dunlop N, Cababa D, Jones TM, Zebedee SL, Persson MA, Nara PL, Norrby E (říjen 1992). "Rekombinantní lidské fragmenty Fab neutralizují lidský virus imunodeficience typu 1 in vitro". Proc. Natl. Acad. Sci. USA. 89 (19): 9339–43. Bibcode:1992PNAS ... 89,9339B. doi:10.1073 / pnas.89.19.9339. PMC 50122. PMID 1384050.
- ^ Zhou T, Xu L, Dey B, Hessell AJ, Van Ryk D, Xiang SH, Yang X, Zhang MY, Zwick MB, Arthos J, Burton DR, Dimitrov DS, Sodroski J, Wyatt R, Nabel GJ, Kwong PD (2007 ). „Strukturální definice konzervativního neutralizačního epitopu na HIV-1 gp120“. Příroda. 445 (7129): 732–737. Bibcode:2007 Natur.445..732Z. doi:10.1038 / nature05580. PMC 2584968. PMID 17301785.
- ^ Pantophlet, Ralph; Ollmann Saphire, Erica; Poignard, Pascal; Parren, Paul W. H. I .; Wilson, Ian A .; Burton, Dennis R. (01.01.2003). „Jemné mapování interakce neutralizujících a neneutralizujících monoklonálních protilátek s vazebným místem pro CD4 viru lidské imunodeficience typu 1 gp120“. Journal of Virology. 77 (1): 642–658. doi:10.1128 / jvi.77.1.642-658.2003. ISSN 0022-538X. PMC 140633. PMID 12477867.
- ^ Ashish, null; Solanki, Ashish K .; Boone, Christopher D .; Krueger, Joanna K. (01.01.2010). „Globální struktura protilátky neutralizující HIV-1 IgG1 b12 je asymetrická“. Sdělení o biochemickém a biofyzikálním výzkumu. 391 (1): 947–951. doi:10.1016 / j.bbrc.2009.11.170. ISSN 1090-2104. PMID 19995532.
- ^ Solanki, Ashish K .; Rathore, Yogendra S .; Badmalia, Maulik D .; Dhoke, Reema R .; Nath, Samir K .; Nihalani, Deepak; Ashish (12. 12. 2014). „Účinnost globálních tvarů a vazeb na ligandy protilátek neutralizujících HIV-1 se liší od účinnosti protilátek, které nemohou neutralizovat HIV-1“. The Journal of Biological Chemistry. 289 (50): 34780–34800. doi:10,1074 / jbc.M114,563486. ISSN 0021-9258. PMC 4263879. PMID 25331945.
- ^ Chien, Peter C .; Cohen, Sandra; Kleeberger, Cynthia; Giorgi, Janis; Phair, John; Zolla-Pazner, Susan; Hioe, Catarina E. (2002-07-15). „Vysoké hladiny protilátek proti CD4 vazebné doméně glykoproteinu 120 typu 1 viru lidské imunodeficience jsou spojeny s rychlejší progresí onemocnění“. The Journal of Infectious Diseases. 186 (2): 205–213. doi:10.1086/341297. ISSN 0022-1899. PMID 12134256.
- ^ aidsinfo.nih.gov/drugs/508/bms-663068/0/professional
- ^ Bachis A, Avdoshina V, Zecca L, Parsadanian M, Mocchetti I (2012). „Virus lidské imunodeficience typu 1 mění zpracování neurotrofních faktorů odvozených od mozku v neuronech“. The Journal of Neuroscience. 32 (28): 9477–9484. doi:10.1523 / JNEUROSCI.0865-12.2012. PMC 3408006. PMID 22787033.
- ^ Thomas S, Mayer L., Sperber K (2009). „Mitochondrie ovlivňují expresi Fas v apoptóze neuronových buněk indukovanou gp120“. Int. J. Neurosci. 119 (2): 157–65. doi:10.1080/00207450802335537. PMID 19125371.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Cena TO, Ercal N, Nakaoke R, Banks WA (květen 2005). „Virové proteiny HIV-1 gp120 a Tat indukují oxidační stres v endoteliálních buňkách mozku“. Brain Res. 1045 (1–2): 57–63. doi:10.1016 / j.brainres.2005.03.031. PMID 15910762.
- ^ Yang B, Akhter S, Chaudhuri A, Kanmogne GD (březen 2009). „HIV-1 gp120 indukuje expresi cytokinů, adhezi leukocytů a transmigraci přes hematoencefalickou bariéru: modulační účinky signalizace STAT1“. Microvasc. Res. 77 (2): 212–9. doi:10.1016 / j.mvr.2008.11.003. PMC 3715090. PMID 19103208.
Další čtení
- Glykoprotein viru lidské imunodeficience 120
- Vashistha H, Husain M, Kumar D, Singhal PC (2009). „Exprese tubulárních buněk HIV-1 gp120 indukuje aktivaci kaspázy 8 a apoptózu“. Ren Fail. 31 (4): 303–12. doi:10.1080/08860220902780101. PMID 19462280.
externí odkazy
- https://web.archive.org/web/20060219135317/http://www.aidsmap.com/en/docs/4406022B-85D7-4A9B-B700-91336CBB6B18.asp
- http://www.mcld.co.uk/hiv/?q=gp120
- http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000777
- Vashistha, H .; Husain, M .; Kumar, D .; Singhal, P. C. (2009). „Exprese tubulárních buněk HIV-1 gp120 indukuje aktivaci kaspázy 8 a apoptózu“. Selhání ledvin. 31 (4): 303–312. doi:10.1080/08860220902780101. PMID 19462280.
