Cyklopentadienid sodný - Sodium cyclopentadienide
 | |||
 | |||
| |||
 Cyklopentadienidový anion | |||
| Jména | |||
|---|---|---|---|
| Ostatní jména cyklopentadienylid sodný, cyklopentadienylsodný | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.023.306 | ||
| Číslo ES |
| ||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H5Na | |||
| Molární hmotnost | 88.085 g · mol−1 | ||
| Vzhled | bezbarvá pevná látka | ||
| Hustota | 1,113 g / cm3 | ||
| rozklad | |||
| Rozpustnost | THF | ||
| Nebezpečí | |||
| Hlavní nebezpečí | hořlavý | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Cyklopentadienid sodný je organosodná sloučenina s vzorec C5H5Na. Sloučenina je často zkrácena jako NaCp, kde Cp− je anion cyklopentadienidu.[1] Cyklopentadienid sodný je bezbarvá pevná látka, i když vzorky jsou kvůli stopám oxidovaných nečistot často růžové.[2]
Příprava
Cyklopentadienid sodný je komerčně dostupný jako roztok v THF. Připravuje se zpracováním cyklopentadien s sodík:[3]
- 2 Na + 2 ° C5H6 → 2 NaC5H5 + H2
Obvykle se konverze provádí zahříváním suspenze roztaveného sodíku v dicyklopentadien.[2] V minulosti se sodík běžně dodával ve formě „sodíkového drátu“ nebo „sodného písku“, jemné disperze sodíku připravené tavením sodíku za refluxu xylen a rychle se míchá.[4][5] Hydrid sodný je vhodný základ:[6]
- NaH + C.5H6 → NaC5H5 + H2
V rané práci Grignardova činidla byly použity jako základy. S pK.A z 15 může být cyklopentadien deprotonován mnoha činidly.
Aplikace
Cyklopentadienid sodný je běžným činidlem pro přípravu substituovaných cyklopentadienylových solí, jako jsou estery a formylové sloučeniny NaC5H4X (CO.)2Já, CHO):[7]
- NaC5H5 + HCO2R → NaC5H4CHO + ROH
Cyklopentadienid sodný je běžným činidlem pro přípravu metaloceny. Například příprava ferrocen[4] a chlorid zirkonocen:[8]
- 2 NaC5H5 + FeCl2 → Fe (C.5H5)2 + 2 NaCl
- ZrCl4(thf)2 + 2 NaCp → Cp2ZrCl2 + 2 NaCl + 2 THF
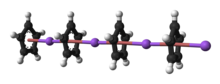
Struktura
Povaha NaCp silně závisí na jeho médiu a pro účely plánování syntéz je činidlo často reprezentováno jako sůl Na+
C
5H−
5. NaCp bez krystalického rozpouštědla, se kterým se setkáváme jen zřídka, je „polydecker“ sendvičový komplex, skládající se z nekonečného řetězce střídavého Na+ středy vložené mezi μ -η5:η5-C5H5 ligandy.[9] Jako roztok v donorových rozpouštědlech je NaCp vysoce solvatovaný, zejména na alkalickém kovu, jak naznačuje izolabilita adukt Na (tmeda ) Str.[10]
Na rozdíl od cyklopentadienidů alkalických kovů tetrabutylamonium cyklopentadienid (Bu4N+C5H5−) bylo zjištěno, že je zcela podporován iontovou vazbou a jeho struktura je reprezentativní pro strukturu anionu cyklopentadienidu (C5H5−, Str−) v pevném stavu. Anion se však poněkud odchyluje od rovinného pravidelného pětiúhelníku, přičemž délky vazeb C – C se pohybují v rozmezí 138,0–140,1 pm a úhly vazeb C – C – C v rozmezí 107,5–108,8 °.[11]
Viz také
Reference
- ^ Mezinárodní unie pro čistou a aplikovanou chemii (2005). Nomenklatura anorganické chemie (Doporučení IUPAC 2005). Cambridge (Velká Británie): RSC –IUPAC. ISBN 0-85404-438-8. p. 262. Elektronická verze.
- ^ A b Tarun K. Panda, Michael T. Gamer, Peter W. Roesky „Vylepšená syntéza cyklopentadienidu sodného a draselného“, Organometallics, 2003, 22, 877–878.doi:10.1021 / om0207865
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988), Pokročilá anorganická chemie (5. vydání), New York: Wiley-Interscience, str. 139, ISBN 0-471-84997-9
- ^ A b Wilkinson, Geoffrey (1963). "Ferrocen". Organické syntézy.; Kolektivní objem, 4, str. 473
- ^ Partridge, John J .; Chadha, Naresh K .; Uskokovič, Milan R. (1990). „Asymetrická hydroborace 5-substituovaných cyklopentadienů: syntéza methylu (1R,5R) -5-hydroxy-2-cyklopenten-1 -acetát ". Organické syntézy.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 7, str. 339
- ^ Girolami, G. S .; Rauchfuss, T. B. & Angelici, R. J. (1999). Syntéza a technika v anorganické chemii. CA: University Science Books: Mill Valley. ISBN 0935702482.
- ^ Macomber, D. W .; Hart, W. P .; Rausch, M. D. (1982). "Funkčně substituované cyklopentadienylové kovové sloučeniny". Adv. Organomet. Chem. Pokroky v organokovové chemii. 21: 1–55. doi:10.1016 / S0065-3055 (08) 60377-9. ISBN 9780120311217.
- ^ Wilkinson, G.; Birmingham, J. G. (1954). "Bis-cyklopentadienylové sloučeniny Ti, Zr, V, Nb a Ta". J. Am. Chem. Soc. 76 (17): 4281–84. doi:10.1021 / ja01646a008.
- ^ Robert E. Dinnebier; Ulrich Behrens & Falk Olbrich (1997). "Struktury v pevné fázi cyklopentadienyllithia, sodíku a draslíku. Stanovení práškovou difrakcí s vysokým rozlišením". Organometallics. 16: 3855–3858. doi:10.1021 / om9700122.
- ^ Elschenbroich, C. (2006). Organometallics. Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2.
- ^ Reetz, Manfred T .; Hütte, Stephan; Goddard, Richard (01.03.1995). „Tetrabutylamoniové soli 2-nitropropanu, cyklopentadienu a 9-ethylfluorenu: krystalová struktura a použití při aniontové polymeraci“. Zeitschrift für Naturforschung B. 50 (3): 415–422. doi:10.1515 / znb-1995-0316. ISSN 1865-7117.


