CUL4A - CUL4A
Cullin-4A je protein že u lidí je kódován CUL4A gen.[4][5] CUL4A patří do cullin rodina ubikvitin ligáza proteiny a je vysoce homologní s CUL4B protein. CUL4A reguluje řadu klíčových procesů, jako je oprava DNA, remodelace chromatinu, spermatogeneze, krvetvorba a mitotický buněčný cyklus. Ve výsledku se CUL4A podílí na několika rakovinách a patogeneze některých virů včetně HIV. Bylo zjištěno, že součást komplexu CUL4A, Cereblon, je hlavním terčem teratogenního činidla thalidomid.
Struktura
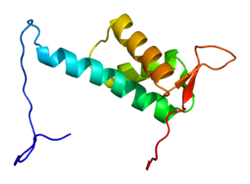
Protein CUL4A je dlouhý 759 aminokyselin a tvoří rozšířenou, tuhou strukturu, která se primárně skládá z alfa-šroubovice. Na N-konec, CUL4A se váže na beta-vrtule z DDB1 adaptační protein, který interaguje s mnoha faktory spojenými s DDB1-CUL4 (DCAF). Ve výsledku je N-konec rozhodující pro nábor substrátů pro ubikvitin ligáza komplex. Na C-terminál konec, CUL4A interaguje s RBX1 / ROC1 protein prostřednictvím RING doména. RBX1 je základní složkou komplexů Cullin-RING ubikvitin ligázy (CRL) a funkcí pro nábor Enzymy konjugující s E2 ubikvitinem. Proto C-konec CUL4A - spolu s RBX1 a aktivovanými enzymy E2 - tvoří katalytické jádro komplexů CRL4. CUL4A je také modifikován kovalentním připojením a NEDD8 molekula na vysoce konzervovaném lysinovém zbytku v C-koncové oblasti. Zdá se, že tato modifikace vyvolává konformační změny, které podporují flexibilitu v doméně RING cullin proteiny a zvýšenou aktivitu ubikvitin ligázy.[6]
Celkově mají komplexy CRL4A modulární strukturu, která umožňuje sofistikovanou regulaci buňkou a vliv na četné substráty a procesy v buňce. Ačkoli se jednotlivé části liší, všechny ubikvitinové ligázy na bázi cullinu vykazují tyto vlastnosti.[7]
Funkce
Poškození a oprava DNA
Protein adaptéru DDB1 byl původně charakterizován jako velká podjednotka heterodimerního komplexu (UV-DDB), u kterého bylo zjištěno, že rozpoznává poškozenou DNA a účastní se formou opravy známé jako oprava nukleotidové excize (NER). Menší podjednotka tohoto poškozeného proteinového komplexu vázajícího DNA je známá jako DDB2 a je schopen přímo vázat léze DNA spojené s UV zářením. DDB2 je protein DCAF a je ubikvitinačním substrátem komplexu CRL4 a také slouží jako protein E3 ligázy pro jiné substráty, jako je XPC a histony (viz následující část) poblíž místa poškození.[8] Díky své ubikvitinaci proteinů DDB2 a XPC rozpoznávajících poškození DNA byl CUL4A popsán jako negativní regulátor aktivity NER.[9][10] Kromě „globálního“ typu NER se zdá, že komplex CRL4A hraje roli také v „transkripčně vázaném“ NER ve spojení s Cockaynův syndrom A protein.[11] Zdá se, že komplexy CRL4A jsou aktivovány určitými typy poškození DNA (zejména UV zářením) a několik substrátů je po indukci poškození DNA přednostně ubikvitinováno.
Přestavba chromatinu
Role CUL4A v modifikaci chromatinu do značné míry souvisí s opravnými aktivitami DNA a nastává po indukci poškození DNA. Jak CUL4A, tak jeho blízce příbuzný homolog CUL4B mohou ubikvitinovat histony H2A, H3 a H4.[12][13] Homolog kvasinek CUL4A, Rtt101, ubikvitinuje histon H3 a podporuje nukleosom shromáždění a komplexy CRL4A plní podobné funkce v lidských buňkách.[14] Komplexy CRL4 také ovlivňují dějiny methylace histonu a strukturu chromatinu regulací histonmethyltransferázy.[15] Histon H4 monomethyláza PR-Set7 / SET8 je ubikvitinován na chromatinu komplexy CRL4 (Cdt2) během S fáze a po poškození DNA v PCNA -závislým způsobem.[16][17][18]
Regulace buněčného cyklu a replikace DNA
CRL4A komplexy regulují vstup do fáze syntézy DNA, nebo S fáze mitotického cyklu regulací úrovní exprese proteinu proteinu faktoru licenčního replikace Cdt1 a inhibitor cyklin-dependentní kinázy p21. V obou případech využívá CRL4A Cdt2 jako DCAF vázat oba substráty způsobem závislým na PCNA. Během nerušeného postupu buněčného cyklu, ubikvitinace a downregulace těchto proteinů pomocí CRL4ACdt2 nastává na počátku replikace DNA. Poškození DNA, jako je UV záření, také indukuje CRL4ACdt2- zprostředkovaná destrukce těchto proteinů. Oba substráty jsou rovněž regulovány SCFSkp2 komplex.
CRL4 zprostředkovaná destrukce uvolnění p21 cyklin E -CDK2 inhibice a podporuje vstup do S fáze. Ztráta exprese Cdt2 zvyšuje expresi p21 v buňkách a stabilizuje p21 po UV záření.[19] CUL4A delece vede k opožděnému vstupu S fáze do myších embryonálních fibroblastů, který je zachráněn delecí p21.[10] V lidských retinálních buňkách pigmentového epitelu vede ztráta exprese Cdt2 také k p21 závislému zpožděnému vstupu do S-fáze a k opětovné expresi p21 v S-fázi, což vede k cyklům neúplné replikace, dlouhodobé akumulaci p21 a v některých případech indukce apoptózy.[20]
Po podpoře zahájení replikace eukaryotické DNA na původ, Cdt1 je deaktivován Geminin a zaměřené na degradaci SCFSkp2 a CRL4Cdt2 komplexy. Exprese Cdt1 je stabilizována pomocí RNAi zprostředkovaného knockdownu DDB1 nebo obou CUL4A a CUL4B, což naznačuje redundantní nebo překrývající se funkci dvou proteinů CUL4 pro regulaci Cdt1.[21][22] Zdá se, že pouze snížení exprese gemininu indukuje re-replikaci v buňkách nadměrně exprimujících Cdt1.
CRL4 také využívají Cdt2 a PCNA k degradaci p12 podjednotky DNA polymeráza δ během S fáze a po UV záření.[23]
Krvetvorba
Zdá se, že komplexy CRL4A indukují degradaci mnoha členů HOX rodina transkripce, které jsou základními regulátory hematopoézy.[24] Prvním členem rodiny HOX identifikovaným jako cíl degradace zprostředkované CRL4A je HOXA9, který je nezbytný pro udržení hematopoetických kmenových buněk a byl zahrnut v podskupině myeloidní leukémie.[25][26] HOXA9 degron leží uvnitř homeodomain, což je zásadní pro vazbu DNA. Sekvenční srovnávací studie ukázaly, že v helixu jedné z homeodomény je vysoce konzervativní motiv „LEXE“. Když bylo mutováno více aminokyselin v tomto motivu, HOXB4 se stal rezistentním vůči degradaci zprostředkované CRL4A.[24] Substrátový receptor nebo DCAF požadovaný pro degradaci proteinu HOX zůstává neznámý.
Spermatogeneze a meióza
The Cul4a gen je vyžadován pro normální spermatogeneze a redukční dělení buněk v mužských zárodečných buňkách myší.[27][28] Cul4a−/− muži produkují abnormální spermie a jsou neplodní. Zatímco CUL4A i CUL4B jsou exprimovány v mužských gametách, CUL4A je vysoce exprimován v pachytenes a diplotenes. Právě v těchto stádiích vykazují mužské zárodečné buňky s nedostatkem CUL4A vysokou hladinu apoptóza, nevhodný Oprava DNA a akumulace substrátu CRL4 Cdt1.
Dysregulace
Rakovina
Chromozomální oblast ch13q34, která obsahuje CUL4A gen je amplifikován u 3–6% jistých karcinomy včetně: rakoviny prsu, dělohy, plic, žaludku a tlustého střeva a konečníku.[29] CUL4A je také mutován nebo amplifikován asi ve 4% melanomy (ačkoli mutace jsou rozptýleny a jednotlivé mutace se vyskytují sporadicky).
U modelů myší Cul4a vyřazení mělo za následek výraznou odolnost proti karcinogenezi kůže vyvolané UV zářením.[10] Cre -indukovaný Cul4a byla podporována nadměrná exprese v plicní tkáni myší hyperplazie.[30]
Kvůli pozorovanému zesílení CUL4A u několika karcinomů a skutečnost, že komplexy CRL4 se zaměřují na mnohonásobné opravy DNA a geny potlačující nádory, CUL4A lze považovat za onkogen v určitých kontextech.
Virová patogeneze
Díky své robustní expresi (zejména během replikace DNA) a modulární povaze mohou být komplexy CRL4A kooptovány nebo "uneseny", aby podporovaly virovou proliferaci v savčích buňkách.
Určitý paramyxoviry vyhnout se interferon reakce v buňkách cílením STAT1 a narušení signalizace. Lidský virus parainfluenzy opičího viru 5 a typu II exprimuje protein s názvem „V“, který funguje jako substrátový receptor a přemosťuje interakci mezi proteiny DDB1 a STAT (struktura CRL4ASV5V komplex je zobrazen na vložce) - což indukuje ubikvitinaci a degradaci STAT1[31][32]
DCAF1 je také pojmenován VPRBP kvůli jeho interakci s HIV-1 proteinem Vpr. Ačkoli se zdá, že DCAF1 / VPRBP má rozhodující funkci při potlačení nádoru, replikaci DNA a vývoji embryí, HIV-1 „unese“ ubikvitin ligázový komplex, aby vyvolal zastavení buněčného cyklu v Fáze G2.[33][34][35] CRL4ADCAF1-Vpr indukuje ubikvitinaci jaderné izoformy uracil-DNA glykosyláza.[36][37] Zdá se, že HIV-2 také využívá CRL4ADCAF1 přes Vpx proteinem indukovaná destrukce pojmenované deoxynukleosid trifosfohydrolázy inhibující lentivirus SAMHD1.[38][39]
Léčba thalidomidem
V roce 2010 Ito a kol. uvádí, že Cereblon, DCAF protein, byl hlavním terčem teratogenní sloučeniny thalidomidu.[40] Thalidomid a další deriváty, jako např pomalidomid a lenalidomid jsou známé jako imunomodulační léky (nebo IMiD) a byly zkoumány jako terapeutické látky pro autoimunitní onemocnění a několik druhů rakoviny - zejména myelomů. Nedávné zprávy ukazují, že IMiD se vážou na CRL4CRBN a podporovat degradaci transkripčních faktorů IKZF1 a IKZF3, na které se komplexy CRL4 normálně nezaměřují.[41][42]
Interakce a substráty
Lidský CUL4A se formuje přímo interakce s:
Lidské komplexy CUL4A-DDB1-RBX1 podporují ubikvitinaci:
†protein je substrátem CRL4A, pouze pokud je směrován virovými proteiny
§protein je substrátem CRL4A, pouze pokud je řízen IMiD
Poznámky
Verze tohoto článku z roku 2015 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Jeffrey Hannah, Pengbo Zhou (15. listopadu 2015). „Výrazné a překrývající se funkce proteinů lešení Cull4 E3 ligázy CUL4A a CUL4B“. Gen. 573 (1): 33–45. doi:10.1016 / J.GENE.2015.08.064. PMC 5110433. PMID 26344709.CS1 maint: používá parametr autoři (odkaz) |
Reference
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000031446 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Kipreos ET, Lander LE, Wing JP, He WW, Hedgecock EM (červen 1996). „cul-1 je vyžadován pro opuštění buněčného cyklu u C. elegans a identifikuje novou genovou rodinu“. Buňka. 85 (6): 829–39. doi:10.1016 / S0092-8674 (00) 81267-2. PMID 8681378. S2CID 15805562.
- ^ „Entrez Gene: CUL4A Cullin 4A“.
- ^ Duda DM, Borg LA, Scott DC, Hunt HW, Hammel M, Schulman BA (září 2008). „Strukturální pohledy na NEDD8 aktivaci cullin-RING ligáz: konformační kontrola konjugace“. Buňka. 134 (6): 995–1006. doi:10.1016 / j.cell.2008.07.022. PMC 2628631. PMID 18805092.
- ^ Bosu DR, Kipreos ET (2008). „Cullin-RING ubikvitinové ligázy: globální regulační a aktivační cykly“. Buněčné dělení. 3: 7. doi:10.1186/1747-1028-3-7. PMC 2266742. PMID 18282298.
- ^ A b Sugasawa K, Okuda Y, Saijo M, Nishi R, Matsuda N, Chu G, Mori T, Iwai S, Tanaka K, Tanaka K, Hanaoka F (květen 2005). „UV-indukovaná ubikvitylace XPC proteinu zprostředkovaná komplexem UV-DDB-ubikvitin ligáza“. Buňka. 121 (3): 387–400. doi:10.1016 / j.cell.2005.02.035. PMID 15882621. S2CID 16773579.
- ^ Chen X, Zhang J, Lee J, Lin PS, Ford JM, Zheng N, Zhou P (květen 2006). „Funkce c-Abl nezávislá na kináze při podpoře proteolytické destrukce poškozených proteinů vázajících DNA“. Molekulární buňka. 22 (4): 489–99. doi:10.1016 / j.molcel.2006.04.021. PMID 16713579.
- ^ A b C d Liu L, Lee S, Zhang J, Peters SB, Hannah J, Zhang Y, Yin Y, Koff A, Ma L, Zhou P (květen 2009). „Abrogace CUL4A zvyšuje reakci na poškození DNA a ochranu proti karcinogenezi kůže“. Molekulární buňka. 34 (4): 451–60. doi:10.1016 / j.molcel.2009.04.020. PMC 2722740. PMID 19481525.
- ^ Hannah J, Zhou P (duben 2009). „Regulace odezvy na poškození DNA pomocí ubikvitinových ligáz cullin-RING“. Oprava DNA. 8 (4): 536–43. doi:10.1016 / j.dnarep.2009.01.011. PMC 2858918. PMID 19231300.
- ^ Guerrero-Santoro J, Kapetanaki MG, Hsieh CL, Gorbachinsky I, Levine AS, Rapić-Otrin V (červenec 2008). „Cullin 4B na bázi UV poškození DNA vazebné proteinové ligázy se váže na UV poškozený chromatin a ubikvitinuje histon H2A“. Výzkum rakoviny. 68 (13): 5014–22. doi:10.1158 / 0008-5472.CAN-07-6162. PMID 18593899.
- ^ Wang H, Zhai L, Xu J, Joo HY, Jackson S, Erdjument-Bromage H, Tempst P, Xiong Y, Zhang Y (květen 2006). „Ubiquitylace histonu H3 a H4 ubikvitinovou ligázou CUL4-DDB-ROC1 usnadňuje buněčnou reakci na poškození DNA“. Molekulární buňka. 22 (3): 383–94. doi:10.1016 / j.molcel.2006.03.035. PMID 16678110.
- ^ Han J, Zhang H, Zhang H, Wang Z, Zhou H, Zhang Z (listopad 2013). „Ubikvitin ligáza Cul4 E3 reguluje předávání histonů během sestavování nukleosomů“. Buňka. 155 (4): 817–29. doi:10.1016 / j.cell.2013.10.014. PMC 3994564. PMID 24209620.
- ^ Higa LA, Wu M, Ye T, Kobayashi R, Sun H, Zhang H (listopad 2006). „Ubikvitinová ligáza CUL4-DDB1 interaguje s více proteiny opakujícími se WD40 a reguluje methylaci histonu“. Přírodní buněčná biologie. 8 (11): 1277–83. doi:10.1038 / ncb1490. hdl:10397/34293. PMID 17041588. S2CID 22180568.
- ^ A b Jørgensen S, Eskildsen M, Fugger K, Hansen L, Larsen MS, Kousholt AN, Syljuåsen RG, Trelle MB, Jensen ON, Helin K, Sørensen CS (leden 2011). „SET8 je degradován prostřednictvím PCNA-vázané CRL4 (CDT2) ubikvitylace ve S fázi a po UV ozařování“. The Journal of Cell Biology. 192 (1): 43–54. doi:10.1083 / jcb.201009076. PMC 3019552. PMID 21220508.
- ^ A b Tardat M, Brustel J, Kirsh O, Lefevbre C, Callanan M, Sardet C, Julien E (listopad 2010). „Histon H4 Lys 20 methyltransferáza PR-Set7 reguluje počátky replikace v savčích buňkách“. Přírodní buněčná biologie. 12 (11): 1086–93. doi:10.1038 / ncb2113. PMID 20953199. S2CID 6710289.
- ^ A b Oda H, Hübner MR, Beck DB, Vermeulen M, Hurwitz J, Spector DL, Reinberg D (listopad 2010). „Regulace histonové H4 monomethylázy PR-Set7 degradací PCNA závislou na CRL4 (Cdt2) během poškození DNA“. Molekulární buňka. 40 (3): 364–76. doi:10.1016 / j.molcel.2010.10.011. PMC 2999913. PMID 21035370.
- ^ A b Abbas T, Sivaprasad U, Terai K, Amador V, Pagano M, Dutta A (září 2008). „PCNA-závislá regulace ubikvitilace a degradace p21 prostřednictvím ubikvitinového komplexu CRL4Cdt2“. Geny a vývoj. 22 (18): 2496–506. doi:10.1101 / gad.1676108. PMC 2546691. PMID 18794347.
- ^ Barr, Alexis R .; Cooper, Samuel; Heldt, Frank S .; Butera, Francesca; Stoy, Henriette; Mansfeld, Jörg; Novák, Béla; Bakal, Chris (2017). „Poškození DNA během S-fáze zprostředkovává rozhodnutí proliferace - klid v následující G1 prostřednictvím exprese p21“. Příroda komunikace. 8: 14728. Bibcode:2017NatCo ... 814728B. doi:10.1038 / ncomms14728. PMC 5364389. PMID 28317845.
- ^ A b Higa LA, Mihaylov IS, Banks DP, Zheng J, Zhang H (listopad 2003). "Radiačně zprostředkovaná proteolýza CDT1 komplexy CUL4-ROC1 a CSN představuje nový kontrolní bod". Přírodní buněčná biologie. 5 (11): 1008–15. doi:10.1038 / ncb1061. PMID 14578910. S2CID 26070877.
- ^ A b Hu J, Xiong Y (únor 2006). „Evolučně konzervovaná funkce proliferujícího buněčného jaderného antigenu pro degradaci Cdt1 ligandem ubikvitin Cul4-Ddb1 v reakci na poškození DNA“. The Journal of Biological Chemistry. 281 (7): 3753–6. doi:10,1074 / jbc.C500464200. PMID 16407242.
- ^ A b Zhang S, Zhao H, Darzynkiewicz Z, Zhou P, Zhang Z, Lee EY, Lee MY (2013). „Nová funkce CRL4 (Cdt2): regulace struktury podjednotky DNA polymerázy δ v reakci na poškození DNA a během fáze S“. J. Biol. Chem. 288 (41): 29550–61. doi:10.1074 / jbc.M113.490466. PMC 3795253. PMID 23913683.
- ^ A b C Lee J, Shieh JH, Zhang J, Liu L, Zhang Y, Eom JY, Morrone G, Moore MA, Zhou P (květen 2013). „Vylepšená ex vivo expanze dospělých hematopoetických kmenových buněk překonáním degradace HOXB4 zprostředkované CUL4“. Krev. 121 (20): 4082–9. doi:10.1182 / krev-2012-09-455204. PMC 3656448. PMID 23520338.
- ^ A b Zhang Y, Morrone G, Zhang J, Chen X, Lu X, Ma L, Moore M, Zhou P (listopad 2003). „CUL-4A stimuluje ubikvitylaci a degradaci proteinu homeodomény HOXA9“. Časopis EMBO. 22 (22): 6057–67. doi:10.1093 / emboj / cdg577. PMC 275435. PMID 14609952.
- ^ Lawrence, H. J .; Christensen, J .; Fong, S .; Hu, Y. L .; Weissman, I .; Sauvageau, G .; Humphries, R. K .; Largman, C. (2005). „Ztráta exprese genu homeoboxu Hoxa-9 zhoršuje proliferační a repopulační schopnost hematopoetických kmenových buněk“. Krev. 106 (12): 3988–3994. doi:10.1182 / krev-2005-05-2003. PMC 1895111. PMID 16091451.
- ^ Yin Y, Lin C, Kim ST, Roig I, Chen H, Liu L, Veith GM, Jin RU, Keeney S, Jasin M, Moley K, Zhou P, Ma L (2011). „E3 ubikvitinová ligáza Cullin 4A reguluje meiotickou progresi v spermatogenezi myší“. Dev. Biol. 356 (1): 51–62. doi:10.1016 / j.ydbio.2011.05.661. PMC 3130830. PMID 21624359.
- ^ Kopanja D, Roy N, Stoyanova T, Hess RA, Bagchi S, Raychaudhuri P (2011). „Cul4A je nezbytný pro spermatogenezi a mužskou plodnost“. Dev. Biol. 352 (2): 278–87. doi:10.1016 / j.ydbio.2011.01.028. PMC 3065526. PMID 21291880.
- ^ „cBioPortal for Cancer Genomics“. Archivovány od originál dne 2015-05-21.
- ^ Li T, Hung MS, Wang Y, Mao JH, Tan JL, Jahan K, Roos H, Xu Z, Jablons DM, You L (březen 2011). "Transgenní myši pro Cre-indukovatelnou nadměrnou expresi genu Cul4A". Genesis. 49 (3): 134–41. doi:10.1002 / dvg.20708. PMC 3285554. PMID 21381181.
- ^ A b Ulane CM, Kentsis A, Cruz CD, Parisien JP, Schneider KL, Horvath CM (srpen 2005). „Složení a sestavení komplexů ubiquitin ligasy zaměřených na STAT: karboxylový konec paramyxovirového proteinu V je oligomerizační doménou“. Journal of Virology. 79 (16): 10180–9. doi:10.1128 / JVI.79.16.10180-10189.2005. PMC 1182666. PMID 16051811.
- ^ A b Precious B, Childs K, Fitzpatrick-Swallow V, Goodbourn S, Randall RE (listopad 2005). „5 V protein opičího viru funguje jako adaptér, který spojuje DDB1 se STAT2, aby usnadnil ubikvitinaci STAT1“. Journal of Virology. 79 (21): 13434–41. doi:10.1128 / JVI.79.21.13434-13441.2005. PMC 1262611. PMID 16227264.
- ^ McCall CM, Miliani de Marval PL, Chastain PD, Jackson SC, He YJ, Kotake Y, Cook JG, Xiong Y (září 2008). „Virus lidské imunodeficience typu 1 Vpr vazebný protein VprBP, protein WD40 spojený s ubikvitinovou ligázou DDB1-CUL4 E3, je nezbytný pro replikaci DNA a vývoj embryí“. Molekulární a buněčná biologie. 28 (18): 5621–33. doi:10.1128 / MCB.00232-08. PMC 2546929. PMID 18606781.
- ^ Le Rouzic E, Belaïdouni N, Estrabaud E, Morel M, Rain JC, Transy C, Margottin-Goguet F (leden 2007). „HIV1 Vpr zastavuje buněčný cyklus náborem DCAF1 / VprBP, receptoru ubikvitin ligázy Cul4-DDB1“. Buněčný cyklus. 6 (2): 182–8. doi:10,4161 / cc.6.2.3732. PMID 17314515.
- ^ Wen, Xiaoyun; Duus, Karen M .; Friedrich, Thomas D .; De Noronha, Carlos M. C. (2007). „Protein HIV1 Vpr působí tak, že podporuje zastavení cyklu G2Cell zapojením komplexu ubikvitin ligázy obsahujícího DDB1 a Cullin4A s použitím VprBP / DCAF1 jako adaptéru“. Journal of Biological Chemistry. 282 (37): 27046–27057. doi:10,1074 / jbc.M703955200. PMID 17620334.
- ^ A b Ahn J, Vu T, Novince Z, Guerrero-Santoro J, Rapic-Otrin V, Gronenborn AM (listopad 2010). „HIV-1 Vpr načte uracilovou DNA glykosylázu-2 na DCAF1, podjednotku rozpoznávající substrát ubikvitinové ligázy cullinového 4A-kruhu E3 pro degradaci závislou na proteasomu“. The Journal of Biological Chemistry. 285 (48): 37333–41. doi:10.1074 / jbc.M110.133181. PMC 2988339. PMID 20870715.
- ^ A b Wen X, Casey Klockow L, Nekorchuk M, Sharifi HJ, de Noronha CM (2012). „Protein HIV1 Vpr působí na zvýšení konstitutivního DCAF1 závislého obratu UNG2“. PLOS ONE. 7 (1): e30939. Bibcode:2012PLoSO ... 730939W. doi:10.1371 / journal.pone.0030939. PMC 3265533. PMID 22292079.
- ^ A b Hofmann H, Logue EC, Bloch N, Daddacha W, Polsky SB, Schultz ML, Kim B, Landau NR (prosinec 2012). „Lentivirový doplňkový protein Vpx cílí na SAMHD1 pro degradaci v jádře“. Journal of Virology. 86 (23): 12552–60. doi:10.1128 / JVI.01657-12. PMC 3497686. PMID 22973040.
- ^ A b Ahn J, Hao C, Yan J, DeLucia M, Mehrens J, Wang C, Gronenborn AM, Skowronski J (duben 2012). „Virus HIV / opičí imunodeficience (SIV) doplňkový faktor virulence Vpx načte restrikční faktor hostitelské buňky SAMHD1 na komplex E3 ubikvitin ligázy CRL4DCAF1“. The Journal of Biological Chemistry. 287 (15): 12550–8. doi:10.1074 / jbc.M112.340711. PMC 3321004. PMID 22362772.
- ^ Ito, T .; Ando, H .; Suzuki, T .; Ogura, T .; Hotta, K .; Imamura, Y .; Yamaguchi, Y .; Handa, H. (2010). „Identifikace primárního cíle teratogenity thalidomidu“. Věda. 327 (5971): 1345–1350. Bibcode:2010Sci ... 327.1345I. doi:10.1126 / science.1177319. PMID 20223979. S2CID 17575104.
- ^ A b C Lu G, Middleton RE, Sun H, Naniong M, Ott CJ, Mitsiades CS, Wong KK, Bradner JE, Kaelin WG Jr (2014). „Myelomový lék lenalidomid podporuje destrukci proteinů Ikaros závislou na cereblonu“. Věda. 343 (6168): 305–9. Bibcode:2014Sci ... 343..305L. doi:10.1126 / science.1244917. PMC 4070318. PMID 24292623.
- ^ A b C Krönke J, Udeshi ND, Narla A, Grauman P, Hurst SN, McConkey M, Svinkina T, Heckl D, Comer E, Li X, Ciarlo C, Hartman E, Munshi N, Schenone M, Schreiber SL, Carr SA, Ebert BL (2014). „Lenalidomid způsobuje selektivní degradaci IKZF1 a IKZF3 v buňkách mnohočetného myelomu“. Věda. 343 (6168): 301–5. Bibcode:2014Sci ... 343..301K. doi:10.1126 / science.1244851. PMC 4077049. PMID 24292625.
- ^ Shiyanov P, Nag A, Raychaudhuri P (prosinec 1999). „Cullin 4A se asociuje s UV-poškozeným proteinem vázajícím DNA DDB“. The Journal of Biological Chemistry. 274 (50): 35309–12. doi:10.1074 / jbc.274.50.35309. PMID 10585395.
- ^ Dias DC, Dolios G, Wang R, Pan ZQ (prosinec 2002). "CUL7: Cullin obsahující doménu DOC se selektivně váže na Skp1.Fbx29 a vytváří komplex podobný SCF". Sborník Národní akademie věd Spojených států amerických. 99 (26): 16601–6. doi:10.1073 / pnas.252646399. PMC 139190. PMID 12481031.
- ^ Ohta T, Michel JJ, Schottelius AJ, Xiong Y (duben 1999). „ROC1, homolog APC11, představuje rodinu partnerů cullinu s přidruženou aktivitou ubikvitin ligázy“. Molekulární buňka. 3 (4): 535–41. doi:10.1016 / s1097-2765 (00) 80482-7. PMID 10230407.
- ^ Min KW, Hwang JW, Lee JS, Park Y, Tamura TA, Yoon JB (květen 2003). „TIP120A se asociuje s culliny a moduluje aktivitu ubikvitin ligázy“. The Journal of Biological Chemistry. 278 (18): 15905–10. doi:10,1074 / jbc.M213070200. PMID 12609982.
- ^ Serino G, Deng XW (2003). „Signalosom COP9: regulace vývoje rostlin kontrolou proteolýzy“ (PDF). Roční přehled biologie rostlin. 54: 165–82. doi:10.1146 / annurev.arplant.54.031902.134847. PMID 14502989.
- ^ Chen X, Zhang Y, Douglas L, Zhou P (prosinec 2001). „Proteiny vázající DNA poškozené UV zářením jsou cílem ubikvitinace a degradace zprostředkované CUL-4A“. The Journal of Biological Chemistry. 276 (51): 48175–82. doi:10,1074 / jbc.M106808200. PMID 11673459.
- ^ Nishitani H, Shiomi Y, Iida H, Michishita M, Takami T, Tsurimoto T (říjen 2008). „CDK inhibitor p21 je degradován cestou Cul4-DDB1Cdt2 spojenou s proliferujícím buněčným jaderným antigenem během S fáze a po UV záření“. The Journal of Biological Chemistry. 283 (43): 29045–52. doi:10,1074 / jbc.M806045200. PMC 2662008. PMID 18703516.
externí odkazy
- Člověk CUL4A umístění genomu a CUL4A stránka s podrobnostmi o genu v UCSC Genome Browser.
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: Q13619 (Cullin-4A) u PDBe-KB.
Další čtení
- Osaka F, Kawasaki H, Aida N, Saeki M, Chiba T, Kawashima S, Tanaka K, Kato S (srpen 1998). „Nový ligační systém NEDD8 pro cullin-4A“. Geny a vývoj. 12 (15): 2263–8. doi:10.1101 / gad.12.15.2263. PMC 317039. PMID 9694792.
- Chen LC, Manjeshwar S, Lu Y, Moore D, Ljung BM, Kuo WL, Dairkee SH, Wernick M, Collins C, Smith HS (srpen 1998). „Lidský homolog pro gen Caenorhabditis elegans cul-4 je amplifikován a nadměrně exprimován u primárních karcinomů prsu“. Výzkum rakoviny. 58 (16): 3677–83. PMID 9721878.
- Ohta T, Michel JJ, Schottelius AJ, Xiong Y (duben 1999). „ROC1, homolog APC11, představuje rodinu partnerů cullinu s přidruženou aktivitou ubikvitin ligázy“. Molekulární buňka. 3 (4): 535–41. doi:10.1016 / S1097-2765 (00) 80482-7. PMID 10230407.
- Hori T, Osaka F, Chiba T, Miyamoto C, Okabayashi K, Shimbara N, Kato S, Tanaka K (listopad 1999). „Kovalentní modifikace všech členů proteinů lidské rodiny cullinů pomocí NEDD8“. Onkogen. 18 (48): 6829–34. doi:10.1038 / sj.onc.1203093. PMID 10597293.
- Lyapina S, Cope G, Shevchenko A, Serino G, Tsuge T, Zhou C, Wolf DA, Wei N, Shevchenko A, Deshaies RJ (květen 2001). "Podpora štěpení konjugátu NEDD-CUL1 signalosomem COP9". Věda. 292 (5520): 1382–5. Bibcode:2001Sci ... 292.1382L. doi:10.1126 / science.1059780. PMID 11337588. S2CID 14224920.
- Chen X, Zhang Y, Douglas L, Zhou P (prosinec 2001). „Proteiny vázající DNA poškozené UV zářením jsou cílem ubikvitinace a degradace zprostředkované CUL-4A“. The Journal of Biological Chemistry. 276 (51): 48175–82. doi:10,1074 / jbc.M106808200. PMID 11673459.
- Yasui K, Arii S, Zhao C, Imoto I, Ueda M, Nagai H, Emi M, Inazawa J (červen 2002). "TFDP1, CUL4A a CDC16 identifikovány jako cíle pro amplifikaci v 13q34 v hepatocelulárních karcinomech". Hepatologie. 35 (6): 1476–84. doi:10.1053 / jhep.2002.33683. PMID 12029633.
- Liu J, Furukawa M, Matsumoto T, Xiong Y (prosinec 2002). "NEDD8 modifikace CUL1 disociuje p120 (CAND1), inhibitor vazby CUL1-SKP1 a SCF ligáz". Molekulární buňka. 10 (6): 1511–8. doi:10.1016 / S1097-2765 (02) 00783-9. PMID 12504025.
- Min KW, Hwang JW, Lee JS, Park Y, Tamura TA, Yoon JB (květen 2003). „TIP120A se asociuje s culliny a moduluje aktivitu ubikvitin ligázy“. The Journal of Biological Chemistry. 278 (18): 15905–10. doi:10,1074 / jbc.M213070200. PMID 12609982.
- Groisman R, Polanowska J, Kuraoka I, Sawada J, Saijo M, Drapkin R, Kisselev AF, Tanaka K, Nakatani Y (květen 2003). „Aktivita ubikvitinové ligázy v komplexech DDB2 a CSA je odlišně regulována signalosomem COP9 v reakci na poškození DNA“. Buňka. 113 (3): 357–67. doi:10.1016 / S0092-8674 (03) 00316-7. PMID 12732143. S2CID 11639677.
- Higa LA, Mihaylov IS, Banks DP, Zheng J, Zhang H (listopad 2003). "Radiačně zprostředkovaná proteolýza CDT1 komplexy CUL4-ROC1 a CSN představuje nový kontrolní bod". Přírodní buněčná biologie. 5 (11): 1008–15. doi:10.1038 / ncb1061. PMID 14578910. S2CID 26070877.
- Wertz IE, O'Rourke KM, Zhang Z, Dornan D, Arnott D, Deshaies RJ, Dixit VM (únor 2004). „Human De-etiolated-1 reguluje c-Jun sestavením ubikvitinové ligázy CUL4A“ (PDF). Věda. 303 (5662): 1371–4. Bibcode:2004Sci ... 303.1371W. doi:10.1126 / science.1093549. PMID 14739464. S2CID 40501515.
- Obuse C, Yang H, Nozaki N, Goto S, Okazaki T, Yoda K (únor 2004). „Proteomická analýza komplexu centromér z HeLa mezifázových buněk: UV-poškozený DNA vazebný protein 1 (DDB-1) je součástí komplexu CEN, zatímco BMI-1 je přechodně ko-lokalizován s centromerickou oblastí v mezifázi.“ Geny do buněk. 9 (2): 105–20. doi:10.1111 / j.1365-2443.2004.00705.x. PMID 15009096.
- Hu J, McCall CM, Ohta T, Xiong Y (říjen 2004). "Cílená ubikvitinace CDT1 ligandem DDB1-CUL4A-ROC1 v reakci na poškození DNA". Přírodní buněčná biologie. 6 (10): 1003–9. doi:10.1038 / ncb1172. PMID 15448697. S2CID 34194616.
- Nag A, Bagchi S, Raychaudhuri P (listopad 2004). „Cul4A se fyzicky asociuje s MDM2 a podílí se na proteolýze p53“. Výzkum rakoviny. 64 (22): 8152–5. doi:10.1158 / 0008-5472.CAN-04-2598. PMID 15548678.
- Matsuda N, Azuma K, Saijo M, Iemura S, Hioki Y, Natsume T, Chiba T, Tanaka K, Tanaka K (květen 2005). „DDB2, produkt genu skupiny xeroderma pigmentosum skupiny E, je přímo ubikvitylován komplexem ubikvitin ligázy na bázi Cullin 4A“. Oprava DNA. 4 (5): 537–45. doi:10.1016 / j.dnarep.2004.12.012. PMID 15811626.