Skládací uzel trojlístku - Trefoil knot fold

The skládací uzel trojlístku je protein složit ve kterém páteř bílkovin je zkroucený do trojlístkový uzel tvar. „Mělké“ uzly, ve kterých konec polypeptidového řetězce prochází smyčkou pouze o několik zbytků, jsou neobvyklé, ale „hluboké“ uzly, ve kterých smyčkou prochází mnoho zbytků, jsou extrémně vzácné. Hluboké trojlístkové uzly byly nalezeny v SPOUT nadčeleď.[1] počítaje v to methyltransferáza proteiny podílející se na posttranskripci RNA úpravy ve všech třech doménách života, včetně bakterie Thermus thermophilus[2] a bílkoviny,[3] v archaea[1] a v eukaryota.[4]
V mnoha případech je uzel trojlístku součástí Aktivní stránky nebo vazebné místo pro ligand a je kritické pro aktivitu enzym ve kterém se objevuje. Před objevením prvního vázaný protein, to bylo věřil, že proces skládání bílkovin nemohl efektivně produkovat hluboké uzly v proteinových páteřích. Studie skládání kinetika a dimerní protein z Haemophilus influenzae odhalili, že skládání proteinů uzlů trojlístku může záviset na prolin izomerizace.[5] Byly vyvinuty výpočetní algoritmy k identifikaci vázaných proteinových struktur, a to jak pro plátno Proteinová datová banka pro dříve nezjištěné přírodní uzly a pro identifikaci uzlů v předpovědi struktury proteinů, kde je nepravděpodobné, že přesně reprodukují strukturu nativního stavu kvůli vzácnosti uzlů ve známých proteinech.[6] V současné době je k dispozici webový server pKNOT, který detekuje uzly v proteinech a poskytuje informace o vázaných proteinech v Proteinová datová banka.[7]Knottiny jsou malé, různorodé a stabilní proteiny s významným potenciálem pro design léčiv. Mohou být klasifikovány do 30 rodin, které pokrývají širokou škálu sekvencí (1621 sekvenovaných), trojrozměrných struktur (155 vyřešených) a funkcí (> 10). Podobnost mezi uzly leží hlavně mezi 20% a 40% sekvenční identity a odchylkami páteře 1,5 až 4 A, i když všechny sdílejí pevně vázané disulfidové jádro. Tato důležitá variabilita pravděpodobně vznikne z velmi různorodých smyček, které spojují postupné vázané cysteiny. Predikce strukturálních modelů pro všechny knottinové sekvence by otevřela nové směry pro analýzu interakčních míst a poskytla lepší pochopení strukturální a funkční organizace proteinů sdílejících toto lešení.[8]
Trojlístek doména
| Trojlístek (typ P) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
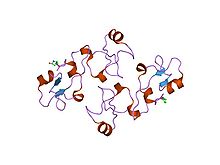 Struktura pankreatického spasmolytického polypeptidu.[9] | |||||||||||
| Identifikátory | |||||||||||
| Symbol | Jetel | ||||||||||
| Pfam | PF00088 | ||||||||||
| InterPro | IPR000519 | ||||||||||
| CHYTRÝ | SM00018 | ||||||||||
| STRÁNKA | PDOC00024 | ||||||||||
| SCOP2 | 1 lžička / Rozsah / SUPFAM | ||||||||||
| CDD | cd00111 | ||||||||||
| |||||||||||
Trojlístek (typ P) je bohatý na cysteiny doména přibližně čtyřicet pět aminokyselinových zbytků bylo nalezeno v některých extracelulárních eukaryotických proteinech.[10][11][12][13] Je známá jako doména „P“, „trojlístek“ nebo „TFF“ a obsahuje šest cysteinů spojených třemi disulfidovými vazbami s konektivitou 1-5, 2-4, 3-6.
Doména byla nalezena v různých extracelulárních eukaryotických proteinech,[10][12][13] včetně proteinu pS2 (TFF1 ) bílkovina vylučovaná sliznice žaludku; spasmolytický polypeptid (SP) (TFF2 ), protein asi 115 zbytků, který inhibuje gastrointestinální systém pohyblivost a žaludeční kyselina vylučování; faktor střevního trojlístku (ITF) (TFF3 ); Xenopus laevis žaludeční proteiny xP1 a xP4; xenopus integumentary muciny A.1 (preprospasmolysin) a C.1, proteiny, které se mohou podílet na obraně proti mikrobiálním infekcím ochranou epitelu před vnějším prostředím; kožní protein xenopus xp2 (nebo APEG); Zona pellucida protein vázající spermie B (ZP-B); střevní sacharáza-izomaltáza (ES 3.2.1.48 / ES 3.2.1.10 ), multifunkční enzymový komplex vázaný na membránu obratlovců, který hydrolyzuje sacharózu, maltózu a isomaltózu; a lysozomální alfa-glukosidáza (ES 3.2.1.20 ).
Příklady
Lidský gen kódující proteiny obsahující trojlístkovou doménu zahrnuje:
externí odkazy
- SCOP skládání uzlů alfa / beta
- Topologie CATH alfa / beta uzlu
- pKNOT webový server k detekci uzlů v proteinech
Reference
- ^ Zarembinski TI, Kim Y, Peterson K, Christendat D, Dharamsi A, Arrowsmith CH, Edwards AM, Joachimiak A. (2003). Hluboký uzel trojlístku zapojený do vazby RNA nacházející se v archebakteriálním proteinu. Proteiny 50(2):177-83
- ^ Nureki O, Shirouzu M, Hashimoto K, Ishitani R, Terada T, Tamakoshi M, Oshima T, Chijimatsu M, Takio K, Vassylyev DG, Shibata T, Inoue Y, Kuramitsu S, Yokoyama S. (2002). Enzym s hlubokým uzlem trojlístku pro architekturu aktivního místa. Acta Crystallogr D 58 (Pt 7): 1129-37
- ^ Nureki O, Watanabe K, Fukai S, Ishii R, Endo Y, Hori H, Yokoyama S. (2004). Hluboká uzlová struktura pro konstrukci aktivního místa a vazebného místa kofaktoru enzymu modifikujícího tRNA. Struktura 12(4):593-602
- ^ Leulliot N, Bohnsack MT, Graille M, Tollervey D, Van Tilbeurgh H. (2008). Faktor kvasinkového ribozomu Emg1 je novým členem nadrodiny alfa / beta uzlových záhybů methyltransferáz. Nucleic Acids Res 36(2):629-39
- ^ Mallam AL, Jackson SE. (2006). Sondování uzlů přírody: skládací dráha vázaného homodimerního proteinu. J Mol Biol 359(5):1420-36
- ^ Khatib F, Weirauch MT, Rohl CA. (2006). Rychlá detekce uzlů a aplikace na predikci struktury proteinů. Bioinformatika 22 (14): e252-9
- ^ Lai YL, Yen SC, Yu SH, Hwang JK (2007). pKNOT: proteinový webový server KNOT. Výzkum nukleových kyselin 35: W420-424
- ^ (Jerome Gracy a Laurent Chiche (2010). Optimalizace strukturního modelování pro konkrétní proteinové lešení: knottiny nebo inhibiční cystinové uzly. BMC bioinformatika. 11:535)
- ^ Gajhede M, Petersen TN, Henriksen A a kol. (Prosinec 1993). „Pankreatický spasmolytický polypeptid: první trojrozměrná struktura člena peptidové rodiny savčích trojlístků“. Struktura. 1 (4): 253–62. doi:10.1016/0969-2126(93)90014-8. PMID 8081739.
- ^ A b Otto B, Wright N (1994). "Trojlístkové peptidy. Vychází jetel". Curr. Biol. 4 (9): 835–838. doi:10.1016 / S0960-9822 (00) 00186-X. PMID 7820556. S2CID 11245174.
- ^ Thim L, Wright NA, Hoffmann W, Otto WR, Rio MC (1997). „Postupování jetele: peptidy z domény trojlístkových faktorů (TFF), migrace buněk a rakovina“. FEBS Lett. 408 (2): 121–123. doi:10.1016 / S0014-5793 (97) 00424-9. PMID 9187350. S2CID 26946754.
- ^ A b Bork P (1993). „Trojlístková doména v hlavním proteinu zona pellucida králíka“. Protein Sci. 2 (4): 669–670. doi:10.1002 / pro.5560020417. PMC 2142363. PMID 8518738.
- ^ A b Hoffmann W, Hauser F (1993). „Motiv P-domény nebo trojlístku: role při obnově a patologii slizničních epitelů?“. Trends Biochem. Sci. 18 (7): 239–243. doi:10.1016 / 0968-0004 (93) 90170-R. PMID 8267796.
Bibliografie
- Tkaczuk KL, Dunin-Horkawicz S, Purta E, Bujnicki JM. (2007). Strukturální a evoluční bioinformatika nadrodiny methyltransferáz SPOUT. BMC bioinformatika. 8:73
