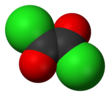
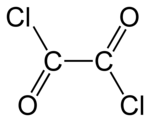
Oxalylchlorid - Oxalyl chloride
 | |||
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Oxalyldichlorid[1] | |||
| Systematický název IUPAC Ethandioyl dichlorid[1] | |||
| Ostatní jména Chlorid kyseliny šťavelové Dichlorid kyseliny šťavelové Kyselina šťavelová Oxaloylchlorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.001.092 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C2Ó2Cl2 | |||
| Molární hmotnost | 126,93 g / mol | ||
| Vzhled | Bezbarvá kapalina | ||
| Hustota | 1,4785 g / ml | ||
| Bod tání | -16 ° C (3 ° F; 257 K) | ||
| Bod varu | 63 až 64 ° C (145 až 147 ° F; 336 až 337 K) při 1,017 baru | ||
| Reaguje | |||
Index lomu (nD) | 1.429 | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Toxický, žíravý, slzotvorce [2] | ||
| Bezpečnostní list | Externí bezpečnostní list | ||
| Piktogramy GHS |   [2] [2] | ||
| Signální slovo GHS | Nebezpečí[2] | ||
| H314, H331[2] | |||
| P261, P280, P305 + 351 + 338, P310[2] | |||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Příbuzný acylchloridy | Malonylchlorid Sukcinylchlorid fosgen | ||
Související sloučeniny | Kyselina šťavelová Diethyloxalát Oxamid Oxalylhydrazid Cuprizon 1 | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Oxalylchlorid je chemická sloučenina s vzorec (COCl)2. Tato bezbarvá kapalina s ostrým zápachem, diacylchlorid z kyselina šťavelová, je užitečné činidlo v organická syntéza.[3]
Příprava
Oxalylchlorid poprvé připravil v roce 1892 francouzský chemik Adrien Fauconnier, který reagoval s diethyloxalátem s chloridem fosforečným.[4] Může být také připraven zpracováním kyselina šťavelová s chlorid fosforečný.[5]
Oxalylchlorid se komerčně vyrábí z ethylenkarbonát. Fotochlorace poskytuje tetrachlorid, který se následně odbourává:[6]
- C2H4Ó2CO + 4 Cl2 → C.2Cl4Ó2CO + 4 HCl
- C2Cl4Ó2CO → C.2Ó2Cl2 + COCl2
Reakce
Oxalylchlorid reaguje s voda pouze vydávání plynných produktů: chlorovodík (HCl), oxid uhličitý (CO.)2), a kysličník uhelnatý (CO).
- (COCl)
2 + H
2O → 2 HCl + CO
2 + CO
V tomto je zcela odlišný od ostatních acylchloridy které hydrolyzují za vzniku chlorovodíku a originálu karboxylová kyselina.
Aplikace v organické syntéze
Oxidace alkoholů
Řešení zahrnuje DMSO a oxalylchlorid, po kterém následuje reakce s triethylamin převádí alkoholy na odpovídající aldehydy a ketony prostřednictvím procesu známého jako Swernova oxidace.[7][8][9]
Syntéza acylchloridů
Oxalylchlorid se používá hlavně společně s a N,N-dimethylformamid katalyzátor v organická syntéza pro přípravu acylchloridů z odpovídajících karboxylové kyseliny. Jako thionylchlorid se činidlo v této aplikaci degraduje na těkavé vedlejší produkty, což zjednodušuje zpracování. Jeden z vedlejších produktů z N,N-dimethylformamidem katalyzovaná reakce je silný karcinogen pocházející z N,N-dimethylformamidový rozklad.[10] Ve vztahu k thionylchloridu má oxalylchlorid tendenci být mírnější a selektivnější činidlo. Je to také dražší než thionylchlorid takže má tendenci být používán v menším měřítku.
Tato reakce zahrnuje konverzi DMF na imidoylchlorid derivát (Me2N = CHCI+), podobný první fázi v Vilsmeier-Haackova reakce. Imidoylchlorid je aktivní chlorační činidlo.
Formylace arenů
Oxalylchlorid reaguje s aromatický sloučeniny v přítomnosti chlorid hlinitý dát odpovídající acylchlorid v procesu známém jako a Friedel-Craftsova acylace.[11][12] Výsledný acylchlorid lze hydrolyzovat za vzniku odpovídajícího karboxylová kyselina.
Příprava oxalátových diesterů
Stejně jako ostatní acylchloridy, oxalylchlorid reaguje s alkoholy za vzniku esterů:
- 2 RCH
2OH + (COCl)
2 → RCH
2OC (O) C (O) OCH
2R + 2 HCl
Typicky se takové reakce provádějí v přítomnosti báze, jako je pyridin. Diester odvozený od fenol, ester fenyloxalátu, je Cyalume, aktivní složka v svítící tyčinky.
jiný
Oxalylchlorid byl údajně použit při první syntéze dioxan tetraketon (C4Ó6), an oxid uhlíku.[13]
Opatření
V březnu 2000, a Malaysia Airlines Airbus A330 -300 byl neopravitelně poškozen poté, co do nákladového prostoru unikl náklad zakázaného oxalylchloridu (falešně deklarovaného jako hydroxychinolin).[14] Je toxický při vdechování, i když je řádově méně akutně toxický než příbuzná sloučenina fosgen.[15]
Viz také
Reference
- ^ A b Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 797. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A b C d E Bezpečnostní list oxalylchloridu
- ^ Salmon, R. (2001). "Oxalylchlorid". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. New York: John Wiley & Sons. doi:10.1002 / 047084289X.ro015. ISBN 0471936235.
- ^ Fauconnier, Adrien (1892). „Action du perchlorure de phosphore sur l'oxalate d'éthyle“ Působení chloridu fosforečného na diethyloxalát. Comptes rendus hebdomadaires des séances de l'Académie des Sciences (francouzsky). 114: 122–123.
- ^ DE patent 2840435, Vogel, A .; Steffan, G .; Mannes, K .; Trescher, V., „Proces přípravy oxalylchloridu“, vydaný 1980-03-27, přidělený společnosti Bayer
- ^ Pfoertner, Karl-Heinz (2000). „Fotochemie“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_573.
- ^ Dondoni, A .; Perrone, D. (2004). „Syntéza 1,1-dimethylethyl- (S) -4-formyl-2,2-dimethyl-3-oxazolidinkarboxylát oxidací alkoholu ". Organické syntézy.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 10, str. 320
- ^ Bishop, R. (1998). „9-Thiabicyklo [3.3.1] nonan-2,6-dion“. Organické syntézy.; Kolektivní objem, 9, str. 692
- ^ Leopold, E. J. (1990). „Selektivní hydroborace 1,3,7-trienu: Homogeraniol“. Organické syntézy.; Kolektivní objem, 7, str. 258
- ^ Clayden, Jonathan (2005). Organická chemie (Přetištěno (s opravami) vyd.). Oxford [u.a.]: Oxford Univ. Lis. str.296. ISBN 978-0-19-850346-0.
- ^ Neubert, M. E.; Fishel, D.L. (1983). „Příprava 4-alkyl- a 4-halogenbenzoylchloridů: 4-pentylbenzoylchlorid“. Organické syntézy. 61: 8.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 7, str. 420
- ^ Sokol, P. E. (1964). "Kyselina mezitoic". Organické syntézy. 44: 69.; Kolektivní objem, 5, str. 706
- ^ Strazzolini, P .; Gambi, A .; Giumanini, A. G .; Vancik, H. (1998). „Reakce mezi ethandioyl (oxalyl) dihalogenidy a Ag2C2Ó4: cesta k nepolapitelnému Staudingerovu nepolapitelnému anhydridu kyseliny ethandiové (šťavelové) “. Journal of the Chemical Society, Perkin Transactions 1. 1998 (16): 2553–2558. doi:10.1039 / a803430c.
- ^ „Firma řekla, aby zaplatila 65 milionů dolarů za zničení letadla“. Reuters. 2007-12-06. Citováno 2007-12-06.
- ^ Barbee, S.J .; Stone, J. J.; Hilaski, R.J. (Leden 1995). "Akutní inhalační toxikologie oxalylchloridu". American Industrial Hygiene Association Journal. 56 (1): 74–76. doi:10.1080/15428119591017358. ISSN 0002-8894.