Hurlerův syndrom - Hurler syndrome
| Hurlerův syndrom | |
|---|---|
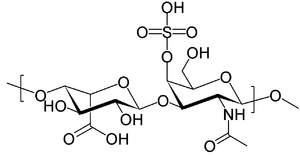 | |
| Struktura dermatan sulfát, jedna z molekul, která se hromadí v lysozomy pacientů s Hurlerovým syndromem | |
| Příčiny | Nedostatek enzymu alfa-L iduronidázy |
| Diferenciální diagnostika | Hurler-Scheie syndrom; Scheieho syndrom; Hunterův syndrom; jiný mukopolysacharidózy |
| Prognóza | Smrt obvykle nastává před 12 lety |
| Frekvence | 1 ze 100 000 |
Hurlerův syndrom, také známý jako mukopolysacharidóza Typ IH (MPS-IH), Hurlerova chorobaa dříve chrlič, je genetická porucha což má za následek nahromadění velkých molekul cukru zvaných glykosaminoglykany (AKA GAG nebo mukopolysacharidy) v lysozomy. Neschopnost rozložit tyto molekuly má za následek širokou škálu příznaků způsobených poškozením několika různých orgán systémy, mimo jiné včetně nervový systém, kosterní soustava, oči, a srdce.
Základním mechanismem je nedostatek alfa-L iduronidáza, an enzym zodpovědné rozbíjení GAG.[1]:544 Bez tohoto enzymu se hromadí dermatan sulfát a heparan sulfát se vyskytuje v těle. Příznaky objevují se v dětství a obvykle dochází k předčasné smrti. Mezi další, méně závažné formy MPS typu I patří Hurler-Scheie syndrom (MPS-IHS) a Scheie syndrom (MPS-IS).
Hurlerův syndrom je klasifikován jako a lysozomální střádavá nemoc. Klinicky to souvisí s Hunterův syndrom (MPS II);[2] Hunterův syndrom však je X-vázaný, zatímco Hurlerův syndrom je autosomálně recesivní.
Příznaky a symptomy

Děti s Hurlerovým syndromem se mohou po narození jevit jako normální a během prvních let života se u nich projeví příznaky. Příznaky se u pacientů liší.
Jednou z prvních abnormalit, které lze detekovat, je zhrubnutí obličejových rysů; tyto příznaky mohou začít ve věku 3-6 měsíců. The hlava může být velká s výrazné čelní kosti. Lebka může být protáhlý. Nos může mít zploštělý nosní můstek s nepřetržitým nosním výtokem. Oční důlky mohou být daleko od sebe a oči mohou vyčnívat z lebky. Rty mohou být velké a postižené děti mohou neustále držet otevřené čelisti. Abnormality skeletu se vyskytují přibližně ve věku 6 měsíců, ale nemusí být klinicky zjevné až do 10–14 měsíců. U pacientů se mohou objevit oslabující deformity páteře a kyčle, syndrom karpálního tunelu a ztuhlost kloubů. Pacienti mohou být v kojeneckém věku normální výšky, ale do věku 2 let přestanou růst. Nesmí dosáhnout výšky větší než 4 stopy.
Jiné časné příznaky mohou zahrnovat tříslovný a pupeční kýly. Mohou být přítomny při narození nebo se mohou vyvinout během prvních měsíců života. Zataženo rohovka a degenerace sítnice se mohou objevit během prvního roku života, což vede k oslepnutí. Zvětšený játra a slezina jsou běžné. Neexistuje žádná orgánová dysfunkce, ale depozice GAG v těchto orgánech může vést k masivnímu zvětšení velikosti. Pacienti mohou také mít průjem. Aortální chlopně může dojít k onemocnění.
Obstrukce dýchacích cest je častá, obvykle sekundární k abnormálním krčním obratlům.[3] Infekce horních a dolních dýchacích cest mohou být časté.
Zpoždění vývoje se může projevit ve věku 1–2 let, s maximálním funkčním věkem 2–4 roky. Následuje postupné zhoršování. Většina dětí má omezené jazykové schopnosti. Smrt obvykle nastává do 10 let.[4][5]
Mechanismy

Gen IDUA je zodpovědný za kódování enzymu zvaného alfa-L-iduronidáza. Přes hydrolýza, alfa-L-iduronidáza je zodpovědná za rozklad molekuly s názvem nesulfátovaná kyselina alfa-L-iduronová. Tohle je kyselina uronová nachází se v GAG dermatan sulfátu a heparan sulfátu. Enzym alfa-L-iduronidázy se nachází v lysozomech. Bez dostatečné enzymatické funkce nelze tyto GAG správně trávit.[6]
Genetika

Děti s Hurlerovým syndromem nesou dvě vadné kopie IDUA gen, který byl namapován na místo 4p16.3 dne chromozom 4. Toto je gen, který kóduje protein iduronidázu. Od roku 2018[Aktualizace], více než 201 různých mutací v IDUA Bylo prokázáno, že tento gen způsobuje MPS I.[7]
Protože Hurlerův syndrom je autosomální recesivní poruchy mají postižené osoby dvě nepracující kopie genu. Osoba narozená s jednou normální kopií a jednou vadnou kopií se nazývá a dopravce. Budou produkovat méně α-L-iduronidázy než jedinec se dvěma normálními kopiemi genu. Snížená produkce enzymu v nosičích však zůstává dostatečná pro normální funkci; osoba by neměla vykazovat žádné příznaky nemoci.
Diagnóza
Diagnózu lze často provést klinickým vyšetřením a testy moči (přebytek mukopolysacharidy se vylučují do moč ). Enzymové testy (testování různých buněk nebo tělních tekutin v kultuře na nedostatek enzymů) se také používají k zajištění konečné diagnózy jedné z mukopolysacharidóz. Prenatální diagnóza použitím amniocentéza a vzorkování choriových klků může ověřit, zda a plod buď nese kopii vadného gen nebo je postižen touto poruchou. Genetické poradenství může pomoci rodičům, kteří mají v rodinné anamnéze mukopolysacharidózy, určit, zda jsou nositeli mutovaného genu, který způsobuje poruchy.
Klasifikace
Všichni členové rodiny mukopolysacharidózy jsou také lysozomální střádavé choroby. Mukopolysacharidóza typu I (MPS I) je rozdělen do tří podtypů na základě závažnosti příznaků. Všechny tři typy způsobují nepřítomnost nebo sníženou funkci stejného enzymu. MPS-IH (Hurlerův syndrom) je nejtěžší ze subtypů MPS I. Další dva typy jsou MPS-IS (Scheieho syndrom ) a MPS-IHS (Hurler-Scheie syndrom ).
Vzhledem k podstatnému překrývání mezi Hurlerovým syndromem, Hurler-Scheieho syndromem a Scheieho syndromem považují některé zdroje tyto termíny za zastaralé. Místo toho lze MPS I rozdělit na „závažné“ a „oslabené“ formy.[8]
Léčba
V současné době neexistuje žádný lék na Hurlerův syndrom. Enzymová substituční terapie s iduronidáza (Aldurazyme) může zlepšit plicní funkce a mobilitu. Může snížit množství sacharidů, které jsou nesprávně uloženy v orgánech. Může být nutná chirurgická korekce deformit rukou a nohou. Operace rohovky může pomoci zmírnit problémy se zrakem.[5]
Transplantace kostní dřeně (BMT) a transplantace pupečníkové krve (UCBT) lze použít jako léčbu MPS I. BMT od sourozenců se stejnými HLA geny a od příbuzných s podobnými geny HLA mohou významně zlepšit přežití, kognitivní funkce a fyzické příznaky. Pacienti se mohou vyvinout nemoc štěpu proti hostiteli; to je pravděpodobnější u dárců, kteří nejsou sourozenci. Ve studii z roku 1998 měly děti s identickými dárci sourozenců HLA pětileté přežití 75%; děti s dárci sourozenců měly 5leté přežití 53%.[9]
Děti často nemají přístup k vhodnému dárci kostní dřeně. V těchto případech může UCBT od nepříbuzných dárců zvýšit přežití, snížit fyzické příznaky onemocnění a zlepšit poznávání. Komplikace z této léčby mohou zahrnovat nemoc štěpu proti hostiteli.[10]
Prognóza
Britská studie z roku 2008 zjistila střední odhadovanou délku života 8,7 roku u pacientů s Hurlerovým syndromem. Pro srovnání byla střední délka života u všech forem MPS typu I 11,6 roku. Pacienti, kteří dostali úspěšné transplantace kostní dřeně, měli 2 roky míra přežití 68% a 10letá míra přežití 64%. Pacienti, kteří nedostali transplantaci kostní dřeně, měli významně sníženou délku života se středním věkem 6,8 roku.[4]
Epidemiologie
Hurlerův syndrom má celkovou frekvenci jeden na 100 000.[5] Dohromady mají všechny mukopolysacharidózy frekvenci přibližně jednoho z každých 25 000 porodů ve Spojených státech.[2]
Výzkum
Genová terapie
Při léčbě MPS I existuje velký zájem genová terapie. Ve zvířecích modelech bylo dodání genu iduronidázy dosaženo pomocí retrovirus, adenovirus, virus spojený s adeno, a plazmid vektory. Myši a psi s MPS I byli úspěšně léčeni genovou terapií. Většina vektorů může napravit onemocnění v játrech a slezině a může upravit účinky na mozek pomocí vysoké dávky. Genová terapie zlepšila přežití, neurologické a fyzické příznaky; u některých zvířat se však vyvinuly nevysvětlitelné nádory jater. Pokud lze vyřešit problémy s bezpečností, může genová terapie v budoucnu poskytnout alternativní léčbu poruch MPS u lidí.[11]
Sangamo Therapeutics se sídlem v Richmond, Kalifornie, v současné době provádí klinické hodnocení zahrnující úpravu genů pomocí Nukleáza se zinkovým prstem (ZFN) pro léčbu MPS I.[12]
Dějiny
V roce 1919 Gertrud Hurlerová, německý pediatr, popsal syndrom zahrnující zakalení rohovky, abnormality skeletu a mentální retardaci. Podobnou nemoc „chrličství“ popsal v roce 1917 Charles A. Hunter. Hurler nezmínil Hunterův papír. Z důvodu přerušení komunikace způsobeného první světová válka Je pravděpodobné, že nevěděla o jeho studiu. Hurlerův syndrom nyní odkazuje na MPS IH, zatímco Hunterův syndrom označuje MPS II.[13][14] V roce 1962 Scheie identifikoval mírnější formu MPS I, což vedlo k označení Scheieho syndromu.[4]
Viz také
- Hunterův syndrom (MPS II)
- Sanfilippo syndrom (MPS III)
- Morquioův syndrom (MPS IV)
- Maroteaux-Lamyho syndrom (MPS VI)
Reference
- ^ James WD, Berger TG a kol. (2006). Andrewsovy nemoci kůže: klinická dermatologie. Saunders Elsevier. ISBN 978-0-7216-2921-6.
- ^ A b „Informační list o mukopolysacharidózách“. Národní institut neurologických poruch a mozkové mrtvice. 15. listopadu 2017. Citováno 11. května 2018.
- ^ Myer CM (červenec 1991). "Ucpání dýchacích cest u Hurlerova syndromu - rentgenografické znaky". International Journal of Pediatric Otorhinolaryngology. 22 (1): 91–6. doi:10.1016 / 0165-5876 (91) 90101-g. PMID 1917344.
- ^ A b C Moore D, Connock MJ, Wraith E, Lavery C (září 2008). „Prevalence a přežití u mukopolysacharidózy I: syndromy Hurler, Hurler-Scheie a Scheie ve Velké Británii“. Orphanet Journal of Rare Diseases. 3: 24. doi:10.1186/1750-1172-3-24. PMC 2553763. PMID 18796143.
- ^ A b C Banikazemi M (12. října 2014). „Hurlerův syndrom, Hurler-Scheieho syndrom a Scheieho syndrom (mukopolysacharidóza typu I)“. Medscape. Citováno 10. května 2018.
- ^ "Gen IDUA". Genetická domácí reference. 11. června 2019. Citováno 18. června 2019.
- ^ Chkioua L, Boudabous H, Jaballi I, Grissa O, Turkia HB, Tebib N, Laradi S (květen 2018). „Nová mutace genu IDUA genového spojení v tuniských rodokmenech s hurlerovým syndromem“. Diagnostická patologie. BioMed Central. 13 (1): 35. doi:10.1186 / s13000-018-0710-3. PMC 5975427. PMID 29843745.
- ^ „Mukopolysacharidóza typu I“. Genetická domácí reference. Citováno 10. května 2018.
- ^ Peters C, Shapiro EG, Anderson J, Henslee-Downey PJ, Klemperer MR, Cowan MJ a kol. (Duben 1998). "Hurlerův syndrom: II. Výsledek HLA-genotypicky identického sourozence a HLA-haploidentické transplantace kostní dřeně u padesáti čtyř dětí. The Storage Disease Collaborative Study Group". Krev. 91 (7): 2601–8. doi:10,1182 / krev. V91.7.2601. PMID 9516162.
- ^ Staba SL, Escolar ML, Poe M, Kim Y, Martin PL, Szabolcs P a kol. (Květen 2004). „Transplantace pupečníkové krve od nepříbuzných dárců u pacientů s Hurlerovým syndromem“. The New England Journal of Medicine. 350 (19): 1960–9. doi:10.1056 / NEJMoa032613. PMID 15128896. S2CID 43572313.
- ^ Ponder KP, Haskins ME (září 2007). "Genová terapie pro mukopolysacharidózu". Znalecký posudek na biologickou terapii. 7 (9): 1333–45. doi:10.1517/14712598.7.9.1333. PMC 3340574. PMID 17727324.
- ^ „Studie vzestupné dávky úpravy genomu terapeutickou SB-318 u pacientů s MPS I terapeutickým účinkem nukleázy zinku (ZFN)“. clintrials.gov. Americká národní lékařská knihovna. Citováno 7. února 2019.
- ^ Hurlerův syndrom na Kdo to pojmenoval?
- ^ Hurler, G. (1919). „Über einen Typ multipler Abartungen, vorwiegend am Skelettsystem“. Zeitschrift für Kinderheilkunde. 24 (5–6): 220–234. doi:10.1007 / BF02222956. S2CID 34471544.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
