HinIII - HindIII - Wikipedia
| HindIIIR typu II restrikční endonukleáza | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | zadní IIIR | ||||||
| Gen NCBI | 950303 | ||||||
| PDB | 2e52 Více struktur | ||||||
| UniProt | P43870 | ||||||
| Další údaje | |||||||
| EC číslo | 3.1.21.4 | ||||||
| |||||||
HinIII (vyslovuje se „Hin D Three“) je místně specifická deoxyribonukleáza typu II restrikční enzym izolovaný od Haemophilus influenzae který štěpí DNA palindromickou sekvenci AAGCTT v přítomnosti kofaktoru Mg2+ přes hydrolýza.[1]

Štěpení této sekvence mezi AA má za následek 5 'převisy na volané DNA lepivé konce:
5'-A | A G C T T-3 '
3'-T T C G A | A-5 '
Restrikční endonukleázy se používají jako obranné mechanismy v prokaryotický organismy v systém modifikace omezení. Jejich primární funkcí je především ochrana hostitelského genomu před invazí cizí DNA bakteriofág DNA. Existují také důkazy, které naznačují, že restrikční enzymy mohou působit vedle modifikačních enzymů jako sobecké prvky nebo se na nich mohou podílet genetická rekombinace a transpozice.[2]
Struktura enzymu
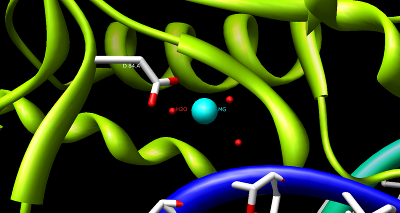
Struktura HindIII je složitá a sestává z homodimeru. Stejně jako u jiných restrikčních endonukleáz typu II se předpokládá, že obsahují společné strukturní jádro obsahující čtyři β-listy a jeden α-šroubovice. Každá podjednotka obsahuje 300 aminokyseliny a předpokládaná molekulová hmotnost je 34 950 Da. Přes význam tohoto enzymu v molekulární biologie a technologie DNA je k dispozici málo informací o mechanismu rozpoznávání DNA a fosfodiesterová vazba výstřih.[1] Předpokládá se však, že HindIII využívá společný mechanismus rozpoznávání a katalýza DNA nacházející se v jiných enzymech typu II, jako je EcoRI, BamAHOJ, a BglII. Tyto enzymy obsahují aminokyselina sekvenční motiv PD- (D / E) XK ke koordinaci Mg2+, kation potřebný ke štěpení DNA ve většině restrikčních endonukleáz typu II.[4] Kofaktor Mg2+ Předpokládá se, že váže molekuly vody a přenáší je na katalytická místa enzymů, mimo jiné kationy. Na rozdíl od většiny dokumentovaných restrikčních endonukleáz typu II je HindIII jedinečný v tom, že má malou nebo žádnou katalytickou aktivitu při působení Mg2+ je nahrazen jinými kofaktory, jako je Mn2+.[1]
Místně zaměřená mutageneze
Navzdory nejistotě týkající se vztahu mezi strukturou a katalýzou endonukleáz typu II je cílený na místo mutageneze restrikční endonukleázy HindIII poskytlo mnoho informací o klíči aminokyselina zúčastněné zbytky. Zejména substituce Asn za Lys ve zbytku 125 a Leu za Asp ve zbytku 108 významně snížily vazbu DNA a katalytickou funkci HinIII.[1] V samostatné studii mutageneze bylo prokázáno, že mutace ve zbytku 123 z Asp na Asn snížila enzymatickou aktivitu. Navzdory skutečnosti, že tento zbytek je s největší pravděpodobností zodpovědný za odvíjení DNA a koordinaci s vodou, nikoli za přímou interakci s útočícími nukleofil, jeho specifická funkce není známa.[4]
Navrhovaný mechanismus
Zatímco restrikční enzymy štěpí na specifických sekvencích DNA, je nejprve nutné, aby se nespecificky vážily s páteří DNA, než se lokalizují na místo omezení. V průměru bude restrikční enzym tvořit 15-20 Vodíkové vazby se základy rozpoznávací sekvence. S pomocí dalších van der Waalsovy interakce tato vazba usnadňuje konformační změnu komplexu DNA-enzym, která vede k aktivaci katalytických center.[2]
Navzdory nedostatku důkazů, které by naznačovaly přesný mechanismus štěpení DNA pomocí HindIII, byla analýza site-mutageneze spojená s podrobnějšími studiemi katalýzy zprostředkované kovovými ionty EcoRV vedly k následujícímu navrhovanému katalytickému mechanismu. Bylo navrženo, že během hydrolýzy DNA pomocí EcoRV se katalytický zbytek Lys-92 stabilizuje a orientuje útočící vodu nukleofil, zatímco karboxylát Asp-90 stabilizuje odchod hydroxid anion až po koordinaci Mg2+. Enzymatická funkce dále závisí na správné poloze zbytku Asp-74, což naznačuje, že má roli při zvyšování nukleofilnosti molekuly útočící vody.[5]
V důsledku výše popsaných experimentů s místně-mutagenezí se proto navrhuje, aby Lys-125, Asp-123 a Asp-108 HindIII fungovaly podobně jako Lys-92, Asp-90 a Asp-74 v EcoRV, resp. Lys-125 umístí útočící molekulu vody, zatímco Asp-108 zlepšuje její nukleofilitu. Souřadnice Asp-123 k Mg2 +, které zase stabilizují opouštějící iont hydroxidu.
Využití ve výzkumu
HindIII a další typ II restrikční endonukleázy jsou velmi užitečné v moderní vědě, zejména v Sekvenování DNA a mapování. Na rozdíl od restrikčních enzymů typu I provádějí restrikční endonukleázy typu II velmi specifické štěpení DNA. Restrikční enzymy typu I rozpoznávají specifické sekvence, ale štěpí DNA náhodně na jiných místech, než je jejich rozpoznávací místo, zatímco restrikční enzymy typu II štěpí pouze na svém specifickém rozpoznávacím místě.[6] Od svého objevu na začátku 70. let 20. století způsobily restrikční enzymy typu II revoluci ve způsobu, jakým vědci pracují s DNA, zejména v genetické inženýrství a molekulární biologie.
Mezi hlavní použití restrikčních enzymů typu II patří genová analýza a klonování. Ukázaly se jako ideální modelovací systémy pro studium interakcí protein-nukleová kyselina, vztahů mezi strukturou a funkcí a mechanismu vývoj.[2] Dělají dobré testy pro studium genetické mutace jejich schopností specificky štěpit DNA, což umožňuje odstranění nebo vložení DNA. Díky použití restrikčních enzymů jsou vědci schopni modifikovat, vkládat nebo odstraňovat specifické geny, velmi silný nástroj, zejména pokud jde o úpravu organismu genom.
Reference
- ^ A b C d Tang, D; et al. (2000). "Mutační analýzy restrikční endonukleázy - mutantu HindIII E86K s vyšší aktivitou a změněnou specificitou". Proteinové inženýrství. 13 (4): 283–9. doi:10.1093 / protein / 13.4.283. PMID 10810160.
- ^ A b C Pingoud, Alfred; Jeltsch, Albert. (2001). "Struktura a funkce restrikčních endonukleáz typu II". Výzkum nukleových kyselin. 29 (18): 3705–27. doi:10.1093 / nar / 29.18.3705. PMC 55916. PMID 11557805.
- ^ Lukacs C a kol. (2000). „Pochopení neměnnosti restrikčních enzymů: krystalová struktura BglII a jeho DNA substrátu při rozlišení 1,5 A“. Nat. Struct. Biol. 7 (2): 134–40. doi:10.1038/72405. PMID 10655616. S2CID 20478739.
- ^ A b Tang D a kol. (1999). "Místně zaměřená mutageneze restrikční endonukleázy HindIII". Biosci. Biotechnol. Biochem. 63 (10): 1703–7. doi:10,1271 / bbb.63.1703. PMID 10586498.[trvalý mrtvý odkaz ]
- ^ Horton N, Newberry K, Perona J (1999). „Katalyzace zprostředkovaná substráty kovovými ionty v restrikčních endonukleázách typu II“. Proc. Natl. Acad. Sci. USA. 95 (23): 13489–94. doi:10.1073 / pnas.95.23.13489. PMC 24846. PMID 9811827.
- ^ Roberts, Richard J. (2005). „Jak se restrikční enzymy staly pracovníky molekulární biologie“. Proc. Natl. Acad. Sci. USA. 102 (17): 5905–8. doi:10.1073 / pnas.0500923102. PMC 1087929. PMID 15840723.

