BglII - BglII - Wikipedia
tento článek může být pro většinu čtenářů příliš technická na to, aby je pochopili. Prosím pomozte to vylepšit na aby to bylo srozumitelné pro neodborníky, aniž by byly odstraněny technické podrobnosti. (Únor 2012) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| Restrikční endonukleáza BglII | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 struktura restrikční endonukleázy BstYI vázán na neznámou DNA | |||||||||
| Identifikátory | |||||||||
| Symbol | EndonucBglII | ||||||||
| Pfam | PF09195 | ||||||||
| Pfam klan | CL0236 | ||||||||
| InterPro | IPR015278 | ||||||||
| SCOP2 | 1dfm / Rozsah / SUPFAM | ||||||||
| |||||||||
BglII je omezení typu II endonukleáza izolované z určitých kmenů Bacillus globigii.
Hlavní funkcí restrikčních enzymů je ochrana genomu hostitele před cizím DNA, ale mohou mít také určité zapojení do rekombinace a transpozice.[1]
Jako většina restrikčních enzymů typu II, BglII se skládá ze dvou identických podjednotek, které tvoří homodimer kolem dvojité šroubovice DNA. Každý monomer má 223 aminokyselin a symetricky váže obě strany jedinečnosti palindromický Nukleotidová sekvence AGATCT, štěpící scissilní fosfodiesterovou vazbu mezi prvními adeninovými a guaninovými nukleotidy na obou vláknech molekuly DNA, čímž se vytvoří lepivé konce s 5 'přesahem konců.
Být restrikčním enzymem typu II, BglII nevyžaduje ATP (adenosintrifosfát ) pro svou enzymatickou funkci, ale vyžaduje pouze spojení s a dvojmocný kation kovu, pravděpodobně Mg2+. Na rozdíl od jiných restrikčních enzymů své třídy BglUkázalo se, že II má některé jedinečné strukturní vlastnosti, jako je β-sendvičová subdoména, a zdá se, že prochází jedinečnou konformační změna po dimerizaci,[2] ale jeho celková struktura a mechanismus katalýzy zůstává konzistentní s jinými restrikčními enzymy typu II.
Restrikční endonukleázy hrají v moderní době velmi důležitou roli molekulární klonování techniky. Díky svým jedinečným místům rozpoznávání / štěpení lze použít restrikční enzymy k přesnému štěpení DNA na konkrétních místech předvídatelným způsobem. Po rozřezání má DNA (obvykle) tzv. „lepivé konce ", který pak umožňuje fragmentu DNA hybridizovat do DNA vektor. Ligující enzymy se používají kovalentně spojují požadovaný fragment s vektorem pro následné klonování DNA.
| Identifikátory | |
| název | BglII Omezení endonukleáza |
| Entrez | 6173168 |
| PDB | 1DFM |
| PŘÍSTUP # | Q45488 |
| Číslo ES | 3.1.21.4 |
Mechanismus
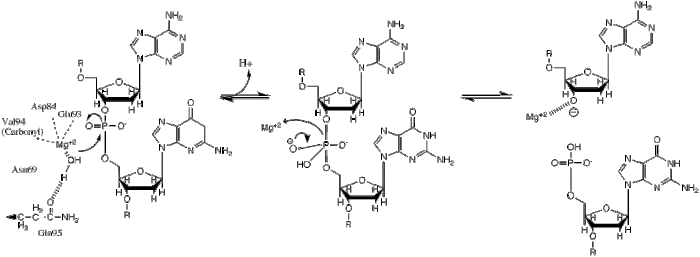 | K tomuto přenosu fosforylu dochází nukleofilním útokem hydridového iontu na scissilní fosfát, což vede k trigonálnímu bipyramidovému fosforovému meziproduktu. Fosfor se poté nahradí a 3'-0- se zahajuje jako odcházející skupina. |
BglII katalýzy fosfodiesterová vazba štěpení na páteři DNA přenosem fosforylu do vody.[1] Studie mechanismu restrikčních enzymů odhalily několik obecných rysů, které se zdají být pravdivé téměř ve všech případech, ačkoli skutečný mechanismus pro každý enzym je s největší pravděpodobností určitou variací tohoto obecného mechanismu. Tento mechanismus vyžaduje základnu pro generování hydroxidový ion z vody, která bude fungovat jako nukleofil a zaútočit na fosfor ve fosfodiesterové vazbě. Rovněž je nutná Lewisova kyselina ke stabilizaci extra záporného náboje pentakoordinovaného přechodový stav fosfor, stejně jako obecný kyselý nebo kovový iont, který stabilizuje odstupující skupinu (3’-O−).
Struktura

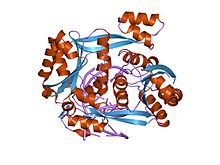
Ačkoli restrikční endonukleázy vykazují malou sekvenční podobnost, krystalové struktury ukazují, že všechny sdílejí vysoce podobné α / β jádro skládající se z šestivláknového β-list po boku pěti α-šroubovice, z nichž dva zprostředkovávají dimerizaci.[1] Toto jádro nese aktivní místo (katalytické centrum) a zbytky, které přicházejí do styku s DNA v hlavní drážka. BglII je jedinečný v tom, že jeho jádro α / β je rozšířeno o β-sendvičovou subdoménu, která má několik výstupků, které se táhnou směrem ven, aby uchopily DNA, což umožňuje BglII úplně obklopit molekulu DNA. Tato atypická vlastnost BglII navrhuje jedinečný pohyb závěsu pro vazbu a uvolnění DNA.[2]Srovnávací strukturní studie volného enzymu vs. BglKomplex II-DNA ukázal, že se enzym otevírá dramatickým pohybem podobným nůžkám, doprovázeným úplným přeskupením α-šroubovic na rozhraní dimeru. Tyto strukturní studie také odhalily, že v každém monomeru se sada zbytků snižuje nebo zvyšuje, aby alternativně izolovala nebo vystavovala zbytky aktivního místa. Tyto dramatické rozdíly ve struktuře ve volném vs. navázaném enzymu ještě nebyly pozorovány u žádné jiné restrikční endonukleázy a mohou pravděpodobně představovat nový mechanismus pro zachycení DNA, který se může rozšířit i na další proteiny, které obklopují DNA.[2][3]
Aktivní stránky
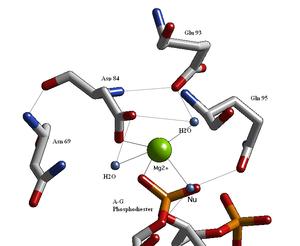
Strukturální studie endonukleáz odhalily podobnou architekturu aktivního místa se zbytky po slabé shodné sekvenci Glu / Asp- (X)9-20-Glu / Asp / Ser-X-Lys / Glu. BglAktivní místo II je podobné ostatním endonukleázám, po sekvenci Asp- (X)9-Glu-X-Gln. Na jeho aktivním místě leží dvojmocný kation kovu, nejpravděpodobněji Mg2+, který interaguje s Asp-84, Val-94, fosforylovým kyslíkem a třemi molekulami vody. Jedna z těchto molekul vody je schopna působit jako nukleofil díky své blízkosti k scissilnímu fosforylu (jeho orientace je fixována vodíkovou vazbou s amidovým kyslíkem postranního řetězce Gln-95[1][4]) a jeho kontakt s kationtem kovu (který snižuje jeho pKA, podporující nukleofilitu vody).
Viz také
- BamHI, nukleázový enzym z 'Bacillus amyloliquefaciens..
- FokI, nukleázový enzym z Flavobacterium okeanokoites
- EcoRI, nukleázový enzym z 'E-coli.
Reference
- ^ A b C d E F Lukacs CM, Kučera R, Schildkraut I, Aggarwal AK (únor 2000). „Pochopení neměnnosti restrikčních enzymů: krystalová struktura BglII a jeho DNA substrátu při rozlišení 1,5 A“. Přírodní strukturní biologie. 7 (2): 134–40. doi:10.1038/72405. PMID 10655616.
- ^ A b C Lukacs CM, Kučera R, Schildkraut I, Aggarwal AK (únor 2001). „Struktura volného BglII odhaluje bezprecedentní pohyb podobný nůžkám pro otevření endonukleázy“. Přírodní strukturní biologie. 8 (2): 126–30. doi:10.1038/84111. PMID 11175900.
- ^ Galburt EA, Stoddard BL (únor 2000). „Restrikční endonukleázy: jedna z těchto věcí není jako ostatní“. Přírodní strukturní biologie. 7 (2): 89–91. doi:10.1038/72450. PMID 10655603.
- ^ A b Pingoud A, Jeltsch A (září 2001). "Struktura a funkce restrikčních endonukleáz typu II". Výzkum nukleových kyselin. 29 (18): 3705–27. doi:10.1093 / nar / 29.18.3705. PMC 55916. PMID 11557805.